| |
| Med Sci (Paris). 2006 November; 22(11): 916–918. Published online 2006 November 15. doi: 10.1051/medsci/20062211916.PCSK9, du gène à
la protéine : un nouvel acteur dans l’homéostasie du cholestérol Marianne Abifadel,1* Jean-Pierre Rabès,2,3 Catherine Boileau,2,3 and Mathilde Varret2 1Inserm U781, Paris, France ; AP-HP, Hôpital Necker-Enfants Malades, 149, rue de Sèvres, 75743 Paris, France ; Université Paris 5, Faculté de médecine, Paris, France ; Université Saint-Joseph, Faculté de Pharmacie, BP11, 5076 Beyrouth, Liban 2Inserm U781, 75743 Paris, France ; Université Paris 5, 75005 Paris, France 3AP-HP, Hôpital Ambroise Paré, Laboratoire de Biochimie et de Génétique Moléculaire ; Université Versailles Saint-Quentin-en-Yvelines, UFR Médicale Paris Ile-de-France Ouest, 92104 Boulogne, France MeSH keywords: Cholestérol, Régulation de l'expression des gènes, Variation génétique, Homéostasie, Humains, Hypercholestérolémie, Mutation, Proprotein convertases, Biosynthèse des protéines, Serine endopeptidases |
L’hypercholestérolémie familiale, à transmission autosomique dominante (ADH), est l’une des maladies génétiques les plus fréquentes (1/500 sous sa forme hétérozygote). L’excès de cholestérol lié aux lipoprotéines de basse densité (LDL, low density lipoproteins) provoque des dépôts artériels à l’origine de plaques d’athérome, sources de complications cardiovasculaires graves. L’ADH est due à des mutations des gènes codant le récepteur des LDL (LDLR) ou son ligand l’apolipoprotéine B-100 (APOB). Nous avons identifié le troisième gène impliqué dans l’ADH, PCSK9, localisé en 1p32. Cela a été réalisé par approche de clonage positionnel et d’analyse de liaison dans des familles françaises dont l’hypercholestérolémie n’était liée à aucun des gènes LDLR ou APOB [
1]. Le gène PCSK9 (proprotein convertase subtilisin/kexin type 9) code une enzyme initialement nommée Narc-1 (neural apoptosis regulated convertase 1) puisque son ADNc fut cloné suite à sa surexpression dans des neurones en apoptose induite par une privation en sérum. Principalement exprimée dans le foie, l’iléon, le côlon, le rein et le système nerveux, Narc-1 est le 9e membre de la famille des proprotéines convertases, enzymes impliquées dans la protéolyse ciblée de précurseurs protéiques, tels que les prohormones au cours de leur processus sécrétoire. Synthétisée sous forme de préproprotéine de 692 acides aminés, préproNarc-1 perd son peptide signal pour donner un zymogène de 72 kDa (proNarc-1) qui subit un autoclivage dans le réticulum endoplasmique [
2]. Ses substrats ainsi que son rôle exact sont encore inconnus, cependant les variations de PCSK9 sont associées tant à l’hypercholestérolémie qu’à l’hypocholestérolémie. |
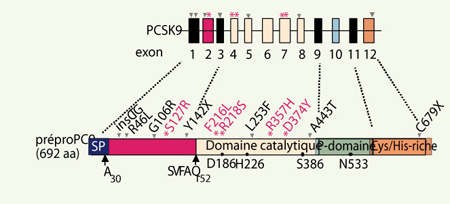
Mutations hypercholestérolémiantes de PCSK9 Nous avons identifié les deux premières mutations hypercholestérolémiantes de PCSK9 dans trois familles françaises recrutées grâce au Réseau national de recherche sur les hypercholestérolémies familiales qui regroupe treize centres sur le territoire français1,. La mutation p.S127R a été trouvée dans deux grandes familles, l’une originaire de Vendée et l’autre de Mayenne. La mutation p.F216L a été identifiée dans une famille française dont le proposant, décédé à l’âge de 49 ans d’un infarctus du myocarde, avait des taux de LDL-cholestérol au-delà de 3,5 g/l sans traitement [1]. Par la suite, nous avons rapporté les variations p.R218S et p.R357H dans deux familles françaises [
3]. Parallèlement, quelques mutations hypercholestérolémiantes ont été trouvées par différentes équipes. La mutation p.D374Y a été décrite dans une famille de l’Utah [
4], deux familles norvégiennes [
5] et quatre familles anglaises [
6]. Enfin, les variations p.R469W, p.R496W, p.N425S ont été retrouvées, associées à des mutations du gène LDLR, chez des patients présentant une hypercholestérolémie particulièrement sévère [3,
7] (Figure 1).  | Figure 1.
PCSK9, du gène à la protéine : variations hypo- et hypercholestérolémiantes et domaines protéiques. Les mutations hypercholestérolémiantes sont représentées en rose, les variations hypocholestérolémiantes en noir. Sont aussi représentés les sites de clivage potentiels, la triade catalytique et le site de glycosylation N533. |
|
Variations hypocholestérolémiantes de PCSK9 Parallèlement, des variations hypocholestérolémiantes de PCSK9 ont été rapportées. Les variations non-sens p.Y142X et p.C679X, fréquentes chez les Afro-américains (fréquence combinée de 2 %), sont associées à un faible taux de LDL-cholestérol [
8,
9]. D’autres variations p.R46L, p.L253F p.A443T [9], p.G106R [
10] et c.43-44insCTG [
11] sont retrouvées associées à des réductions des taux de LDL-cholestérol allant de 3,5 % à 30 % dans des études indépendantes (Figure 1). Par ailleurs, les variations IVS1-161C→T et p.I474V sont associés à des taux bas de LDL-cholestérol dans une population japonaise [
12]. L’étude de l’impact de trois de ces variations hypocholestérolémiantes sur l’incidence des maladies cardiovasculaires survenues sur une période de 15 ans a été réalisée dans une cohorte de 3 363 sujets afro-américains et 9 523 caucasiens âgés de 45 à 64 ans, issus de 4 communautés américaines [
13]. Les variations non-sens retrouvées avec une fréquence de 2,6 % chez les sujets afro-américains sont associées à une réduction des taux de LDL-cholestérol de 28 % ainsi qu’à une réduction des maladies cardiovasculaires de 88 % dans cette population, alors que la variation p.R46L retrouvée chez 3,2 % des sujets caucasiens est associée à une réduction des taux de LDL-cholestérol de 15 % et à une réduction des maladies cardiovasculaires de 47 % [13]. Cette étude conforte le rôle cardioprotecteur d’une réduction à long terme des taux de cholestérol, mais n’exclut pas un rôle protecteur direct de Narc-1. |
PCSK9 et homéostasie du cholestérol : un rôle à décrypter Le rôle exact de PCSK9 dans l’homéostasie du cholestérol n’est pas encore élucidé. L’effet principalement étudié de PCSK9 est de réguler la variation du taux de récepteurs des LDL à la surface cellulaire. Les mutations hypercholestérolémiantes entraînent une diminution de 23 % des récepteurs des LDL à la surface des cellules HepG2 transfectées par PCSK9 muté et une diminution de 38 % de l’internalisation des LDL. Inversement, les mutations hypocholestérolémiantes provoquent une augmentation des récepteurs des LDL en surface cellulaire de 16 % et une augmentation de l’internalisation des LDL de 35 % [
14]. Cette action de Narc-1 sur le récepteur des LDL est confirmée dans des modèles murins surexprimant, par infection adénovirale, PCSK9 normal ou porteur des mutations p.S127R et p.F216L. Ainsi, une augmentation (x2 à x5) des taux de cholestérol et de LDL-cholestérol, et une forte diminution des taux de récepteurs hépatiques des LDL sont observées chez les souris [
15]. Les souris PCSK9
−/− sont hypocholestérolémiques, avec des taux de cholestérol plasmatique 48 % inférieurs à ceux de souris témoins. Elles présentent une augmentation du nombre de récepteurs des LDL, une augmentation de la capture des LDL et une réponse plus importante au traitement par les statines [
16]. L’hypothèse issue de ces travaux positionne PCSK9 dans un processus de dégradation du récepteur des LDL au niveau du compartiment post-réticulum endoplasmique [15]. Enfin, PCSK9, sécrétée dans le plasma, semble capable d’agir à distance dans ce même processus [14]. Parallèlement à son impact sur le récepteur des LDL, PCSK9 agit en augmentant la biosynthèse hépatique des lipoprotéines riches en apo B-100, comme le prouvent les études cinétiques in vivo réalisées chez deux sujets porteurs de la mutations S127R [
17]. Par ailleurs, l’expression de PCSK9 est régulée par les facteurs de transcription SREBP grâce à un domaine de réponse aux stérols (SRE) dans son promoteur [15]. |
PCSK9, statines et nouveaux espoirs thérapeutiques Les statines, principale classe d’hypocholestérolémiants, sont des inhibiteurs de l’HMG-CoA réductase, enzyme clé de la synthèse du cholestérol. La diminution du cholestérol intracellulaire entraîne une activation de la voie des SREBP et donc l’augmentation de l’expression de différents gènes cibles, notamment du gène LDLR. PCSK9 étant aussi une cible des SREBP, son expression est induite par les statines [
18] et limiterait donc leur action en diminuant le nombre des récepteurs des LDL à la surface cellulaire. Cela est confirmé, chez les souris PCSK9
−/−, qui présentent une réponse plus importante au traitement par les statines [16]. En outre, certaines variations hypocholestérolémiantes de PCSK9 (p.R46L, p.N157K) seraient associées à une meilleure réponse aux statines [10]. Ces arguments soulignent l’importance thérapeutique des inhibiteurs de cette enzyme qui restent cependant à identifier. La découverte de PCSK9, troisième gène impliqué dans l’hypercholestérolémie à transmission autosomique dominante, a permis jusqu’à présent de lever le voile sur un nouvel acteur majeur impliqué dans la maladie et dans l’homéostasie du cholestérol. Elle met aussi en évidence des variations géniques responsables d’une importante variabilité inter-individuelle et inter-ethnique des taux de cholestérol. Cependant, il semble que PCSK9 ait encore beaucoup de secrets à livrer. L’identification de ses substrats permettra d’élucider le rôle exact de ce nouveau protagoniste dans le métabolisme et la régulation du cholestérol. D’éventuels inhibiteurs de Narc-1 pourraient potentialiser l’action hypocholestérolémiante des statines et constituer une nouvelle classe de molécules hypocholestérolémiantes. |
Les travaux de MAF ont été financés par la Fondation Lefoulon-Delalande, Institut de France. Ce projet est soutenu par l’attribution d’une allocation post-doctorale Région Ile-de-France, par un financement du GIS- Institut des Maladies Rares, de l’Université Paris 5, de l’ANR « Cardiovasculaire, obésité et diabète 2005 » et du Programme CEDRE.
|
Footnotes |
1. Abifadel M, Varret M, Rabes JP, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet 2003; 34 : 154–6. 2. Seidah NG, Benjannet S, Wickham L, et al. The secretory proprotein convertase neural apoptosis-regulated convertase 1 (NARC-1) : liver regeneration and neuronal differentiation. Proc Natl Acad Sci USA 2003; 100 : 928–33. 3. Allard D, Amsellem S, Abifadel M, et al. Novel mutations of the PCSK9 gene cause variable phenotype of autosomal dominant hypercholesterolemia. Hum Mutat 2005; 26 : 497. 4. Timms KM, Wagner S, Samuels ME, et al. A mutation in PCSK9 causing autosomal-dominant hypercholesterolemia in a Utah pedigree. Hum Genet 2004; 114 : 349–53. 5. Leren TP. Mutations in the PCSK9 gene in Norwegian subjects with autosomal dominant hypercholesterolemia. Clin Genet 2004; 65 : 419–22. 6. Naoumova RP, Tosi I, Patel D, et al. Severe hypercholesterolemia in four British families with the D374Y mutation in the PCSK9 gene : long-term follow-up and treatment response. Arterioscler Thromb Vasc Biol 2005; 25 : 2654–60. 7. Pisciotta L, Oliva CP, Cefalù AB, et al. Additive effect of mutations in LDLR and PCSK9 genes on the phenotype of familial hypercholesterolemia. Atherosclerosis 2006; 186 : 433–40. 8. Cohen J, Pertsemlidis A, Kotowski IK, et al. Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9. Nat Genet 2005; 37 : 161–5. 9. Kotowski IK, Pertsemlidis A, Luke A, et al. A spectrum of PCSK9 alleles contributes to plasma levels of low-density lipoprotein cholesterol. Am J Hum Genet 2006; 78 : 410–22. 10. Berge KE, Ose L, Leren TP. Missense mutations in the PCSK9 gene are associated with hypocholesterolemia and possibly increased response to statin therapy. Arterioscler Thromb Vasc Biol 2006; 26 : 1094–100. 11. Yue P, Averna M, Lin X, Schonfeld G. The c.43-44insCTG variation in PCSK9 is associated with low plasma LDL-cholesterol in a Caucasian population. Hum Mutat 2006; 27 : 460–6. 12. Shioji K, Mannami T, Kokubo Y, et al. Genetic variants in PCSK9 affect the cholesterol level in Japanese. J Hum Genet 2004; 49 : 109–14. 13. Cohen JC, Boerwinkle E, Mosley TH Jr, Hobbs HH. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354 : 1264–72. 14. Cameron J, Holla OL, Ranheim T, et al. Effect of mutations in the PCSK9 gene on the cell surface LDL receptors. Hum Mol Genet 2006; 15 : 1551–8. 15. Maxwell KN, Breslow JL. Proprotein convertase subtilisin kexin 9 : the third locus implicated in autosomal dominant hypercholesterolemia. Curr Opin Lipidol 2005; 16 : 167–72. 16. Rashid S, Curtis DE, Garuti R, et al. Decreased plasma cholesterol and hypersensitivity to statins in mice lacking Pcsk9. Proc Natl Acad Sci USA 2005; 102 : 5374–9. 17. Ouguerram K, Chetiveaux M, Zair Y, et al. Apolipoprotein B100 metabolism in autosomal-dominant hypercholesterolemia related to mutations in PCSK9. Arterioscler Thromb Vasc Biol 2004; 24 : 1448–53. 18. Dubuc G, Chamberland A, Wassef H, et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia. Arterioscler Thromb Vasc Biol 2004; 24 : 1454–9. |