À L’occasion du 40e anniversaire de la Faculté de Médecine et des Sciences de la Santé de l’Université de Sherbrooke (Québec, Canada), la partie magazine de ce numéro de m/s comporte plusieurs Nouvelles écrites par des chercheurs de cette prestigieuse Université. Ces Nouvelles sont identifiées par le logo de l’Université de Sherbrooke (S).
La douleur serait-elle sexiste ? Il semblerait que oui, cependant les données vont à l’encontre de la croyance populaire selon laquelle les hommes seraient moins résistants que les femmes à la douleur tel qu’en témoigne, par exemple, l’expression : « être frappé par une grippe d’homme » ! En effet, les femmes auraient des seuils de douleur inférieurs à ceux des hommes et moins de tolérance pour des stimuli intenses ; ainsi elles évalueraient un stimulus équivalent comme étant plus douloureux [ 1]. De plus, des maladies accompagnées de douleurs chroniques seraient plus fréquentes chez la femme que chez l’homme ; ce serait notamment le cas des maladies qui affectent le cou et la tête, d’origine musculosquelettique ou viscérale et celles d’étiologie auto-immune [ 2]. Plusieurs facteurs psychosociaux ou physiologiques ont déjà été pris en considération pour expliquer ces différences. Cependant, certaines données permettent de croire que les hormones sexuelles jouent un rôle dominant. En effet, les seuils de douleur et la prévalence de certaines maladies varient selon le statut hormonal de la personne, notamment chez la femme pendant le cycle menstruel.
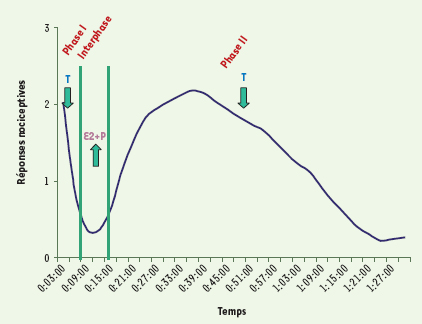
La douleur n’est pas une sensation qui suit une trajectoire simple et linéaire. La transmission nociceptive est un phénomène dynamique : il relève de mécanismes de facilitation et d’inhibition des afférences à l’échelle de tout le système nerveux. L’effet des hormones sexuelles pourrait donc s’exercer par l’intermédiaire des voies excitatrices ou inhibitrices de la douleur. Pour explorer l’action potentielle des hormones stéroïdiennes gonadiques sur la modulation de la douleur, nous avons appliqué le test à la formaline sur un animal. Ce test consiste à injecter une solution diluée de formaline dans la patte arrière du rat ce qui provoque une réponse nociceptive triphasique ; à une (première) phase nociceptive de quelques minutes succède une phase d’inhibition active, l’interphase, qui est suivie d’une (seconde) phase inflammatoire de plus d’une heure. Ce test présente l’avantage de mesurer des réponses d’ordre phasiques, toniques et d’inhibition endogène en une seule expérience (Figure 1).
| Figure 1.
Effet des hormones sexuelles femelles et mâle sur les réponses nociceptives à la suite d’un test à la formaline. Le test à la formaline se décompose en trois phases distinctes, une première phase excitatrice (phase I), une interphase inhibitrice et une seconde phase excitatrice (phase II). La testostérone (T) a un effet hypoalgésique sur les phases I (aiguë) et II (tonique) du test. Pour leur part, les hormones sexuelles femelles combinées, l’œstradiol (E2) et la progestérone (P), inversent le mécanisme d’inhibition observé au cours de l’interphase du test à la formaline [
3,
4]. |
Dans une première étude, nous avons comparé les réponses nociceptives de rats mâles ou femelles, intacts et gonadectomisés [3]. Nous avons constaté que les mâles présentent significativement moins de réponses nociceptives que les femelles. Cette différence est attribuable aux hormones sexuelles car une fois gonadectomisés, mâles et femelles produisent les mêmes réponses nociceptives. Nous pouvons donc conclure à des dimorphismes sexuels dans la modulation des différents mécanismes excitateurs et inhibiteurs des réponses nociceptives. Les hormones sexuelles femelles modulent spécifiquement l’interphase inhibitrice tandis que la testostérone influence les phases excitatrices sans affecter l’interphase.
Dans une seconde étude, nous avons déterminé le rôle hypoalgésique ou hyperalgésique des hormones sexuelles en administrant chacune d’entre elles (œstradiol, progestérone, la combinaison de ces deux hormones ou la testostérone) chez des rats gonadectomisés des deux sexes [4]. Nous avons établi que la testostérone a un rôle hypoalgésique à jouer dans la nociception, tandis que les hormones sexuelles femelles combinées, mais pas elles seules, sont plutôt responsables de la modulation d’un mécanisme inhibiteur de la douleur, mécanisme auquel la diminution des réponses nociceptives en interphase du test à la formaline est attribuable (Figure 1).
Il semble que certaines douleurs chroniques, plus fréquentes chez la femme que chez l’homme, seraient associées à une perturbation des mécanismes inhibiteurs (ou mécanismes de freinage) de la douleur plutôt qu’à un excès de nociception. C’était d’ailleurs l’hypothèse émise par notre équipe concernant une pathologie particulière, la fibromyalgie. Ce syndrome de douleur chronique se caractérise principalement par des douleurs diffuses, une sensibilité exquise aux points tendres, de la fatigue et des troubles du sommeil [ 5]. La fibromyalgie est d’ailleurs beaucoup plus fréquente chez la femme que chez l’homme (1H/9F) et les symptômes de cette pathologie sont plus importants pendant la période périmenstruelle.
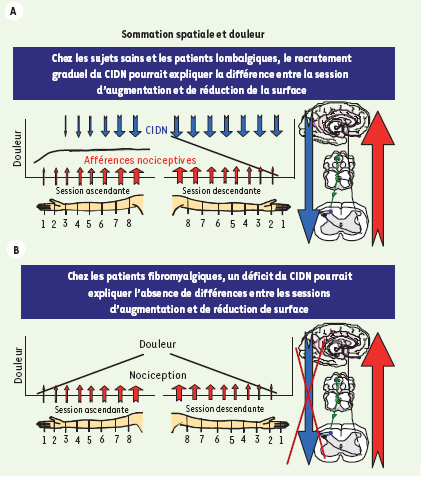
Afin de vérifier l’hypothèse d’un déficit des systèmes inhibiteurs de la douleur, nous avons utilisé le test de sommation spatiale soit l’immersion séquentielle d’une surface de plus en plus grande (session ascendante) ou de plus en plus petite (session descendante) du bras dans l’eau froide (12ºC). Nous savons qu’au cours de la session ascendante, nous recrutons graduellement les contrôles inhibiteurs diffus nociceptifs (CIDN), tandis qu’ils sont recrutés à leur maximum au début de l’immersion lors de la session descendante (Figure 2) [ 6]. Grâce à l’utilisation du test de sommation spatiale, nous avons observé un déficit des mécanismes inhibiteurs descendants chez les patients fibromyalgiques, mais pas chez les patients qui souffrent de douleurs plus localisées comme la lombalgie chronique [ 7]. Ces mécanismes seraient d’ailleurs opioïdergiques étant donné que chez des sujets sains, il est possible de mimer cette déficience par l’injection de naloxone, un antagoniste non spécifique des opioïdes [ 8].
| Figure 2.
Résultats. Dans cette représentation schématique de nos résultats [7], l’augmentation graduelle de la surface stimulée (session ascendante) recrute à la fois des afférences nociceptives et inhibitrices descendantes (CIDN) chez les sujets sains et lombalgiques (A), mais pas chez les patients fibromyalgiques (B). Ces données laissent supposer un déficit des mécanismes inhibiteurs descendants, spécifique de certains types de douleurs chroniques, dont la fibromyalgie. |
Ces études nous permettent de conclure que certaines douleurs sont dépendantes d’un déficit des mécanismes endogènes de contrôle de la douleur. De plus, les hormones sexuelles ont très probablement un rôle à jouer sur les mécanismes excitateurs et inhibiteurs de la douleur. La testostérone aurait un rôle protecteur, rôle qui serait d’ailleurs phylogénétiquement conservé, car la testostérone est hypoalgésique non seulement chez les mammifères, mais également chez certains oiseaux [ 9]. Les hormones sexuelles femelles, pour leur part, auraient un effet modulateur sur les mécanismes inhibiteurs de la douleur. On peut donc croire que certaines pathologies qui s’accompagnent de douleur chronique sont reliées à des déficiences hormonales produisant des déficiences de mécanismes de freinage de la douleur.
Nous pouvons donc imaginer que, dans un futur pas très lointain, un médecin devra non seulement évaluer les mécanismes excitateurs de la douleur chez un patient atteint de douleur chronique mais également l’état hormonal de la personne. Nous ne sommes peut-être plus très loin des analgésiques roses ou bleus !