La protéine prion (PrP) a mauvaise réputation. Il faut dire que les résultats des recherches scientifiques autant que les événements des actualités où elle se trouve mêlée, lui sont rarement favorables. En effet, elle exerce un rôle central dans l’apparition et la propagation de maladies neurodégénératives infectieuses appelées encéphalopathies spongiformes subaiguës transmissibles (ESSTs), ou encore maladies à prions [ 1]. Ces maladies affectent aussi bien les animaux que les hommes. La tremblante du mouton et de la chèvre, ainsi que l’encéphalopathie spongiforme bovine (ou vache folle) en sont quelques exemples chez les animaux. Chez l’homme, il existe trois catégories d’ESST [1]. Les formes sporadiques représentent environ 85 %, et incluent la maladie de Creutzfeldt-Jakob et le syndrome d’insomnie fatale. Les formes génétiques ou familiales sont associées à des mutations dans le gène Prnp qui code pour PrP. Il existe aussi des formes familiales de Creutzfeldt-Jakob et d’insomnies fatales. La troisième catégorie, qui a le moins d’incidence mais qui est la plus médiatisée, inclut des ESST transmises à la suite de l’ingestion de viandes animales contaminées (maladie variante de Creutzfeldt-Jakob), de pratiques neurochirurgicales utilisant des instruments contaminés ou encore de rituels cannibales [1].
Les ESST sont caractérisées par l’accumulation dans le cerveau d’une forme anormale de la protéine. Par souci de simplification, cette forme associée à la maladie est souvent appelée « Scrapie » (PrPSc), terme anglais qui désigne la maladie de la tremblante. Contrairement à la forme normale de PrP appelée forme cellulaire ou PrPC, PrPSc possède une structure qui lui confère des caractéristiques biochimiques uniques et totalement opposées à celles de PrPC [ 2]. PrPSc est présente dans des agrégats extracellulaires insolubles dans des détergents non-ioniques ; par opposition, PrPC ne forme pas d’agrégats et est soluble. En général, les agrégats constitués de PrPSc sont aussi résistants à un traitement protéolytique. Cette propriété est d’ailleurs utilisée pour diagnostiquer post-mortem la pathologie de manière irréfutable. Outre la formation de ces agrégats moléculaires, les ESST sont aussi caractérisées par l’apparition de vacuoles cytoplasmiques qui donnent un aspect spongiforme au cerveau, et par la mort prématurée des neurones. Actuellement, l’issue des ESST est toujours fatale.
Les agents infectieux responsables de la transmission des ESST, et que l’on appelle prions, ne sont autres que des agrégats moléculaires de PrPSc. Et l’on sait désormais que les particules les plus infectieuses sont composées d’agrégats de 14 à 28 molécules de PrPSc [ 3]. Comme tout agent infectieux, PrPSc a la capacité de se répliquer. Sa stratégie, qui consiste à interagir avec PrPC pour la contraindre à adopter la conformation PrPSc (Figure 1), est très rare dans le monde vivant.
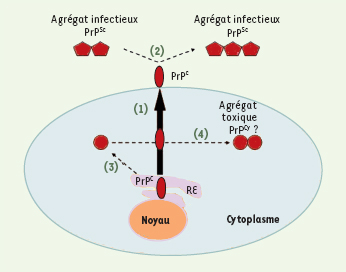
| Figure 1.
Agrégats infectieux et agrégats toxiques. La protéine prion cellulaire PrP
C
est normalement acheminée jusqu’à la membrane plasmique (1), en passant par le réticulum endoplasmique (RE) et l’appareil de Golgi (non représenté). La membrane plasmique est donc la destination physiologique de PrPC. La présence de formes anormalement structurées PrPSc et PrPCy entraîne la formation d’agrégats moléculaires infectieux et toxiques. Agrégats infectieux ou PrPSc
: contrairement à PrPC, la forme infectieuse PrP
sc
est résistante à un traitement protéolytique. Une fois introduite dans l’organisme, elle interagit avec la protéine normale PrP
C
à la membrane plasmique, et entraîne la conversion PrP
C→PrPSc
(2). Le résultat est l’amplification des agrégats infectieux. Agrégats toxiques ou PrPCy : lorsque PrP
C
ne parvient pas à adopter une conformation structurale normale dans le RE, elle est rétrotransloquée vers le cytoplasme sous la forme PrP
Cy
(3). Comme PrPSc, PrPCy est résistante à un traitement protéolytique. PrP
Cy
détourne PrP
C
de la voie de sécrétion dans le cytoplasme. Une fois dans le cytoplasme, PrPC adopte à son tour la conformation PrPCy et s’associe aux agrégats déjà présents (4). Les agrégats qui en résultent pourraient être responsables de la neurotoxicité au cours des maladies à prions. |
L’histoire des travaux qui a mené à l’identification de PrPSc comme étant l’agent infectieux des ESST représente une véritable saga scientifique qui s’est déroulée sur de nombreuses années [2]. Alors qu’il était relativement admis que PrPSc était aussi la molécule toxique à l’origine de la mort prématurée des neurones, des modèles animaux d’ESST ont permis de démontrer que la présence de quantités très importantes de PrPSc ne cause pas nécessairement la mort neuronale [ 4– 6]. La particule infectieuse PrPSc est connue, mais la molécule responsable de la mort neuronale reste toujours à identifier. Parmi les coupables potentiels [ 7– 8], il existe une forme cytoplasmique de PrPC.
PrPC est une glycoprotéine normalement présente à la surface des neurones, attachée à la membrane plasmique par une ancre glycosylphosphatidylinositol. Cependant, lorsque la protéine n’arrive pas à se replier correctement après sa synthèse, elle est détournée de la voie de sécrétion vers le cytoplasme, de sorte qu’elle est dégradée par le protéasome, une usine protéolytique moléculaire [ 9]. Si le protéasome est inhibé, la concentration cytoplasmique de PrPC augmente et devient toxique. Des souris transgéniques qui expriment la protéine exclusivement dans le cytoplasme développent une maladie neurodégénérative [8]. Il est donc important de déterminer le mécanisme de toxicité de la forme cytoplasmique de PrPC.
Nous avons reproduit un modèle cellulaire dans lequel la protéine est exprimée exclusivement dans le cytoplasme (PrPCy). Dans ce modèle, l’accumulation de PrPCy se traduit par la formation spontanée d’agrégats selon un processus très organisé [ 10]. Les agrégats se forment sous le cytosquelette cortical d’actine. Ces « micro-agrégats » sont de taille modeste, inférieure à 0,4 µm, à peine visible par immunofluorescence. Puis ils sont transportés sur les microtubules vers le centrosome, où ils se concentrent pour former une masse protéique de très grande taille (5-10 µm), que l’on peut qualifier de « macro-agrégat ». Les mitochondries désertent littéralement le cytoplasme pour se concentrer autour des agrégats. Dans le cytoplasme, les agrégats forment des pièges pour PrPC. En effet, dans des cellules exprimant les deux formes PrPC et PrPCy, les agrégats ont la capacité de détourner PrPC durant son trajet vers la membrane plasmique. PrPC vient à son tour s’agréger dans le cytoplasme pour apporter sa contribution aux agrégats (Figure 1). Cela suggère que les agrégats cytoplasmiques ont la capacité de se perpétuer en recrutant PrPC. L’ensemble de ces perturbations cytoplasmiques diminue fortement la viabilité des cellules en culture [10].
De tels agrégats cytoplasmiques seraient-ils responsables de la mort neuronale au cours des ESST ? Bien que de tels agrégats intracellulaires de PrPC ne soient pas toujours décelés à l’autopsie, on ne peut pas exclure la possibilité que des agrégats cytoplasmiques de faible taille et donc non détectés au cours des examens pathologiques, soient présents. La cause de la mort neuronale au cours des ESSTs pourrait donc se cacher derrière des agrégats cytoplasmiques de la protéine prion (Figure 1).