| |
| Med Sci (Paris). 2006 December; 22(12): 1025–1028. Published online 2006 December 15. doi: 10.1051/medsci/200622121025.Signalisation calcique cytosolique et nucléaire et réponses des plantes aux stimulus biotiques et abiotiques Tou-Cheu Xiong,1,2 Stéphane Bourque,3,2 Christian Mazars,1,2 Alain Pugin,3,2 and Raoul Ranjeva1,2* 1UMR CNRS-UPS 5546, Signaux et messages cellulaires chez les végétaux, Pôle de Biotechnologie Végétale, 24, chemin de Borde Rouge, BP 42617, Auzeville, 31326 Castanet Tolosan, France 2GDR 2688, Calcium et régulation de l’expression des gènes en contexte normal et pathologique 3UMR Plante-Microbe-Environnement INRA 1088/CNRS 5184/Université de Bourgogne, 17, rue Sully, BP 86510, 21065 Dijon Cedex, France MeSH keywords: Signalisation du calcium, Noyau de la cellule, Cytosol, Mannitol, Phénomènes physiologiques des plantes, Plantes |
Pour convertir les variations d’un paramètre de leur environnement (stimulus) en réponse biologique adaptative, les plantes, comme tous les êtres vivants et, en particulier, les eucaryotes, mettent en jeu des « modules » de signalisation bien régulés. L’une des étapes-clés de ce processus complexe est le codage, par la cellule, d’une information physique ou chimique dans un langage moléculaire qui prend en considération la nature, la force et la durée du stimulus. Ce codage est assuré par un nombre restreint de « seconds messagers » qui interviennent dans le fonctionnement cellulaire de l’organisme, de la fécondation à sa mort [
1]. L’un de ces composés est l’ion Ca2+ qui, à l’état libre, est présent à des concentrations sub-micromolaires dans le cytosol ou dans les compartiments métaboliquement actifs alors que le calcium cellulaire total atteint des concentrations millimolaires. Cette homéostasie résulte de l’équilibre entre le pouvoir tampon cellulaire, la séquestration du Ca2+ dans des organites intracellulaires et/ou son efflux vers le milieu extérieur grâce à des pompes d’une part, et la sortie du Ca2+ de ces réservoirs ou son entrée du milieu extérieur via des canaux, d’autre part [
2]. Le maintien de cette homéostasie est crucial car à des concentrations élevées, le Ca2+ exerce un effet cytotoxique en provoquant, par exemple, la précipitation des ions phosphates. De très nombreux stimulus rompent l’homéostasie calcique et, ce faisant, déclenchent des effets biochimiques en cascade, participant au décodage des signaux perçus par les cellules et aboutissant à l’expression de gènes. En raison de cet effet pléiotrope, le Ca2+ peut donc être un simple interrupteur, non spécifique, dans la signalisation cellulaire végétale [
3]. Toutefois, de nombreux résultats expérimentaux montrent maintenant que les variations calciques (Δ[Ca2+]) ne s’effectuent pas de manière stéréotypée mais selon une logique qui conduit à une « signature » ou « empreinte » propre à chaque stimulus et réponse [
4]. Ce sont les composantes spatiales et temporelles de cette signature que nous allons considérer ici, en prenant des exemples montrant qu’elles spécifient la réponse des cellules végétales à des stimulus abiotiques ou biotiques. |
Le taux de calcium libre est susceptible de varier dans les différents compartiments de la cellule végétale Le développement des méthodes de mesure des concentrations en Ca2+ libre chez les plantes, surtout depuis l’utilisation de l’aequorine recombinante, a permis de suivre in situ les Δ[Ca2+]. Cette protéine dont la bioluminescence est fonction de [Ca2+] a été adressée sélectivement dans les différents organites de la cellule. Grâce à cette méthodologie, on a pu montrer que le taux de calcium libre (Ca2+ second messager) variait spécifiquement dans le cytosol, les mitochondries, les chloroplastes ou le noyau de la cellule végétale, en réponse à différents stimulus [
5,
6]. Ces données montrent d’une part, que les organites (vacuole et paroi mises à part) ne sont pas de simples réservoirs de Ca2+ mobilisable pour contrôler le niveau calcique du cytosol et posent, d’autre part, la question de la gestion et du rôle du Ca2+ messager dans les différents compartiments où se déroulent aussi des processus Ca2+-dépendants. Dans cet article, nous nous limiterons strictement aux compartiments cytosolique [Ca2+]cyt, qui est le plus étudié, et nucléaire [Ca2+]nuc, siège du contrôle de l’expression des gènes. |
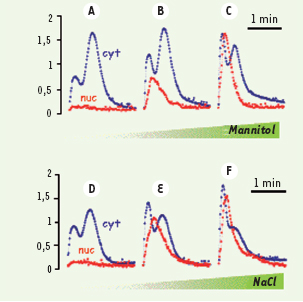
Le taux de calcium libre dans le cytosol varie de manière codifiée selon les stimulus perçus par la cellule Comme l’illustre la Figure 1, l’information véhiculée par le Ca2+ est codée selon différents paramètres : amplitude, durée, fréquence et cinétique. Ainsi, un choc hyperosmotique provoque une Δ[Ca2+]cyt biphasique et transitoire, chez les cellules de tabac. De plus, pour une même osmolarité (520 mosmol), le rapport entre la première et la deuxième vague calcique qui est de 0,48 quand on utilise un composé neutre (le mannitol) passe à une valeur supérieure à 1 quand l’osmoticum est le NaCl. Dans les deux cas, les Δ[Ca2+]cyt qui peuvent atteindre des concentrations supérieures à 1µM s’arrêtent dans les 2 minutes qui suivent l’application du stimulus. Des Δ[Ca2+] cytosoliques et nucléaires différentielles sont également obtenues quand des cellules sont confrontées à des molécules d’origine microbienne appelées « éliciteurs » [
7]. Ces composés induisent des réactions de défense qui protègent les plantes contre un large spectre de microorganismes pathogènes. Parmi ces réactions de défense, la réaction hypersensible est une forme de mort cellulaire programmée des cellules de l’hôte au point d’inoculation qui bloque le développement du pathogène. Ainsi, des éliciteurs « nécrosants » comme le polypeptide secrété par Phytophthora cryptogea, la cryptogéine, provoque une seconde élévation soutenue pendant plusieurs heures du taux de Ca2+ libre dans le cytosol qui conduit à la mort cellulaire [7]. Au contraire, des éliciteurs « non nécrosants », comme divers oligosaccharides, entraînent des Δ[Ca2+]cyt très transitoires Avec les différents éliciteurs utilisés, l’amplitude des élévations calciques cytosoliques et nucléaires dépend de la concentration utilisée en éliciteur. De plus, ce système biologique se « désensibilise » à la suite d’une seconde confrontation avec le même signal, mais demeure apte à générer des augmentations calciques appropriées à un stimulus différent.  | Figure 1.
Variations calciques cytosoliques (Cyt) et nucléaires (Nuc) après stimulation, par du mannitol (A-C) ou du NaCl (D-F), de cellules de tabac BY-2 exprimant l’apoaequorine dans le noyau ou dans le cytosol. Les variations d’osmolarité sont de 300 mosmol (A, D) 520 mosmol (B, E) ou 880mosmol (C, F) (adaptée de [ 6] avec l’autorisation des Éditions Elsevier). |
 | Figure 2.
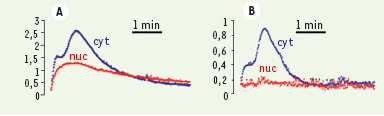
Réponses calciques différentielles cytosolique (Cyt) et nucléaire (Nuc) de cellules de tabac BY-2 stimulées soit par un choc hypo-osmotique (A) soit par un choc hyperosmotique (B). La variation d’osmolarité est de 150 mosmol, dans les deux cas (adaptée de [ 6] avec l’autorisation des Éditions Elsevier). |
Enfin, les Δ[Ca2+]cyt peuvent se présenter sous forme d’oscillations dont la fréquence est cruciale. Ainsi, la fermeture des stomates (structures importantes dans les échanges d’eau et de gaz entre la plante et son milieu extérieur) induite par une hormone végétale, l’acide abscissique, implique une série d’oscillations calciques dans le cytosol. Le mutant det 3 de Arabidopsis thaliana, affecté dans l’aptitude à séquestrer le Ca2+ dans les pools internes, est incapable d’engendrer ces oscillations et de fermer les stomates. La réponse biologique est restaurée en créant artificiellement des oscillations calciques ayant une amplitude et une fréquence identiques à celles des oscillations naturelles [
8]. Ces données montrent donc que la Δ[Ca2+] est porteuse d’une information codée dont l’amplitude est fonction de l’intensité de la stimulation. |
Le noyau et le cytosol contribuent à déterminer une signature calcique cellulaire Chez les végétaux, comme chez les animaux, le noyau héberge de nombreux chaînons de la voie de signalisation calcique (protéines affines comme la calmoduline ou CaM, facteurs de transcription CaM-dépendants, protéines kinases…). Il n’est donc pas étonnant que l’on observe des variations calciques dans cet organite dont on pensait qu’elles reflétaient les fluctuations cytosoliques. Or, de nombreux faits expérimentaux vont à l’encontre de cette hypothèse. Ainsi, quand les cellules de tabac sont placées en situation hypotonique par rapport au milieu de culture standard (-150 mosmol), le taux de Ca2+ libre augmente dans le cytosol et dans le noyau. En revanche, en situation hypertonique (+150 mosmol) l’élévation du Ca2+cyt ne s’accompagne pas de variations du Ca2+nuc [6]. De même, alors que la cryptogéine et les oligosaccharides induisent une augmentation de [Ca2+]cyt, seule la cryptogéine provoque des Δ[Ca2+]nuc importantes [
9]. L’étude cinétique montre, par ailleurs, que les Δ[Ca2+]nuc se produisent tardivement par rapport au cytosol, ce qui exclut une simple diffusion et pose le problème des mécanismes de la production des signaux calciques nucléaires. Dans le cas de la réponse à la cryptogéine, les Δ[Ca2++]nuc sont sous contrôle d’autres seconds messagers : IP3, H2O2 mais pas NO ni ADPRc. |
Le noyau est capable d’engendrer des signaux calciques indépendamment du cytosol Le noyau est délimité par une double membrane ponctuée par des pores composés de complexes protéiques dont la limite d’exclusion est de 40 kDa [
10]. On peut donc penser que les Δ[Ca2+]nuc correspondent à une diffusion du Ca2+cyt. Or, des noyaux, morphologiquement intacts, isolés de cellules de tabac sont imperméables au calcium présent à différentes concentrations dans le milieu d’incubation mais répondent par des Δ[Ca2+] dans le nucléoplasme, à des composés chimiques (mastoparan), à l’élévation de température ou à une stimulation mécanique. Ils sont donc capables de convertir directement un stimulus en Δ[Ca2+] et le pH du milieu joue un rôle essentiel. Ainsi, à pH légèrement alcalin, les Δ[Ca2+]nuc dépendent strictement de la température, la stimulation mécanique restant sans effet. À l’inverse, à pH acide, la stimulation mécanique provoque des Δ[Ca2+]nuc qui suivent la fréquence des stimulus alors que l’élévation de la température reste sans effet. Les processus sont parfaitement réversibles en fonction du pH du milieu. La combinaison d’approches basées sur la pharmacologie et sur la modélisation suggère fortement que le noyau de la cellule végétale est capable de réguler les Δ[Ca2+]nuc grâce à l’action coordonnée de pompes et de canaux qui, localisés sur la membrane interne de l’enveloppe nucléaire, permettent d’injecter le calcium dans le nucléoplasme ou de le séquestrer dans l’espace intermembranaire du noyau [
11]. Dans ce système « clos » les variations calciques provoquent des modifications du profil de protéines phosphorylées, ce qui suggère la possibilité d’un couplage direct entre stimulation externe et réponse nucléaire. Dans la cellule, les échanges d’informations entre cytosol et noyau sont constants et, en terme de signalisation calcique, ces deux compartiments ne sont certainement pas déconnectés. Au contraire, ils pourraient participer, tous deux, à déterminer une « signature calcique » spécifiant un stimulus et une réponse biologique chez les plantes. En conclusion, comme tous les eucaryotes, la cellule végétale utilise le calcium comme second messager dans de nombreux processus biologiques. Le codage obéit, pour l’essentiel, aux mêmes lois que celles mises en évidence notamment chez les animaux mais certains systèmes de décodage (calcium-dependent protein kinases, CaM-like) sont propres aux plantes. L’une des originalités du végétal est aussi la capacité du noyau isolé à percevoir des stimulus et à les convertir en variations de concentration en calcium nucléoplasmique indépendamment du cytosol. Cette propriété illustre l’autonomie (au moins partielle) du noyau en matière de gestion de l’homéostasie calcique qui fait débat dans le domaine général de la biologie cellulaire. Le dialogue entre cytosol et noyau en matière de signalisation calcique et de régulation d’expression génique et/ou de réorientation du métabolisme chez les plantes sera l’un des thèmes de recherche privilégiés dans le futur. |
1. Berridge MJ, Lipp P, Bootman MD. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol 2000; 1 : 11–21. 2. Berridge M, Bootman MD, Roderick L. Calcium signalling: dynamics, homeostasis and remodelling. Nat Rev Mol Cell Biol 2003; 4 : 517–29. 3. Scrase-Field SA, Knight MR. Calcium: just a chemical switch ? Curr Opin Plant Biol 2003; 6 : 500–6. 4. McAinsh MR, Hetherington AM. Encoding specificity in Ca2+ signalling systems. Trends Plant Sci 1998; 3 : 32–6. 5. Knight MR, Campbell AK, Smith SM, Trewavas AJ. Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium. Nature 1991; 352 : 524–6. 6. Pauly N, Knight MR, Thuleau P, et al. The nucleus together with the cytosol generates patterns of specific cellular calcium signatures in tobacco suspension culture cells. Cell Calcium 2001; 30 : 413–21. 7. Lecourieux D, Mazars C, Pauly N, et al. Analysis and effects of cytosolic free calcium increases in response to elicitors in Nicotiana plumbaginifolia cells. Plant J 2002; 14 : 2627–41 8. Allen GJ, Chu SP, Schumacher K, et al. Alteration of stimulus-specific guard cell calcium oscillations and stomatal closing in Arabidopsis det3 mutant. Science 2000; 289 : 2338–42. 9. Lecourieux D, Lamotte O, Bourque S, et al. Proteinaceous and oligosaccharidic elicitors induce different calcium signatures in the nucleus of tobacco cells. Cell Calcium 2005; 38 : 527–38. 10. Perez-Terzic C, Jaconi M, Clapham DE. Nuclear calcium and the regulation of the nuclear pore complex. Bioessays 1997; 19 : 787–92. 11. Xiong TC, Jauneau A, Ranjeva R, Mazars C. Isolated plant nuclei as mechanical and thermal sensors involved in calcium signalling. Plant J 2004; 40 : 12–21. |