| |
| Med Sci (Paris). 2006 December; 22(12): 1035–1037. Published online 2006 December 15. doi: 10.1051/medsci/200622121035.Les TRPV, des canaux qui vous donnent soif ! Reza Sharif Naeini, Sorana Ciura, and Charles W. Bourque* Départements de neurologie-neurochirurgie et de médecine à l’Université McGill, Centre de recherches en neurosciences L7-216, Division de neurologie, Hôpital Général de Montréal et Université McGill, 1650, avenue Cedar, Montréal (Québec), H3G 1A4 Canada MeSH keywords: Animaux, Coeur, Homéostasie, Humains, Souris, Souris knockout, Canaux cationiques TRPV, Soif, Équilibre hydroélectrolytique |
Il y a plus de cent ans Claude Bernard énonçait que la « fixité du milieu intérieur » était une condition nécessaire à la « vie libre et indépendante » [
1]. Tel qu’il l’avait anticipé, il est maintenant établi que la plupart des mécanismes homéostatiques ont pour but essentiel de maintenir la constance des paramètres physico-chimiques des fluides corporels. La pression osmotique du sérum, représentant la concentration des substances dissoutes dans le sang, figure de façon proéminente parmi les paramètres les plus fortement défendus par l’organisme. Les déviations aiguës et significatives (> 10%) de l’osmolarité sanguine entraînent des changements du volume cérébral qui peuvent provoquer une progression de désordres neurologiques : migraine, confusion, convulsions, coma et mort. Les mammifères évitent normalement ces conséquences en corrigeant les fluctuations osmotiques de façon précoce par des modulations concordantes de la soif et de la libération d’hormone antidiurétique (vasopressine) [
2]. L’état hyper-osmotique est compensé par une augmentation de la soif et de la sécrétion de vasopressine pour accroître la rétention d’eau par le rein. Réciproquement, l’hypo-osmolarité est corrigée par l’inhibition de la soif et de la libération de vasopressine. Bien que l’existence de cette régulation soit maintenant établie, les mécanismes moléculaires qui assurent cette régulation demeurent inconnus. Deux études récentes nous ont permis de démontrer qu’un produit du gène codant pour le canal ionique transient receptor potential vanilloid (TRPV) de type 1 (TRPV1) est nécessaire pour installer le processus de transduction des osmorécepteurs cérébraux et pour susciter l’activation de la soif et de la libération de vasopressine. |
Les osmorécepteurs au cœur de l’homéostasie hydrominérale La coordination des mécanismes d’osmorégulation est réalisée dans le cerveau et dépend de l’existence de neurones ayant la capacité de détecter les changements de pression osmotique qui surviennent dans leur environnement immédiat. Ces osmorécepteurs sont localisés principalement dans la partie antérieure de l’hypothalamus, notamment dans l’organe vasculaire de la lame terminale (OVLT) [2]. Nos mesures électrophysiologiques chez des souris ont montré que les osmorécepteurs déclenchent spontanément des potentiels d’action en situation isotonique, et que la fréquence de cette activité électrique diminue en présence d’un milieu hypotonique et augmente en situation hypertonique [
3]. Ces changements de la fréquence des potentiels d’action servent à faire connaître l’état osmotique de l’organisme à d’autres groupes de neurones plus directement responsables du contrôle de la soif ou de la libération de vasopressine [2]. Par exemple, il a été montré que des changements dans la libération de glutamate par les terminaisons axoniques des neurones de l’OVLT, contribuent à la modulation de l’activité des neurones produisant la vasopressine dans le noyau supra-optique (NSO) [2]. De surcroît, les neurones du NSO sont aussi eux-mêmes des osmorécepteurs [
4], si bien que le contrôle osmotique de leur activité électrique est prescrit par une combinaison de facteurs notamment l’osmosensibilité intrinsèque, la libération de glutamate par les neurones de l’OVLT et des interactions neuro-gliales en association avec la taurine [2,
5]. |
Le mécanisme cellulaire de l’osmoréception Le mécanisme par lequel la transduction osmotique par les osmorécepteurs se produit a été mis en évidence par des expériences électrophysiologiques sur des neurones isolés à partir de l’OVLT et du NSO de rats et de souris. Il a été montré que l’excitation de ces cellules par l’hyperosmolarité résulte de l’activation de canaux ioniques perméables aux ions Na+, K+ et Ca2+ [
6]. L’ouverture de ces canaux induit un courant transmembranaire entrant causant une dépolarisation du neurone et une augmentation de la fréquence de décharge des potentiels d’action. L’augmentation de la probabilité d’ouverture du canal transducteur se produit de concert avec la réduction de volume qui accompagne un stimulus hypertonique. Inversement, la probabilité d’ouverture décroît pendant l’augmentation de volume produite en état hypotonique. Les mécanismes par lesquels les changements de volume maîtrisent la probabilité d’ouverture demeurent inconnus, mais pourraient être liés à la mécanosensibilité intrinsèque du canal [4]. L’identification éventuelle des gènes codant pour le canal osmotransducteur permettra d’améliorer notre compréhension des mécanismes par lesquels les changements d’osmolarité contrôlent ce canal ionique, et de révéler comment les mutations de ces gènes pourraient contribuer à susciter des pathologies d’homéostasie hydrominérale [
7]. |
Les TRPV : des canaux qui vous donnent soif ! Une étape importante a été atteinte par la découverte qui a établi que certains membres de la famille de canaux cationiques codés par les gènes TRPV peuvent être modulés par les changements d’osmolarité et peuvent contribuer à la bonne marche de l’osmorégulation. Les gènes TRPV2 et TRPV4, par exemple, sont exprimés chez les osmorécepteurs [
8], et des stratégies d’expression hétérologue ont montré que les canaux homomultimériques formés par ces gènes produisent des canaux qui peuvent être activés par l’hypo-osmolarité [
9]. Bien que ce phénotype soit l’inverse de celui du canal propre aux osmorécepteurs, la caractérisation de ces gènes a permis néanmoins de mettre en évidence une première famille de canaux cationiques modulables par l’osmolarité. Il demeure possible que des produits des gènes TRPV2 et TRPV4 puissent contribuer à la constitution du canal transducteur propre aux osmorécepteurs. En effet, il a été montré que l’inactivation du gène TRPV4 atténue la modulation de la soif et la libération de vasopressine induites par la stimulation osmotique [8]. Nos deux études récentes ont aussi démontré que l’inactivation du gène TRPV1 atténue la stimulation de la soif [3] et la libération de vasopressine [
10] induites par l’hyperosmolarité plasmatique. Conséquemment, l’osmolarité du sérum de souris chez lesquelles le gène TRPV1 a été inactivé (TRPV1−/−
) dépasse largement (> 3%) celle des souris normales. Ces observations ont motivé l’étude du rôle potentiel du TRPV1 dans l’osmoréception. En combinant la technique du RT-PCR et le marquage immunohistochimique, nous avons récemment établi que les neurones du NSO expriment un variant d’épissage du TRPV1 qui produit une protéine dont la partie aminoterminale est tronquée. L’analyse électrophysiologique des cellules du NSO et de l’OVLT obtenus de souris TRPV1−/−
, nous a permis de conclure que cette protéine tronquée peut avoir à jouer un rôle dans l’osmosensibilité de ces cellules. En effet, bien que l’hyperosmolarité entraîne toujours une réduction du volume cellulaire, des osmorécepteurs isolés de l’OVLT [3] et du NSO [10] des souris transgéniques TRPV1−/−
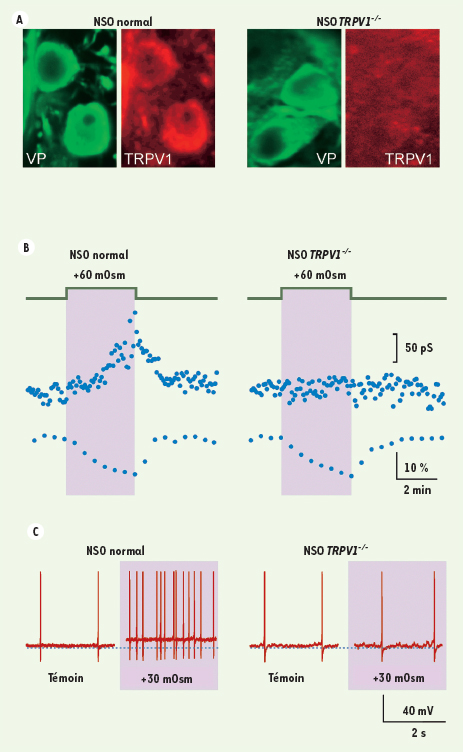
, celle-ci ne s’accompagne pas de l’augmentation de la conductance membranaire, ni de la dépolarisation, ni du changement de la fréquence de décharge des potentiels d’action observés chez les souris témoins (Figure 1). L’absence de produits du gène TRPV1 semble donc empêcher soit la production du canal osmotransducteur, sa localisation membranaire, ou encore son contrôle par les changements du volume cellulaire. Les études à venir nous permettront de mieux comprendre comment les canaux TRPV contribuent à déclencher l’osmosensibilité des osmorécepteurs, et à assurer la stabilité du milieu intérieur.  | Figure 1.
A. Absence d’expression de protéine TRPV1 (marquage rouge) dans les neurones du NSO contenant la vasopressine (VP, marquage vert) chez les souris TRPV1−/−
. B. L’augmentation de conductance causée par la réduction de volume associée à l’hyperosmolarité est absente dans les neurones du NSO de souris TRPV1−/−
. C. La dépolarisation et l’augmentation de la fréquence de décharge des potentiels d’action induites par l’hyperosmolarité sont absentes dans les neurones du NSO de souris TRPV1−/−
(modifiée d’après [ 10]). |
|
1. Bernard C. Cours de physiologie générale du Muséum d’histoire naturelle. De la vie commune aux animaux et aux végétaux. Paris : J. Ballière et Fils, 1878 : 404. 2. Voisin DL, Bourque CW. Integration of sodium and osmosensory signals in vasopressin neurons. Trends Neurosci 2002; 25 : 199–205. 3. Ciura S, Bourque CW. TRPV1 is required for intrinsic osmoreception in OVLT neurons and for normal thirst responses to systemic hyperosmolality. J Neurosci 2006 (sous presse). 4. Oliet SHR, Bourque CW. Mechanosensitive channels transduce osmosensitivity in supraoptic neurons. Nature 1993; 364 : 341–3. 5. Hussy N. Glial cells in the hypothalamo-neurohypophysial system: key elements of the regulation of neuronal electrical and secretory activity. Prog Brain Res 2002; 139 : 95–112. 6. Zhang Z, Bourque CW. Calcium permeability and flux through osmosensory transduction channels of isolated rat supraoptic nucleus neurons. Eur J Neurosci 2006; 23 : 1491–500. 7. Verbalis JG. Disorders of body water homeostasis. Best Pract Res Clin Endocrinol Metab 2003; 17 : 471–503. 8. Liedtke W, Friedman JM. Abnormal osmotic regulation in Trpv4−/− mice. Proc Natl Acad Sci USA 2003; 100 : 13698–703. 9. Muraki K, Iwata Y, Katanosaka Y, et al. TRPV2 is a component of osmotically sensitive cation channels in murine aortic myocytes. Circ Res 2003; 93 : 829–838. 10. Sharif Naeini R, Witty MF, Seguela P, Bourque CW. An N-terminal variant of Trpv1 channel is required for osmosensory transduction. Nat Neurosci 2006; 9 : 93–8. |