| |
| Med Sci (Paris). 2006 December; 22(12): 1069–1074. Published online 2006 December 15. doi: 10.1051/medsci/200622121069.Corécepteurs lymphocytaires Daniel Olive* Inserm UMR 599, Institut Paoli-Calmettes, Université de la Méditerranée, 232, boulevard Sainte-Marguerite, 13009 Marseille, France |
Le déclenchement et le développement de la réponse immune dépendent de signaux environnementaux, provenant de pathogènes, de la réactivation d’un virus latent ou du développement d’un processus néoplasique. Ces signaux vont directement ou non, via les cellules présentant l’antigène (CPA), induire leur activation après fixation à des récepteurs des cellules immunitaires. Les récepteurs pour ces signaux activateurs sont retrouvés sur les lymphocytes T αβ et γδ, B et NK : récepteur pour l’antigène des lymphocytes T αβ et γδ (TcR), récepteur des lymphocytes B (BcR) et récepteur activateur des cellules NK (CD16, ou NCR). Ces processus sont régulés de façon fine par des corécepteurs qui amplifient, s’opposent ou inhibent la réponse. Ce phénomène de co-signalisation affecte tous les effecteurs du système immunitaire, et son importance permet de comprendre la physiopathologie des maladies auto-immunes, ainsi que les mécanismes d’échappement au système immunitaire des pathogènes ou des cellules néoplasiques. |
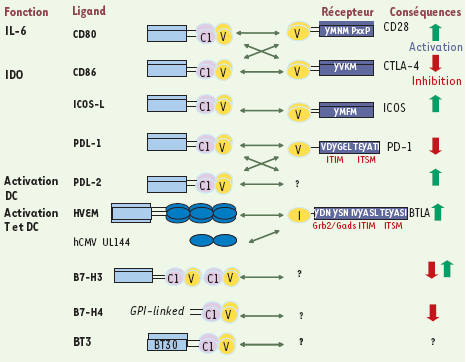
Corécepteurs costimulateurs lymphocytaires Dans la superfamille des immunoglobulines, les molécules homologues à CD28/B7 sont les plus étudiées (Figure 1).  | Figure 1.
Interactions entre les membres des familles CD28 et B7. Les fonctions associées aux molécules présentées sont indiquées sur la gauche pour la famille B7 et sur la droite pour la famille CD28. Les parties intracytoplasmiques de CD28, d’ICOS et de CTLA4 possèdent un motif commun YxxM, qui peut fixer le domaine SH2 de la sous-unité régulatrice p85 de la PI3K. Cependant, ces trois récepteurs ont des partenaires intracellulaires différents. Le motif YxxM de CD28 contient une asparagine (N) en position +2 de la tyrosine (Y), YMNM, qui peut s’associer avec le domaine SH2 des protéines d’adaptation GRB2 et Gads. De plus, les régions polyprolines (PxxP) de CD28 sont capables de fixer différentes molécules de signalisation, via leurs domaines SH3, les molécules d’adaptation GRB2/Gads et des protéines tyrosine kinases des familles Src et Tec. La séquence du motif YxxM de CTLA4 est YKVM ; dans sa forme non phosphorylée, ce motif se fixe aux complexes adaptateurs tétramériques AP1 (AP47) et AP2 (AP50). Quant à ICOS, son seul partenaire connu est la sous-unité régulatrice p85 de la PI3K, via son motif YMFM. Les parties intracytoplasmiques de PD-1 et de BTLA possèdent deux motifs communs : un motif ITIM de type (I/V/L/S)xYxx(L/V) et un motif ITSM de type TxYxx(V/I). Ces motifs phosphorylés sont capables de recruter les protéine tyrosine phosphatases SHP-1 et SHP-2, via leurs domaines SH2. De plus, BTLA possède deux motifs YxN (YDN et YSN) qui peuvent fixer les domaines SH2 des molécules d’adaptation Grb2/Gads. |
CD28 (et ses ligands CD80 et CD86) CD28 transmet les seconds signaux essentiels pour diminuer le seuil d’activation, induire l’amplification de la réponse immune et favoriser la survie lymphocytaire [
1–
3]. CD28 présente la particularité d’avoir un homologue, CTLA-4, avec lequel il partage deux ligands, CD80 et CD86 (initialement dénommés B7.1 et B7.2). CD28 est présent constitutivement sur les lymphocytes T CD4 et la majorité des cellules CD8. Son expression diminue au cours du processus de différenciation des cellules T en cellules mémoires effectrices, ce qui en fait une molécule essentiellement impliquée dans l’activation des cellules naïves. Les ligands CD80 et CD86 se fixent sur CD28 comme sur CTLA-4, mais avec des affinités différentes [
4]. Ils sont tous deux présents sur les CPA, avec toutefois des cinétiques d’expression différentes : CD86 est constitutif, mais présent à un niveau faible et rapidement surexprimé après activation, tandis que CD80 apparaît plus tard. La pharmacologie de la co-signalisation CD28/CD80-CD86 n’est que partiellement comprise. Elle augmenterait les signaux relayés par le TcR, en particulier la voie PLCγ/shc/rap2/Vav1, mais activerait aussi des signaux spécifiques comme la phosphorylation de Vav1 et de WASP, contribuant ainsi au réarrangement du cytosquelette. Plusieurs molécules s’associent au domaine intracytoplasmique de CD28 après qu’il ait fixé un ligand : sous-unité p85 de la PI3K (via son domaine SH2), Grb2 et GRID [
5]. Deux régions riches en proline lient les domaines SH3 des tyrosine kinases appartenant aux familles Src (lck) et Tec (tec et Itk). Des données obtenues chez des souris agéniques pour CD28, CD80 et CD86 ont apporté des informations sur de nouvelles fonctions des membres de cette famille, qui réguleraient notamment l’homéostasie des cellules régulatrices CD4+CD25+ [
6]. Ainsi, les molécules CD80 et CD86 lymphocytaires T participent aux phénomènes de tolérance périphérique en limitant la réponse lymphocytaire. ICOS (et son ligand ICOSL) ICOS est exprimé sur les lymphocytes T activés [
7]. On le trouve, in vivo, exprimé sur les cellules T des centres germinatifs, mais aussi dans les zones T des organes lymphoïdes secondaires. ICOS, comme CD28, induit l’activation et la différenciation des lymphocytes T et le développement de la réponse immunitaire B. Cependant, ICOS n’induit pas la synthèse d’IL-2, mais essentiellement d’IL-10 et des cytokines Th2 comme l’IL-4, l’IL-5 et l’IL-13 [ 7]. Chez l’homme, le déficit de l’expression d’ICOS induit un déficit immunitaire commun variable causé par un déficit du développement des lymphocytes B naïfs et mémoires [
8]. ICOSL, le ligand d’ICOS, est présent sur les cellules B, les monocytes et les cellules dendritiques, mais aussi sur des cellules endothéliales ou épithéliales [
9]. Les voies de signalisation d’ICOS identifiées à ce jour comprennent essentiellement l’activation de la PI3K, comme CD28, mais sans recrutement de Grb2 ni des molécules possédant des domaines SH3. Les voies de co-signalisation CD28 et ICOS présentent donc des homologies fonctionnelles, mais aussi des complémentarités, en particulier dans la différenciation des réponses B. Autres molécules : B7-H3, B7-H4, BT3.1 Les fonctions et les molécules s’associant à ces protéines sont encore mal connues ou non identifiées. Ces molécules sont homologues aux molécules B7.1 et B7.2 (Figure 2). B7-H3 est une protéine transmembranaire de 534 acides aminés, dont les fonctions doivent encore être explorées. Les premières observations lui attribuent une fonction costimulatrice sur les lymphocytes T, tandis qu’elle inhiberait les fonctions des cellules NK [
10,
11]. B7-H4 est, quant à elle, une protéine régulant de façon négative la réponse immune. Elle est exprimée sur des tumeurs humaines, et pourrait donc participer aux mécanismes d’échappement tumoral [
12]. Enfin, BT3.1, BT3.2 et BT3.3, qui appartiennent à la famille des butyrophillines, homologue de la famille B7, sont exprimées sur les cellules immunes et certains tissus tumoraux, mais ont un rôle encore inconnu [
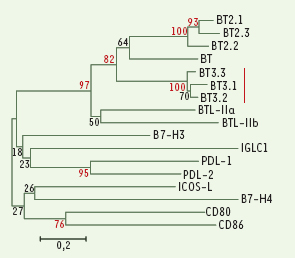
13].  | Figure 2.
Arbre phylogénétique élaboré à partir de la séquence des domaines IgC1 des molécules de la famille B7, à l’exclusion de BTLA. Les valeurs indiquées correspondent à la valeur obtenue par la méthode de bootstrap exprimée en pourcentage. |
|
Corécepteurs co-inhibiteurs À ce jour, trois entités ont été décrites : CTLA-4, PD-1 et BTLA [
14–
16]. Ces molécules sont toutes impliquées dans le contrôle de la tolérance, en déclenchant des seconds signaux inhibiteurs qui vont empêcher, terminer ou atténuer une réponse immune. Leur rôle dans le contrôle de la tolérance immunitaire a été démontré par l’utilisation de souris agéniques. Les souris ctla4
−/− développent ainsi une lymphoprolifération massive conduisant à la mort [
17], tandis que les souris pd1
−/− développent des maladies auto-immunes dont le type et la sévérité dépendent du fond génétique [
18]. Enfin, les souris btla
−/− développent avec une plus forte incidence une encéphalite allergique expérimentale après immunisation peptidique [16]. Ces trois molécules sont des cibles thérapeutiques particulièrement importantes. Chez des patients atteints de cancers, l’injection d’anticorps monoclonaux anti-CTLA-4 est associée à une augmentation de la réponse aux vaccinations thérapeutiques et un accroissement de l’élimination tumorale ; toutefois, ces patients sont également exposés à la survenue d’événements auto-immuns, spécifiques d’organe ou systémiques [
19]. CTLA-4 (et ses ligands CD80 et CD86) CTLA-4 est le récepteur co-inhibiteur, reconnaissant les membres de la famille B7, le plus étudié. Il est absent sur les cellules au repos, sauf sur les cellules régulatrices. Son expression, induite par l’activation du TcR, est amplifiée par les seconds signaux. Après interaction avec ses ligands CD80 et CD86, les lymphocytes T exprimant CTLA-4 sont inhibés : ils subissent un arrêt de la progression dans le cycle cellulaire et de la synthèse d’IL-2. Les mécanismes moléculaires de cette inhibition sont un arrêt de l’accumulation nucléaire des protéines AP-1, NF-κB et NF-AT, ainsi que l’inhibition de la cycline D3, des kinases dépendantes des cyclines CDK 4 et -6 et de la dégradation de p27kip1. La stimulation de CTLA-4 restaure l’expression de l’ubiquitine ligase E3 Cbl-b, un puissant inhibiteur de Vav1. Enfin, CTLA-4 régule la réorganisation du cytosquelette en augmentant l’activité de la petite protéine G Rap1 [
20]. Les fonctions inhibitrices de CTLA-4 sont particulièrement complexes, car elles dépendent de signaux intracellulaires, de la compétition pour la fixation des ligands avec CD28 et de signaux transmis via les molécules B7. Au niveau de son domaine intracellulaire, CTLA-4 n’a pas d’activité enzymatique intrinsèque et ne contient pas de motif ITIM. Cependant, il peut interagir avec des phosphatases, notamment les phosphatases SHP-2 et PP2A. Ainsi, en l’absence d’activation, des résidus du domaine cytoplasmique de CTLA-4 s’associent aux sous-unités A et C de la PP2A. Après stimulation par le TcR, CTLA-4 est phosphorylé sur des résidus tyrosines, la PP2A se dissocie de CTLA-4, et celui-ci peut alors fixer la sous-unité p85 de la PI3K. Le lien entre les activités enzymatiques associées à CTLA-4 après activation du TcR et les conséquences en aval doit toutefois encore être précisé. CTLA-4 entre en compétition avec CD28 pour la fixation des ligands CD80 et CD86. En effet, CTLA-4 possède une affinité beaucoup plus importante que CD28 pour CD80. L’expression de surface de CTLA-4 peut donc déplacer CD80 et empêcher l’activation de CD28. Plus récemment, des données ont évoqué le rôle d’une signalisation assurée par CD80 et CD86 dans les CPA. Cette signalisation inverse permettrait d’induire l’activité de l’enzyme IDO, et donc le catabolisme du tryptophane. Cet acide aminé étant limitant dans le lymphocyte T, sa dégradation induit l’inhibition de la prolifération T [
21]. De façon intéressante, alors que les fonctions de CTLA-4 sont restreintes au lymphocyte T, cette signalisation inverse dans les CPA affecte les populations de cellules T αβ et γδ, ainsi que les cellules NK. PD-1 (et ses ligands PDL1 et-2) PD-1 est le second type de récepteur induisant une co-signalisation négative. Si son domaine extracellulaire appartient également à la SFIg, il est, à la différence de CTLA-4, dépourvu du résidu cystéine proche de la membrane, nécessaire pour l’homodimérisation. Son expression est également induite par l’activation, mais avec un spectre plus large que celle de CTLA-4, car elle est retrouvée sur les lymphocytes T et B, ainsi que sur les macrophages [
22]. Malgré son nom (programmed death), PD-1 a un effet indirect, et non direct, sur la mort cellulaire, essentiellement par diminution de l’expression de la protéine anti-apoptotique BclxL. Cette fonction pourrait être due à l’inhibition de l’activité PI3K induite par CD28 [
23]. PD-1 inhibe la prolifération des lymphocytes T et B par arrêt à la phase G0/G1 du cycle et par diminution de la production de cytokines des lymphocytes T [
24]. Deux ligands de PD-1 ont été décrits, PDL1/B7H1 et PDL2/B7-DC. PDL1 est faiblement exprimé sur les cellules du système immunitaire, plus fortement après leur activation. Il est également exprimé sur des organes non lymphoïdes (cœur, poumon, pancréas, muscle et placenta). Cette expression sur les tissus périphériques suggère que PDL1 pourrait réguler les fonctions des cellules T, B et myéloïdes activées dans les tissus périphériques, ou inhiber les réponses inflammatoires dans ces organes. PDL1 est également exprimé par certaines tumeurs, son expression apparaissant associée à un plus mauvais pronostic [
25]. Chez la souris, le blocage de PD-1 permet d’induire l’élimination des cellules néoplasiques : l’expression de PDL1 serait donc utilisée par la tumeur pour échapper à la réponse antitumorale [
26]. Quant à PDL2, son expression, restreinte aux macrophages et aux cellules dendritiques, est induite par les cytokines, notamment de type Th2. PDL2 est un marqueur associé à un meilleur pronostic dans un sous-groupe de lymphomes B (PMBL) et dans la maladie de Hodgkin. L’augmentation de son expression est due à l’amplification génique affectant la région p24 sur le chromosome 9. PDL2 pourrait participer à l’induction de la réponse immune ou augmenter la production de cytokines inflammatoires [
27]. Les données contradictoires, montrant un rôle inhibiteur ou activateur de PDL1 et PDL2, suggèrent l’existence un ligand alternatif distinct de PD-1 ou d’une plasticité dans la signalisation de PD-1, liée au motif ITSM. Le domaine cytoplasmique de PD-1 contient deux résidus tyrosine, l’un dans un domaine ITIM, l’autre dans un domaine ITSM. Ces motifs interagissent avec les protéines tyrosine phosphatases SHP-1 et -2 [
28]. Les domaines ITIM sont des séquences courtes de consensus (ILV)-x-Y-x-x-(LV) ; quant aux domaines ITSM, ils ont été initialement identifiés au sein de la protéine SLAM/CD150. Ces motifs recrutent, après phosphorylation, des molécules telles que SAP, SHP-2 ou SHP-1. L’importance de la protéine SAP, qui permet le recrutement de la PTK Fyn, est démontrée par l’existence d’une forme fatale de déficit immunitaire, le syndrome lymphoprolifératif lié à l’X : chez ces patients, la SAP est non fonctionnelle, et le système immunitaire ne contrôle pas les infections virales. Le rôle de l’ITSM de PD-1 doit encore être étudié. BTLA (et son ligand HVEM) Même si des données récentes démontrent que BTLA appartient à un sous-groupe de la SFIg structuralement différent de CD28 [
29], sa fonction l’intègre dans les régulateurs négatifs de l’activation immune. BTLA, comme PD-1, contient un ITIM juxtamembranaire et un ITSM distal séparés par 19 acides aminés. La stimulation de BTLA inhibe la prolifération lymphocytaire T et la synthèse de cytokines [ 16]. De façon inattendue, BTLA se fixe et est activé par un membre de la famille du TNFR, HVEM [
30]. C’est le premier exemple décrit d’interaction entre membres des SFIg et SFTNFR. BTLA est exprimé sur les cellules T, B et CPA non activées, par opposition à CTLA-4 et PD-1, seulement exprimés par les cellules activées. |
Conclusions et développements thérapeutiques Au sein de la famille CD28, CTLA-4, PD-1 et BTLA ont en commun la capacité d’inhiber la réponse immune. Toutefois, à partir des données obtenues chez des souris agéniques, on peut décrire une hiérarchie entre ces trois molécules : CLTA-4 exerce un rôle central et majeur dans la tolérance au sein des organes lymphoïdes, tandis que PD-1 et BTLA réguleraient la tolérance et les réponses inflammatoires en périphérie. CTLA-4 régule les cellules T activées et les cellules T régulatrices, tandis que PD-1 et BTLA ont un spectre d’expression plus large, sur les cellules de l’immunité innée comme acquise. Cependant, l’expression de PD-1 dépend de l’activation cellulaire, tandis que BTLA est exprimé sur les cellules naïves. Il est donc possible que chacun d’eux exerce des rôles différents, à divers stades de l’activation. Ces corécepteurs co-inhibiteurs apportent de nouveaux outils pour réguler la réponse immune et proposer des stratégies capables de l’inhiber (anticorps monoclonaux ou ligands agonistes) ou de l’activer (anticorps monoclonaux antagonistes ou bloquant l’interaction ligand/récepteur). Ces stratégies thérapeutiques sont importantes pour les patients atteints de cancer chez qui, après les succès initiaux associés au traitement par des anticorps monoclonaux anti-CTLA-4, de nouveaux réactifs pourraient cibler les récepteurs activés par la cellule tumorale, comme PD-1, voire BTLA. Cela permettrait de proposer de nouvelles stratégies permettant de lutter contre les mécanismes d’échappement tumoral. Par ailleurs, les réactifs dirigés contre les membres des familles CD28 et B7 sont des candidats majeurs pour être utilisés dans le traitement des rejets de greffe ou des maladies auto-immunes, et pour inhiber les phénomènes inflammatoires.

|
Footnotes |
1. Schwartz RH. Costimulation of T lymphocytes: the role of CD28, CTLA-4, and B7/BB1 in interleukin-2 production and immunotherapy. Cell 1992; 71 : 1065–8. 2. Boise LH, Minn AJ, Noel PH, et al. CD28 costimulation can promote T cell survival by enhancing the expression of Bcl-XL. Immunity 1995; 3 : 87–98. 3. Iezzi G, Karjalainen K, Lanzavecchia A. The duration of antigenic stimulation determines the fate of naive and effector T cells. Immunity 1998; 8 : 89–95. 4. Linsley PS, Greene JL, Brady W, et al. Human B7-1 (CD80) and B7-2 (CD86) bind with similar avidities but distinct kinetics to CD28 and CTLA-4 receptors. Immunity 1994; 1 : 793–801. 5. Pages F, Ragueneau M, Rottapel R, et al. Binding of phosphatidylinositol-3-OH kinase to CD28 is required for T-cell signalling. Nature 1994; 369 : 327–9. 6. Salomon B, Lenschow DJ, Rhee L, et al. B7/CD28 costimulation is essential for the homeostasis of the CD4+CD25+ immunoregulatory T cells that control autoimmune diabetes. Immunity 2000; 12 : 431–40. 7. Hutloff A, Dittrich AM, Beier KC, et al. ICOS is an inducible T-cell co-stimulator structurally and functionally related to CD28. Nature 1999; 397 : 263–6. 8. Grimbacher B, Hutloff A, Schlesier M, et al. Homozygous loss of ICOS is associated with adult-onset common variable immunodeficiency. Nat Immunol 2003; 4 : 261–8. 9. Swallow MM, Wallin JJ, Sha WC. B7h, a novel costimulatory homolog of B7.1 and B7.2, is induced by TNFalpha. Immunity 1999; 11 : 423–32. 10. Chapoval AI, Ni J, Lau JS, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production. Nat Immunol 2001; 2 : 269–74. 11. Castriconi R, Dondero A, Augugliaro R, et al. Identification of 4Ig-B7-H3 as a neuroblastoma-associated molecule that exerts a protective role from an NK cell-mediated lysis. Proc Natl Acad Sci USA 2004; 101 : 12640–5. 12. Sica GL, Choi IH, Zhu G, et al. B7-H4, a molecule of the B7 family, negatively regulates T cell immunity. Immunity 2003; 18 : 849–61. 13. Compte E, Pontarotti P, Collette Y, et al. Frontline: characterization of BT3 molecules belonging to the B7 family expressed on immune cells. Eur J Immunol 2004; 34 : 2089–99. 14. Brunet JF, Denizot F, Luciani MF, et al. A new member of the immunoglobulin superfamily, CTLA-4. Nature 1987; 328 : 267–70. 15. Shinohara T, Taniwaki M, Ishida Y, et al. Structure and chromosomal localization of the human PD-1 gene (PDCD1). Genomics 1994; 23 : 704–6. 16. Watanabe N, Gavrieli M, Sedy JR, et al. BTLA is a lymphocyte inhibitory receptor with similarities to CTLA-4 and PD-1. Nat Immunol 2003; 4 : 670–9. 17. Waterhouse P, Penninger JM, Timms E, et al. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science 1995; 270 : 985–8. 18. Nishimura H, Nose M, Hiai H, et al. Development of lupus-like autoimmune diseases by disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity 1999; 11 : 141–51. 19. Phan GQ, Yang JC, Sherry RM, et al. Cancer regression and autoimmunity induced by cytotoxic T lymphocyte-associated antigen 4 blockade in patients with metastatic melanoma. Proc Natl Acad Sci USA 2003; 100 : 8372–7. 20. Teft WA, Kirchhof MG, Madrenas J. A molecular perspective of CTLA-4 function. Annu Rev Immunol 2006; 24 : 65–97. 21. Grohmann U, Orabona C, Fallarino F, et al. CTLA-4-Ig regulates tryptophan catabolism in vivo. Nat Immunol 2002; 3 : 1097–101. 22. Agata Y, Kawasaki A, Nishimura H, et al. Expression of the PD-1 antigen on the surface of stimulated mouse T and B lymphocytes. Int Immunol 1996; 8 : 765–72. 23. Parry RV, Chemnitz JM, Frauwirth KA, et al. CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Mol Cell Biol 2005; 25 : 9543–53. 24. Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000; 192 : 1027–34. 25. Brown JA, Dorfman DM, Ma FR, et al. Blockade of programmed death-1 ligands on dendritic cells enhances T cell activation and cytokine production. J Immunol 2003; 170 : 1257–66. 26. Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci USA 2002; 99 : 12293–7. 27. Rosenwald A, Wright G, Leroy K, et al. Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma. J Exp Med 2003; 198 : 851–62. 28. Chemnitz JM, Parry RV, Nichols KE, et al. SHP-1 and SHP-2 associate with immunoreceptor tyrosine-based switch motif of programmed death 1 upon primary human T cell stimulation, but only receptor ligation prevents T cell activation. J Immunol 2004; 173 : 945–54. 29. Compaan DM, Gonzalez LC, Tom I, et al. Attenuating lymphocyte activity: the crystal structure of the BTLA-HVEM complex. J Biol Chem 2005; 280 : 39553–61. 30. Sedy JR, Gavrieli M, Potter KG, et al. B and T lymphocyte attenuator regulates T cell activation through interaction with herpesvirus entry mediator. Nat Immunol 2005; 6 : 90–8. |