Lors d’une infection virale chronique, le système immunitaire est incapable d’éliminer totalement le virus et celui-ci peut persister longtemps dans certains compartiments cellulaires ou anatomiques. Dans la plupart des cas, le système immunitaire met en place une réponse mémoire efficace permettant de contenir les épisodes de réactivation du virus. En revanche, l’infection par le VIH (virus de l’immunodéficience humaine) s’accompagne de la perte de la capacité des lymphocytes T mémoires à juguler la réplication virale, malheureusement les causes de cet état dysfonctionnel ne sont pas encore bien comprises [ 1]. De nombreuses études ont mis en évidence l’absence de fonctions effectrices des cellules T CD8 spécifiques du VIH et leur incapacité à proliférer [ 2– 5]. Plusieurs stratégies ont été déployées pour essayer de restaurer ces fonctions, par exemple : la trithérapie, l’ajout de cellules compétentes CD4 spécifiques du VIH ou encore de cytokines. Bien que ces dernières aient permis d’améliorer la prolifération des cellules CD8 spécifiques du VIH, la restauration des fonctions effectrices n’a jamais été observée jusqu’à présent.
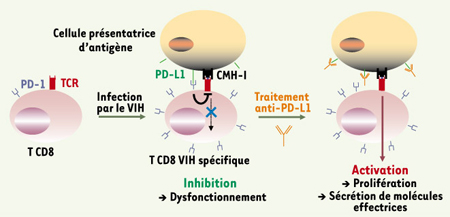
| Figure 1.
Restauration des fonctions effectrices des lymphocytes T CD8 spécifiques du VIH après inhibition de la voie PD-1. La molécule PD-1 est naturellement exprimée à un faible niveau par les lymphocytes T CD8. Au cours de l’infection par le VIH, les cellules CD8 spécifiques du virus expriment fortement PD-1. Lors de la présentation d’un antigène viral par une cellule présentatrice de l’antigène, la liaison de PD-1 à son ligand PD-L1 entraîne une inhibition des fonctions effectrices de la cellule. Le traitement par l’anticorps anti-PD-L1 permet de lever l’inhibition induite par PD-1 et de restaurer la prolifération et la sécrétion de molécules effectrices par les CD8 spécifiques du VIH. |
La régulation des réponses T aux infections virales résulte d’un équilibre délicat entre leurs fonctions effectrices nécessaires pour éliminer l’agent pathogène et leur potentiel à causer des dommages aux tissus. Ainsi, les molécules régulant le système immunitaire ont une importance capitale dans le maintien de l’équilibre entre une réponse efficace et le développement de pathologies auto-immunes. Parmi ces molécules régulatrices, la molécule PD-1 (Programmed Death-1, une protéine exprimée à la surface de certains lymphocytes) permet d’éviter une activation excessive de la réponse immunitaire [ 6]. Plusieurs équipes ont montré que l’entrée en jeu de PD-1 avec son ligand PD-L1 atténue la voie de signalisation du récepteur des cellules T, responsable de la reconnaissance spécifique des antigènes viraux et de l’initiation de la réponse des lymphocytes T, et induit ainsi l’inhibition de la prolifération et de la production d’IL-2 [ 7]. Récemment, l’équipe du Dr Rafi Ahmed a mis en évidence le rôle de PD-1 dans le dysfonctionnement des cellules CD8 au cours de l’infection chronique par le virus de la chorioméningite lymphocytaire (LCMV) chez la souris. L’administration d’anticorps empêchant la liaison de PD-1 avec son ligand permettait de restaurer la fonction des cellules CD8 spécifiques du virus et de réduire la charge virale des souris infectées [ 8]. Ces résultats nous ont incités à étudier le rôle de PD-1 dans l’infection par le VIH.
Dans cette étude, nous avons étudié l’expression de la molécule PD-1 sur des cellules CD8 spécifiques du VIH, du CMV (cytomégalovirus) et de l’EBV (virus d’Epstein-Barr) au sein des mêmes groupes de patients [ 9]. Nous avons montré que l’expression de PD-1 était plus importante sur les cellules CD8 VIH-spécifiques que sur les cellules CMV- et EBV-spécifiques. De plus, celle-ci était plus importante sur les cellules CD8 VIH-spécifiques chez des patients virémiques que chez des patients avirémiques. Cette même association entre le niveau d’expression de PD-1 et la virémie a été observée sur la totalité des cellules CD8, quelles que soient leurs spécificités. Plus la charge virale est élevée, plus les cellules VIH-spécifiques et, dans une moindre mesure, les CD8 totaux surexpriment PD-1. Une analyse longitudinale de 5 patients ayant été suivis sur une période allant jusqu’à 6 ans avec des fluctuations de charge virale attribuées à des interruptions volontaires de traitement a confirmé cette observation chez les mêmes individus. Nous avons ensuite démontré que la capacité réduite des cellules VIH-spécifiques à sécréter les cytokines IL-2 et TNF-α était directement associée à l’expression de PD-1. Ces deux cytokines, indispensables à une réponse efficace des cellules T CD8, étaient davantage sécrétées par les cellules CMV- et EBV-spécifiques isolées chez les mêmes patients exprimant de faibles niveaux de PD-1 que par les cellules VIH-spécifiques caractérisées par une expression élevée de cette molécule. En résumé, plus les niveaux de PD-1 étaient élevés, plus le dysfonctionnement était sévère.
Nous avons alors déterminé si l’inhibition de la voie PD-1 pouvait restaurer la sécrétion de molécules effectrices et la prolifération des cellules CD8 VIH-spécifiques. Un anticorps empêchant l’interaction de PD-1 avec son ligand, PD-L1, a été ajouté au milieu de culture lors de la stimulation des cellules de patients avec des antigènes du VIH. Après 6 jours de culture en présence de cet anticorps, la sécrétion de molécules associées à la fonction cytotoxique des cellules CD8 (TNF-α, Granzyme B et Lymphotoxine-α) a été significativement augmentée, démontrant que l’inhibition de la voie PD-1/PD-L1 pouvait restaurer la production de molécules effectrices. De plus, les cellules CD8 VIH-spécifiques avaient davantage proliféré en présence de l’anticorps dirigé contre PD-L1, démontrant que l’inhibition de la voie PD-1/PD-L1 permettait de restaurer la capacité proliférative des cellules CD8 VIH-spécifiques.
Ces travaux établissent qu’il est possible de restaurer la fonction des lymphocytes CD8 spécifiques du VIH en neutralisant une molécule exprimée à leur surface. Des résultats similaires ont été obtenus simultanément par l’équipe du Dr Bruce Walker au NIH (National Institutes of Health, Bethesda, États-Unis) [ 10]. Les stratégies d’immunothérapie développées jusqu’à présent ont eu pour but d’activer directement les cellules T, soit par la vaccination thérapeutique soit par le transfert adoptif des cellules T cultivées in vitro. Nos résultats permettent d’envisager une stratégie alternative consistant à lever la dysfonction des cellules T par une injection d’anticorps dirigés contre PD-L1. L’amélioration de la qualité de la réponse du système immunitaire du patient infecté constitue une approche thérapeutique prometteuse qui pourrait conduire à l’éradication du virus. Un traitement semblable pourrait même être appliqué à d’autres infections virales chroniques ou dans le cas de pathologies tumorales. Le développement de stratégies thérapeutiques destinées à la restauration des fonctions du système immunitaire doit cependant tenir compte des risques d’apparition de réactions auto-immunes. Ainsi, une meilleure compréhension des mécanismes en jeu dans la régulation du système immunitaire semble essentielle au succès de ces nouvelles approches thérapeutiques.