| |
| Med Sci (Paris). 2007 January; 23(1): 37–40. Published online 2007 January 15. doi: 10.1051/medsci/200723137.La découverte de l’opiorphine humaine Un modulateur anti-nociceptif des voies opioïdergiques Catherine Rougeot1* and Michaël Messaoudi2 1Laboratoire de Pharmacologie des régulations neuroendocrines, Institut Pasteur, 28, rue du Docteur Roux, 75724 Paris Cedex 15, France 2ETAP-Éthologie appliquée, Centre de Recherche en Neuropsychopharmacologie, 13, rue du Bois de la Champelle, 54500 Vandoeuvre-lès-Nancy, France MeSH keywords: Analgésiques, Analgésiques morphiniques, Humains, Morphine, Oligopeptides, Douleur, Mesure de la douleur, Protéines et peptides salivaires |
Chez les mammifères, les métallo-ectopeptidases à zinc contrôlent l’activité de nombreux médiateurs peptidiques neuroendocriniens qui coordonnent la dynamique des réactions adaptatives de l’organisme à un changement environnemental. Les enképhalines sont les neuropeptides des voies opioïdergiques sécrétés en réponse à certaines situations de stress - physique ou psychologique - qui sont très rapidement détruits par les 2 métallo-ectopeptidases membranaires, NEP (neutral endopeptidase) et AP-N (aminopeptidase N). Les enképhalines jouent un rôle crucial dans le contrôle des voies de neurotransmission de la douleur et dans la modulation de l’activité des structures cérébrales régissant, en outre, la motivation et l’équilibre adaptatif des états émotionnels [
1,
2]. Leur action est spécifiquement transmise, comme celle de la morphine (opiacé alcaloïde), via les récepteurs membranaires µ- et ∂-opioïdes. Face à l’importance des constantes biologiques régulées par le système opioïde, l’identification des mécanismes qui contrôlent, en amont, l’activité des signaux enképhalines revêt une importance fondamentale tant sur les plans physiologique que thérapeutique [
3]. L’aventure de la découverte de l’opiorphine débute par une démarche d’intégration fondée sur la caractérisation moléculaire d’un nouveau médiateur hormonal chez le rat - baptisé Sialorphine - et sur l’établissement de son caractère significatif et de sa spécificité fonctionnelle in vivo. |
La découverte de la sialorphine de rat par une approche de pharmacologie inverse L’identification de la sialorphine, un messager hormonal de communication intercellulaire chez le rat, est issue d’une approche de physiopharmacochimie post-génomique. De façon remarquable, il s’est avéré que, chez le rat, la sialorphine est un ligand physiologique et un inhibiteur compétitif de la NEP membranaire - que celle-ci soit issue des tissus nerveux (moelle épinière) ou des tissus systémiques (rein, os, dent, placenta, prostate…) [
4,
5]. In vivo chez le rat mâle adulte, la sialorphine exerce une activité anti-nociceptive puissante avec un effet maximum à une concentration de 100-200 µg/kg par voie intraveineuse, dans deux modèles d’analyse de la réponse comportementale algésique, c’est-à-dire le Pin Pain test et le Formalin test. En outre, les effets antalgiques induits par la sialorphine requièrent l’activation spécifique des récepteurs opioïdes de sous-types µ et ∂ [
6]. De plus, dans un modèle d’analyse du désespoir comportemental, c’est-à-dire le forced-swim behavioral despair test , la sialorphine exerce un effet anti-résignation ou anti-dépresseur. Par ailleurs, dans un modèle d’analyse de la réponse comportementale sexuelle, la sialorphine exerce, aux concentrations physiologiques circulantes (1 µg/kg), un effet stimulateur sur les paramètres comportementaux d’évaluation de la motivation et/ou de l’éveil (fréquence des interactions socio-relationnelles sexuelles) et sur certains paramètres d’évaluation de la performance sexuelle [
7,
8]. L’ensemble des résultats a permis de proposer que, chez le rat, la sialorphine, en protégeant de l’inactivation par les ectopeptidases (NEP et AP-N), les enképhalines endogènes libérées en réponse aux stimulus environnementaux (douleur, émotion, stress…), potentialise leurs fonctions physiologiques adaptatives, notamment leurs actions anti-nociceptive et psycho-stimulante [1, 2,
9]. |
La découverte de l’opiorphine humaine par une approche de biochimie fonctionnelle Compte tenu des propriétés innovantes de la sialorphine de rat, nous avons recherché son homologue fonctionnel chez l’homme et en particulier dans les sécrétions salivaires humaines. En effet, des données de la littérature laissaient supposer la présence de substances (non caractérisées), de petit poids moléculaire, inhibitrices de l’activité NEP dans la salive humaine [
10]. Suivant un protocole de recherche clinique, établi avec le Centre de Recherche Biomédicale de l’Institut Pasteur (CRBm et ICARe, Paris, France), la salive humaine a été collectée chez des volontaires sains. L’ensemble des procédures chromatographiques (HPLC, high performance liquid chromatography) développées a permis d’extraire et d’isoler le composant salivaire majeur ayant la capacité d’inhiber l’activité NEP humaine. L’analyse par micro-séquençage du produit final de purification a fourni la preuve directe de l’existence chez l’homme d’un peptide de séquence QRFSR, sécrété dans la salive humaine, et dont l’activité est similaire à celle de la sialorphine de rat (peptide QHNPR). L’analyse génomique in silico a révélé que le peptide QRFSR serait issu de la maturation sélective du produit du gène humain PROL1 qui est exprimé dans les glandes salivaires humaines. À l’aide de divers modèles de pharmacologie moléculaire (hNEP recombinante) et de pharmacologie cellulaire (lignées cellulaires exprimant constitutivement la hNEP ou transfectées avec l’ADNc-hNEP ou l’ADNc-hAP-N), nous avons démontré que le peptide QRFSR est un inhibiteur à la fois des activités hNEP et hAP-N, et qu’il protège in vitro la Met-enképhaline de la dégradation par ces deux ectoenzymes.
In vivo, dans un modèle d’analyse de la réponse comportementale algésique aiguë chez le rat mâle, le pin pain test (Figure 1), nous avons montré que le peptide QRFSR exerce une activité anti-nociceptive puissante à une concentration de 1 mg/kg, c’est-à-dire équivalente à celle de la morphine administrée par voie intrapéritonéale à une concentration de 6 mg/kg (Figure 2). De plus, l’effet antalgique induit par le peptide est bloqué en présence d’un antagoniste des récepteurs opioïdes, la naloxone, ce qui indique que son action anti-nociceptive est relayée par les voies opioïdergiques endogènes dépendantes de ces récepteurs [
11]. Nous l’avons ainsi nommé opiorphine.  | Figure 1.
Le Pin Pain Test, un modèle éthopharmacologique d’analyse de la réponse comportementale douloureuse chez le rat. Le test est fondé sur l’analyse locomotrice et exploratrice du rat dans un open-field muni d’un plancher algogène (douleur de type mécanique). Le dispositif expérimental est constitué d’un compartiment divisé en 9 aires de surface égale, dont huit sont périphériques et tapissées de pointes en acier et l’une d’entre elles centrale et lisse. Le test consiste à déposer le rat au départ dans l’aire centrale et à quantifier durant 3 minutes son activité locomotrice (horizontale et verticale) et exploratrice sur les aires périphériques. |
 | Figure 2.
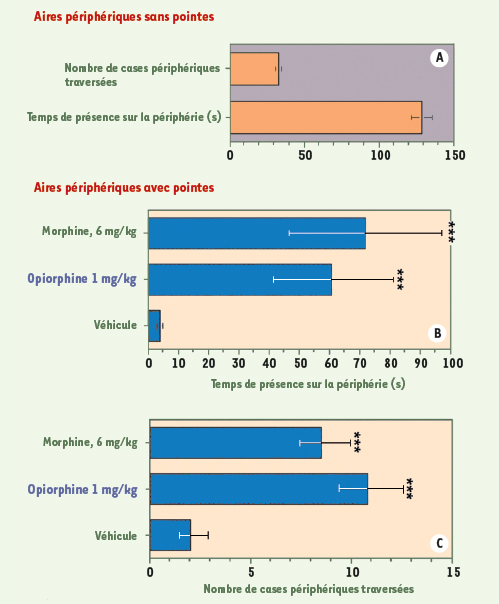
L’opiorphine exerce une activité anti-nociceptive aussi puissante que celle de la morphine dans un modèle d’analyse de la réponse comportementale à la douleur aiguë mécanique chez le rat. Dans les conditions sans pointes (A), le rat déposé dans l’aire centrale du dispositif se dirige rapidement vers les aires périphériques où il passe 75% de son temps en exploration. Lorsque les aires périphériques du dispositif sont rendues aversives par la présence d’un tapis de pointes en acier (B et C), le rat effectue une exploration rapide en périphérie puis revient dans l’aire centrale lisse, où il passe 98% du temps durant les 3 minutes de test, pour éviter tout stimulus douloureux (véhicule ou rat témoin sans opiorphine, B et C). Comparé au rat témoin, après administration d’opiorphine (1 mg/kg) ou de morphine (6 mg/kg), le rat montre une activité locomotrice et exploratrice très importante dans les aires périphériques. Les variables analysées (n=8, 12 rats/groupe) sont : le temps de présence sur la périphérie (B) et le nombre de cases périphériques traversées (C). L’ensemble des paramètres comportementaux enregistrés démontre que l’opiorphine, comme la morphine, inhibe significativement la perception de la douleur induite par le contact des pattes du rat avec les pointes. *** p < 0,001 comparé au groupe de rats témoins (véhicule) par le test U de Mann-Whitney. |
|
Les données convergentes issues des approches de post-génomique, de biochimie et de pharmacologie nous ont permis de mettre en évidence l’existence d’un inhibiteur physiologique des activités métallo-ectopeptidases, NEP et AP-N chez l’homme. De façon remarquable, il s’est avéré que l’opiorphine est un puissant inhibiteur de la sensation douloureuse, via l’activation des voies opioïdergiques endogènes, chez le rat. Sur un plan physiologique, l’opiorphine devrait intervenir dans les processus d’adaptation, relayés en partie par les enképhalines, qui sont associés à la douleur et aux émotions, et plus particulièrement à la régulation des équilibres homéostatiques : pronociception-antinociception et dépression-motivation. Un programme de recherche clinique, visant à établir les caractéristiques topologiques de synthèse et de sécrétion de l’opiorphine chez l’homme, sera suivi d’une deuxième approche qui consistera à identifier les situations physiologiques et les états pathologiques d’intérêt qui conditionnent sa synthèse et sa sécrétion. Par ailleurs, du fait de ses propriétés pharmacodynamiques, l’opiorphine s’avère une source de pistes moléculaires pouvant servir à la conception de nouveaux candidats médicaments qui, en empêchant la destruction des opioïdes endogènes, présentent un potentiel thérapeutique dans le cadre de la prise en charge de la douleur et dans le traitement des désordres comportementaux socio-relationnels associés à un déséquilibre de type émotionnel. |
1. Konig M, Zimmer AM, Steiner H, et al. Pain responses, anxiety and aggression in mice deficient in pre-proenkephalin. Nature 1996; 383 : 535–8. 2. Filliol D, Ghozland S, Chluba J, et al. Mice deficient for delta- and mu-opioid receptors exhibit opposing alterations of emotional responses. Nat Genet 2000; 25 : 195–200. 3. Roques BP. Novel approaches to targeting neuropeptide systems. Trends Pharmacol Sci 2000; 21 : 475–83. 4. Rougeot C, Vienet R, Cardona A, et al. Targets for SMR1-pentapeptide suggest a link between the circulating peptide and mineral transport. Am J Physiol 1997; 273 : R1309–20. 5. Rougeot C. The discovery of sialorphin using inverse pharmacology. BIOforum Europe 2004; 8 : 52–5. 6. Rougeot C, Messaoudi M, Hermitte V, et al. Sialorphin, a natural inhibitor of rat membrane-bound neutral endopeptidase that displays analgesic activity. Proc Natl Acad Sci USA 2003; 100 : 8549–54. 7. Messaoudi M, Desor D, Nejdi A, Rougeot C. The endogenous androgen-regulated sialorphin modulates male rat sexual behavior. Horm Behav 2004; 46 : 684–91. 8. Davies KP, Tar M, Rougeot C, Melman A. Sialorphin (the mature peptide product of Vcsa1) relaxes corporal smooth muscle tissue and increases erectile function in the ageing rat. Br J Urol Int octobre 2006 online. 9. Tian M, Broxmeyer HE, Fan Y, et al. Altered hematopoiesis, behavior, and sexual function in mu opioid receptor-deficient mice. J Exp Med 1997; 185 : 1517–22. 10. Marini M, Roda LG. Neuropeptide enzyme hydrolysis in human saliva. Arch Oral Biol 2000; 45 : 775–86. 11. Wisner A, Dufour E, Messaoudi M, et al. Human opiorphin, a natural antinociceptive modulator of opioid-dependent pathways. Proc Natl Acad Sci USA 2006; 103 : 17979–84. |