| |
| Med Sci (Paris). 2007 January; 23(1): 81–87. Published online 2007 January 15. doi: 10.1051/medsci/200723181.Nouveautés sur le rétrécissement valvulaire aortique Philippe Pibarot,* Jean G. Dumesnil, and Patrick Mathieu Centre de recherche de l’Hôpital Laval, Institut de cardiologie de Québec, Université Laval, 2725, chemin Sainte-Foy, Sainte-Foy, Québec, G1V 4G5 Canada |
Dans les pays industrialisés, le rétrécissement aortique (RA) est la maladie cardiovasculaire la plus fréquente après la maladie coronarienne et l’hypertension artérielle [
1–
3]. Il est prévu que sa prévalence augmentera considérablement au cours des prochaines décennies en raison du vieillissement de la population et, actuellement, elle commande quelque 100 000 chirurgies de remplacement valvulaire par année en Amérique du Nord ; en outre, elle est directement la cause d’environ 20 000 décès chaque année. La première partie de cet article porte sur les pathomécanismes conduisant au RA chez l’adulte ; la deuxième partie est consacrée à la sévérité du RA dont l’évaluation est déterminante pour la conduite thérapeutique. |
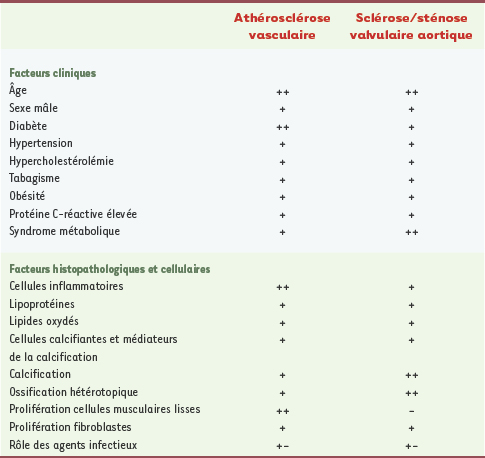
Pathogénie du rétrécissement aortique Bien que le rhumatisme articulaire aigu ait longtemps constitué la source la plus fréquente du RA, la sclérose valvulaire dite dégénérative est, de nos jours, l’étiologie prédominante dans les pays développés. Cette forme de RA a longtemps été considérée comme un processus dégénératif lié au vieillissement dont il était, par conséquent, difficile de modifier l’évolution. Cependant, des études récentes démontrent que cette maladie présente de nombreuses similitudes avec la maladie coronarienne athérosclérotique (MCAS) tant sur le plan de la physiopathologie que des facteurs de risques suggérant ainsi que le RA ne serait en fait qu’une des nombreuses manifestations de l’athérosclérose (Tableau I) [1–
4]. Dans cette perspective, le RA dégénératif ne serait donc plus à considérer comme un processus inéluctable mais plutôt comme une pathologie dont il serait éventuellement possible de modifier l’évolution [1–4]. Il faut néanmoins souligner que les connaissances acquises sur les déterminants cliniques, métaboliques et génétiques de l’athérosclérose vasculaire ne peuvent pas, pour autant, être directement transposés au RA car la structure et la physiologie de la valve aortique sont très différentes de celles des artères [3].  | Tableau I.
Comparaison de la sclérose valvulaire aortique et de l’athérosclérose vasculaire. + : facteur présent ; ++ : facteur prépondérant ; - : facteur absent ; +- : présence du facteur controversée. Cette classification tente de refléter au mieux les données recueillies dans les publications spécialisées, elle demeure cependant arbitraire. |
Le syndrome métabolique (SM) est un ensemble de perturbations métaboliques associées à l’accumulation excessive de graisse abdominale. Les composantes du SM incluent une dyslipidémie athérogénique, ainsi qu’un état pro-inflammatoire et pro-thrombotique lié à l’insulino-résistance [
5,
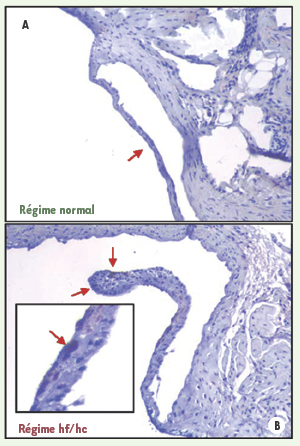
6]. Le SM est un prédicteur important du risque de MCAS, et ce indépendamment des facteurs de risque traditionnels ; c’est la raison pour laquelle les chercheurs de notre équipe ont émis l’hypothèse selon laquelle les effets pro-athérogéniques et pro-inflammatoires du SM pourraient influencer la progression du RA. Et de fait, Drolet et al. ont réussi à causer un RA chez des souris en induisant chez celles-ci un SM au moyen d’une alimentation riche en graisses et en hydrates de carbone très similaire à celle qui prévaut pour les humains dans les pays industrialisés (Figure 1) [
7]. Ces résultats obtenus chez l’animal nous ont conduit à réaliser une étude rétrospective sur 105 patients victimes d’un RA, dans laquelle nous avons observé que le SM était présent chez 40 % d’entre eux et que la progression du RA était 2 fois plus rapide chez ces derniers [
8]. De plus, le SM augmentait de 4 fois le risque de survenue d’événements cardiovasculaires (remplacement valvulaire ou décès) après prise en compte des autres facteurs de risque traditionnels. 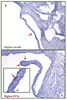 | Figure 1.
Augmentation de l’épaisseur des feuillets (flèches) de la valve aortique chez une souris de souche sauvage nourrie avec un régime riche en graisses et en hydrates de carbone (hf/hc) (B) et chez une souris soumise à un régime normal (A). Les feuillets des souris hf/hc démontrent un marquage positif pour les macrophages (cellules positives pour le CD68) et des cellules spumeuses (flèches) (reproduit de [ 7] avec la permission de l’ American College of Cardiology). |
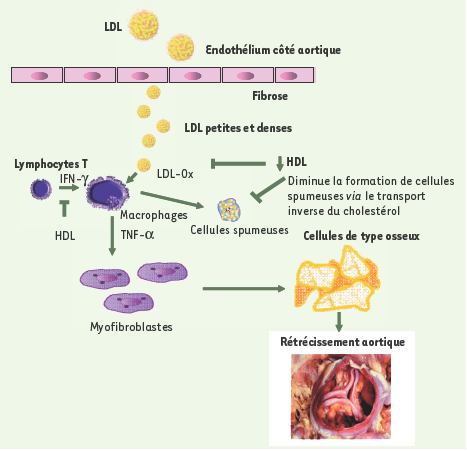
D’un point de vue physiopathologique, plusieurs éléments du SM pourraient favoriser le développement et la progression du RA (Figure 2). Tout d’abord, la diminution du taux de HDL (high density lipoproteins)-cholestérol, un puissant anti-oxydant, ainsi que la présence de particules de LDL (low density lipoproteins) petites et denses pourraient faciliter l’infiltration et l’oxydation des LDL dans les feuillets de la valve. À leur tour, les LDL oxydées sont de puissants activateurs d’inflammation et de calcification. De plus, le tissu adipeux viscéral constitue une importante source de cytokines inflammatoires dont l’interleukine-6 et le tumor necrosis factor α (TNF-α) [
9]. Ainsi, l’obésité abdominale pourrait exacerber la réponse inflammatoire aux stimulus environnementaux et, en particulier, aux LDL oxydées. Les adipokines, dont l’adiponectine, qui est réduite en présence du SM pourraient également jouer un rôle dans la progression de la maladie valvulaire. En effet, l’adiponectine augmente la sensibilité à l’insuline et est dotée de propriétés anti-athérogéniques et anti-inflammatoires [
10]. 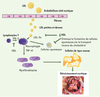 | Figure 2.
Présentation de quelques mécanismes susceptibles d’expliquer le lien entre le syndrome métabolique et le rétrécissement aortique. LDL-Ox : LDL oxydées ; IFN-γ : interféron γ ; TNF-α : tumor necrosis factor α. |
Effets sur les bioprothèses Par ailleurs, nous avons récemment démontré dans une cohorte de 217 patients ayant subi un RVA que le SM constitue aussi un puissant facteur de risque de dégénérescence tissulaire des bioprothèses [
11]. En effet, dans cette étude, la proportion de patients victimes d’une détérioration significative de la performance hémodynamique de leur bioprothèse durant le suivi (3 ± 2 ans) était environ 2 fois plus élevée chez les patients avec SM (41 %) que chez ceux indemnes de SM (25 %). Ces résultats sont d’autant plus inattendus que les tissus d’origine porcine ou bovine utilisés pour fabriquer les bioprothèses sont fixés à l’aide du glutaraldéhyde, détruisant ainsi les éléments cellulaires de la valve avant l’implantation. De ce fait, la dégénérescence des bioprothèses était considérée, jusqu’à tout récemment, comme un phénomène purement passif lié aux propriétés physico-chimiques des tissus implantés. Cependant, les résultats de nos travaux suggèrent, au contraire, que des processus pathologiques actifs de nature biologique pourraient aussi contribuer à la détérioration des bioprothèses. Cela ouvre donc de nouvelles perspectives de traitement dont l’effet serait de retarder, voire de bloquer, la dégénérescence des bioprothèses. Parce qu’elles démontrent que le SM est associé à une progression plus rapide de la maladie valvulaire aortique, les suites pratiques de ces études [7, 8, 11] sont donc que : (1) les patients avec SM (soit environ 40 % de la population de patients porteurs de RA) devraient être suivis de façon plus rapprochée ; et (2) le SM devrait être considéré comme une nouvelle cible de traitement pour ces patients. Une amélioration des habitudes de vie (exercice, meilleur régime alimentaire, etc.) est probablement le moyen le plus efficace pour lutter contre les effets délétères de l’obésité abdominale et du SM [5]. Des approches pharmacologiques ciblant les causes et les effets du SM pourraient aussi être envisagées mais en deuxième lieu. À cet égard, il faut souligner que les médicaments qui sont actuellement considérés et/ou testés dans le but de ralentir la progression du RA, soit les statines et les inhibiteurs de l’enzyme de conversion de l’angiotensine [1,
2, 4,
12–
14] n’ont que peu d’effet sur les principales perturbations métaboliques associées au SM [5, 6]. À la lumière de ces résultats, il s’avère donc important de réaliser de nouvelles études prospectives afin d’identifier les éléments du SM qui sont directement en cause dans la progression du RA afin de permettre l’identification de nouvelles cibles qui répondront efficacement aux traitements pour lutter contre cette maladie. La publication de plusieurs études rétrospectives a permis de fonder beaucoup d’espoir sur l’efficacité des statines dans le traitement du RA [12,
13]. Cependant, un essai clinique récent n’a démontré aucune différence entre le groupe traité avec Atorvastatin et le groupe traité avec placebo à l’égard de la progression du RA [14]. Cet échec peut s’expliquer, en partie, par les raisons suivantes : (1) une intervention trop tardive dans le cours de la maladie. En effet, la plupart des patients avaient déjà un RA modéré ou sévère et donc un degré de calcification valvulaire élevé au moment de leur entrée dans l’étude ; (2) un biais de sélection. Les patients chez lesquels on avait identifié des facteurs de risque cardiovasculaire étaient exclus de l’étude car il aurait été éthiquement inacceptable de les inclure dans une étude randomisée avec placebo. D’autres études sont donc nécessaires pour vérifier si l’utilisation des statines, en particulier dans les stades précoces de la maladie, permet de ralentir sa progression. En outre, la mise en évidence d’un lien entre le SM et le RA suggère, qu’au-delà des statines, d’autres classes de médicaments, tels que les fibrates, les glitazones et les inhibiteurs des récepteurs endocannabinoïdes pourraient s’avérer efficaces pour traiter le RA [5, 6]. Il faut aussi souligner qu’au cours des dernières années, des progrès importants ont été accomplis dans le domaine de la génétique des maladies valvulaires [
15–
17]. Tout d’abord, il a été démontré que la bicuspidie valvulaire aortique, laquelle prédispose au RA, est presque entièrement déterminée de façon génétique [
18]. Des études ont, de plus, établi une association entre le RA et le polymorphisme de l’apolipoprotéine E ainsi que celui du récepteur de la vitamine D [15,
16]. Une mutation de Notch1 a été décrite dans une famille dont les membres sont porteurs de RA [17]. Cette mutation pourrait favoriser la différenciation ostéoblastique des fibroblastes au sein de la valve. Ces observations vont certainement aider à dévoiler les mécanismes pathologiques du RA et ainsi contribuer à mettre au point de nouveaux traitements. |
Évaluation de la sévérité hémodynamique du rétrécissement aortique et indications chirurgicales Les études portant sur la pathogénie du RA sont cruciales car elles devraient permettre d’aboutir à un traitement pharmacologique efficace pour ralentir ou bloquer le RA. Cependant, jusqu’à maintenant le remplacement valvulaire aortique (RVA) demeure le seul traitement efficace. Selon les guides de pratique de l’American Heart Association et de l’American College of Cardiology (AHA/ACC), la décision d’effectuer un RVA est dictée par 2 critères [
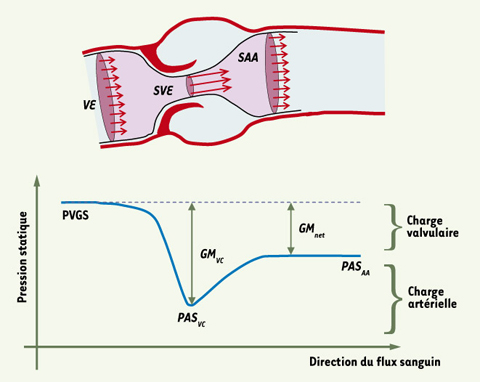
19] : (1) la présence d’un RA sévère et (2) la présence de symptômes. Il est donc essentiel d’évaluer de façon précise la sévérité du RA. Les indices de sévérité qui sont actuellement les plus utilisés sont le gradient de pression transvalvulaire et la surface valvulaire effective (SVE). La SVE peut être mesurée par échocardiographie-Doppler en utilisant l’équation de continuité ou par cathétérisme cardiaque en utilisant la formule de Gorlin. La SVE est actuellement l’indice recommandé par l’AHA/ACC pour estimer le degré de sévérité du RA et en suivre l’évolution hémodynamique [19]. Ainsi une sténose est considérée comme modérée, sévère ou critique selon que la SVE est respectivement ≤ 1,5 cm2 et > 1 cm2, ≤ 1 cm2 et > 0,75 cm2, ou ≤ 0,75 cm2. Cependant, il est bien connu que des patients avec un RA ayant une SVE similaire peuvent exprimer des symptômes et une évolution clinique fort différents [19]. Ainsi, ces observations suggèrent que des facteurs autres que la SVE sont en cause dans la physiopathologie du RA et, dans ce contexte, l’affinement du diagnostic et l’amélioration du traitement de la maladie passent donc par une meilleure identification de ces facteurs et de leurs manifestations cliniques. Le phénomène de recouvrement de pression Nous avons observé au cours d’une étude réalisée in vitro sur banc d’essais que, pour un même degré de RA, soit pour une même SVE, la perte d’énergie ventriculaire gauche liée au RA était systématiquement plus élevée avec une aorte de grande taille plutôt qu’avec une aorte de petite taille [
20]. En présence d’un RA, il y a une perte d’énergie due aux turbulences engendrées dans le jet transvalvulaire. Si la chambre réceptrice, c’est-à-dire la racine aortique dans le cas de la valve aortique, est de petite taille, le jet se ré-attache rapidement à la paroi aortique et une partie de l’énergie potentielle (celle de la pression sanguine) perdue en amont est récupérée en aval ; il s’agit du phénomène de recouvrement de pression (Figure 3). En revanche, si le diamètre aortique est plus grand, le jet se disperse, il y a plus de turbulences : l’énergie récupérée est faible ou inexistante. Nous avons donc proposé un nouvel indice, l’indice de perte d’énergie (IPE) qui tient compte de la SVE et de la surface de section de l’aorte ascendante (SAA) : IPE = (SVE×SAA)/(SAA-SVE). Contrairement à la SVE, cet indice permet d’estimer de façon précise (r > 0,98) la perte d’énergie ventriculaire reliée au RA et il s’avère également supérieur aux indices habituels (SVE et gradient) pour prédire la survenue d’un dysfonctionnement ventriculaire gauche et d’autres complications [ 20,
21]. Ce nouvel indice est facilement mesurable par échocardiographie-Doppler et il a donc le potentiel de devenir très utile pour le suivi et le traitement de ces patients. 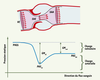 | Figure 3.
Représentation schématique du flux et de la pression sanguine à travers la voie de chasse du ventricule gauche, la valve aortique et l’aorte ascendante. VE : volume d’éjection ; SVE : surface valvulaire effective ; SAA : section de l’aorte ascendante ; PVGS : pression ventriculaire gauche systolique ; PAS
VC
: pression aortique systolique au niveau de la vena contracta ; PAS
AA
: pression aortique systolique au niveau de l’aorte ascendante ; GM
VC
: gradient transvalvulaire moyen au niveau de la vena contracta ; GM
net
: gradient transvalvulaire moyen net (modifié d’après [ 20] avec la permission de l’ American College of Cardiology). |
Dans une deuxième étude, nous avons aussi démontré que les différences observées entre la SVE mesurée par échocardiographie-Doppler et la SVE mesurée par cathéter s’expliquent essentiellement par le phénomène de recouvrement de pression survenant en aval du RA (Figure 3) [
22]. En effet, la mesure de la SVE par échocardiographie-Doppler est fondée sur l’enregistrement de la vélocité du jet transvalvulaire à hauteur de la vena contracta (endroit où le jet est le plus étroit et où la vélocité est donc maximale). Cette SVE ne tient donc pas compte du recouvrement de pression qui survient en aval de la vena contracta. En revanche, la SVE mesurée par cathéter repose sur la mesure de la pression aortique effectuée à quelques centimètres en aval de la valve aortique : elle tient donc compte du recouvrement de pression. De plus, nous avons démontré que l’IPE mesuré par échocardiographie-Doppler permettait de prédire la SVE mesurée par cathéter, conciliant ainsi les discordances entre ces deux méthodes diagnostiques. Ce travail remet en cause les critères d’évaluation de la sévérité du RA proposés dans les recommandations officielles de l’AHA/ACC dans lesquelles on ne fait, en effet, aucune distinction entre la SVE mesurée par échocardiographie-Doppler et celle mesurée par cathéter [19]. Les critères de sévérité recommandés par l’AHA/ACC (mentionnés plus haut) peuvent être appliqués directement à la SVE mesurée par cathéter mais ils ne sont pas nécessairement appropriés pour la SVE mesurée par échocardiographie-Doppler particulièrement chez les patients ayant une racine aortique de petite taille (diamètre à la jonction sino-tubulaire ≤ 30 mm). Ainsi, lorsqu’on utilise l’échocardiographie-Doppler pour évaluer la sévérité du RA, la mesure de l’IPE évitera une surestimation de la sévérité de la maladie qui aurait éventuellement pour conséquences des interventions chirurgicales inutiles et onéreuses. Interaction entre rétrécissement aortique et hypertension artérielle Récemment, nous nous sommes intéressés à la problématique de l’évaluation de la sévérité du RA chez des patients souffrant, de façon concomitante, d’hypertension artérielle systémique (HTA) [ 21,
23,
24], une situation fréquente que l’on rencontre en moyenne chez 30 à 40 % des patients porteurs d’un RA [ 21,
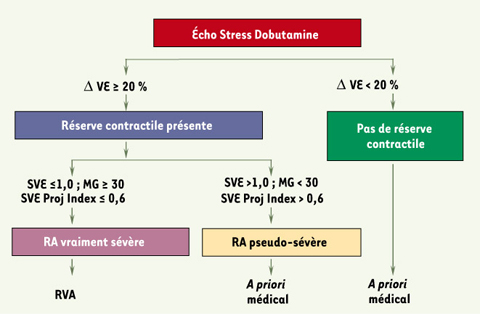
25]. Pour ce faire, nous avons utilisé un modèle porcin de sténose supravalvulaire aortique avec HTA induite par constriction de l’aorte abdominale ou par perfusion de phényléphrine [ 23]. Dans ce modèle, l’HTA induisait une diminution importante des gradients de pression transvalvulaire et une augmentation de la SVE mais en dépit de cette diminution des gradients transvalvulaires, le stress ventriculaire gauche systolique augmentait de façon importante durant l’HTA. Ainsi, cette étude nous a démontré que la sévérité du RA peut être masquée par la présence concomitante d’une HTA ; elle nous suggère donc que les indices de sévérité du RA doivent être interprétés avec prudence chez les patients hypertendus ; il serait dès lors nécessaire de procéder à une réévaluation de leur RA après normalisation de leur pression artérielle systémique. Dans une autre étude menée celle-là sur 208 patients porteurs d’un RA [21], nous avons aussi constaté que près de 40 % d’entre eux présentent une compliance artérielle systémique anormalement basse, favorisant ainsi l’apparition d’une hypertension artérielle systolique. Cela n’est pas surprenant puisque le RA est plus fréquent dans la population vieillissante laquelle est également atteinte d’artériosclérose. En outre, ce phénomène a pour conséquence d’imposer une double charge sur le ventricule gauche (valvulaire + vasculaire). Nous avons donc proposé un nouvel indice mesurable par échocardiographie-Doppler permettant de mieux évaluer la postcharge globale du ventricule gauche chez les patients ayant un RA et/ou une HTA : l’impédance valvulo-artérielle (ZVA) qui peut se calculer facilement au moyen de la formule suivante : ZVA = (PAS + GM)/VEi, où PAS est la pression artérielle systolique, GM est le gradient moyen à travers la valve aortique et VEi est le volume d’éjection indexé par rapport à la surface corporelle. L’impédance valvulo-artérielle qui reflète à la fois la charge imposée par la valve aortique et celle imposée par le système artériel (Figure 3) était un facteur prédictif puissant et indépendant de la survenue de dysfonctionnement VG diastolique et systolique (fraction d’éjection VG < 50 %) [21]. En résumé, l’HTA peut masquer la sévérité du RA. La pression artérielle doit donc être mesurée systématiquement lorsqu’on évalue un patient pour RA. Les indices de sévérité du RA (SVE, gradient, etc.) doivent être aussi interprétés avec prudence chez les patients hypertensifs et être réévalués après normalisation de la pression artérielle. Enfin, outre les indices de sévérité du RA, il est important de mesurer la compliance artérielle systémique et l’impédance valvulo-artérielle afin d’obtenir une estimation plus précise de la postcharge globale imposée sur le ventricule gauche et de mieux apprécier les effets respectifs de la valve aortique et du système artériel sur la fonction ventriculaire gauche et l’état symptomatique des patients avec RA, permettant ainsi de mieux adapter le traitement sur la valve (RVA) et/ou sur les artères (inhibiteurs de l’enzyme de conversion de l’angiotensine ou inhibiteurs des récepteurs de l’angiotensine II). Le rétrécissement aortique à bas débit : un défi diagnostique et thérapeutique Le RA à bas débit et bas gradient est caractérisé par les signes suivants : une SVE ≤ 1 cm 2, un gradient transvalvulaire moyen ≤ 30 mmHg et une fraction d’éjection ≤ 40 %. Cet état se manifeste chez environ 5 % de la population des patients avec RA et elle représente un grand défi autant sur le plan diagnostique que thérapeutique. Dans un état de bas débit cardiaque, la force appliquée sur les feuillets valvulaires aortiques peut ne pas être assez grande pour ouvrir complètement la valve et le calcul de la SVE peut donc surestimer la sévérité du RA. C’est pour cette raison qu’il est difficile de distinguer les patients affectés d’un RA léger ou modéré et, de façon concomitante, un dysfonctionnement systolique du ventricule gauche (RA pseudo-sévère, RAPS) de ceux qui sont affligés d’un RA vraiment sévère (RAVS). Dans les deux cas, le gradient transvalvulaire au repos est bas à cause du faible débit transvalvulaire et la SVE est également réduite à cause de la diminution de la force d’ouverture qui s’exerce sur les feuillets aortiques. La distinction entre les deux sous-groupes est essentielle parce que les patients avec un RAVS vont généralement bénéficier d’un RVA tandis que ceux avec un RAPS n’en bénéficieront pas. Cette distinction est d’autant plus importante que la mortalité opératoire des suites d’un RVA est très élevée (8 % à 30 %) chez ces patients. L’échocardiographie-Doppler avec stimulation par de la dobutamine à faible dose (jusqu’à 20 µg/kg/min) est utile pour décider du type de traitement, médical ou chirurgical, pour ces patients avec RA à bas débit. Cet examen a deux objectifs principaux :
-
Évaluer la sévérité du RA. Les principaux critères proposés pour différencier un RAVS d’un RAPS sont une valeur de la SVE demeurant en dessous de 1 cm2 et/ou une valeur du gradient augmentant au delà de 30 mmHg sous dobutamine (Figure 4). Cependant, la principale limitation de cette approche est que tous les indices de sévérité du RA (SVE, gradient, résistance valvulaire, etc.) sont influencés par le débit transvalvulaire [
26]. Or, le débit obtenu lors d’une stimulation à la dobutamine peut varier considérablement d’un patient à l’autre ce qui rend difficile la généralisation de ces critères. Récemment, nous avons donc proposé un nouvel indice, la SVE projetée à débit normal, qui permet de corriger la variabilité liée au débit et ainsi de mieux distinguer les RAVS des RAPS [
27]. Une SVE projetée et indéxée par rapport à la surface corporelle ≤ 0,6 cm2/m2 est le critère le plus sensible et le plus spécifique pour identifier un RAVS (Figure 4).
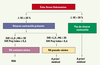 | Figure 4.
Proposition d’un algorithme décisionnel pour le traitement du rétrécissement aortique (RA) à bas débit. SVE : surface valvulaire effective ; SVE proj index : SVE projetée à débit normal et indexée par rapport à la surface corporelle ; VE : volume d’éjection systolique du VG. |
-
Évaluer la réserve contractile du ventricule gauche. Celle-ci est en général évaluée à partir de la capacité du ventricule à augmenter le volume d’éjection ou la fraction de volume d’éjection durant le test à la dobutamine [
28].
Le RVA est indiqué lorsque l’échocardiographie à la dobutamine confirme la présence d’un RAVS et d’une réserve contractile adéquate (Figure 4). Les patients avec un RAPS sont en principe traités médicalement mais des études ultérieures seront nécessaires pour déterminer si certains d’entre eux ne pourraient pas bénéficier d’un traitement chirurgical en cas d’insuccès du traitement médical. Pour les patients ayant peu ou pas de réserve contractile, l’utilité du RVA demeure, elle aussi, incertaine et controversée. En effet, en l’absence de réserve contractile, le pronostic est en général sombre quels que soient la sévérité de la sténose et le type de traitement utilisé [28]. Lorsqu’un RVA est effectué sur un patient avec RA à bas débit, il est recommandé d’éviter, autant que possible, la disproportion patient-prothèse (DPP). Ce problème survient lorsque la SVE de la prothèse implantée est trop petite par rapport à la surface corporelle du patient (et donc par rapport à ses besoins en termes de débit cardiaque) [
29]. La conséquence immédiate de la DPP est la persistance d’un gradient transvalvulaire élevé à travers la prothèse après le RVA. La DPP constitue un problème fréquent chez les patients subissant un RVA : de 20 à 70 % selon le type de prothèse utilisé [29]. Les sujets présentant une DPP développent une moins bonne amélioration symptomatique, une moins bonne performance hémodynamique au repos et à l’effort, ils sont davantage exposés à des complications et enregistrent un taux de survie plus bas [29–
31]. En particulier, nous avons démontré que la DPP est la principale cause de la mortalité opératoire chez les patients avec RA à bas débit [
30]. Ces résultats soulignent la nécessité d’éviter la DPP chez ces patients. À ce stade, il est important de mentionner que la DPP est un facteur de risque modifiable qui peut être, en partie, évité par la mise en place d’une stratégie préventive au moment de l’opération [29]. Lorsqu’un risque de DPP, a fortiori de DPP sévère, est envisagé, il est alors recommandé d’implanter la prothèse offrant la meilleure SVE possible afin d’éviter la DPP ou, à tout le moins, de diminuer sa sévérité. |
Le RA a longtemps été considéré comme une maladie purement dégénérative. Les résultats présentés dans cet article viennent, au contraire, étayer le concept selon lequel le RA est une maladie active qui présente de nombreuses similitudes avec l’athérosclérose et qui, de ce fait, serait susceptible d’être modifiée grâce à des changements de comportement et/ou diverses interventions pharmacologiques. En outre, ces résultats rappellent que le RA n’est pas une maladie isolée qui se limite seulement à l’altération de la valve aortique. Le RA est, en effet, souvent associé à une atteinte de l’arbre artériel et, en particulier, à une diminution de la compliance artérielle qui a des répercussions importantes sur la pathophysiologie et l’évolution clinique de cette maladie. Ainsi, l’évaluation de la sévérité du RA et l’approche thérapeutique qui en découle doivent être effectuées selon une perspective globale qui intègre non seulement la valve aortique mais aussi le réseau artériel et le ventricule gauche, car ces trois entités sont étroitement intriquées autant sur le plan pathophysiologique que sur le plan hémodynamique. |
Footnotes |
1. Rajamannan NM, Gersh B, Bonow RO. Calcific aortic stenosis: from bench to the bedside-emerging clinical and cellular concepts. Heart 2003; 89 : 801–5. 2. Freeman RV, Otto CM. Spectrum of calcific aortic valve disease: pathogenesis, disease progression, and treatment strategies. Circulation 2005; 111 : 3316–26. 3. Otto CM, O’Brien KD. Why is there discordance between calcific aortic stenosis and coronary artery disease ? Heart 2001; 85 : 601–2. 4. Chan KL. Is aortic stenosis a preventable disease ? J Am Coll Cardiol 2003; 42 : 593–9. 5. Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet 2005; 365 : 1415–28. 6. Junquero D, Rival Y. Syndrome métabolique : quelle définition pour quels traitements ? Med Sci
(Paris) 2005; 21 : 1045–53. 7. Drolet MC, Roussel E, Deshaies Y, et al. A high fat/high carbohydrate diet induces aortic valve disease in C57BL/6J mice. J Am Coll Cardiol 2006; 47 : 850–5. 8. Briand M, Lemieux I, Dumesnil JG, et al. Metabolic syndrome negatively influences disease progression and prognosis in aortic stenosis. J Am Coll Cardiol 2006; 47 : 2229–37. 9. Després JP. Inflammation and cardiovascular disease: is abdominal obesity the missing link ? Int J Obes Relat Metab Disord 2003; 27 (suppl 3) : S22–4. 10. Lihn AS, Pedersen SB, Richelsen B. Adiponectin: action, regulation and association to insulin sensitivity. Obes Rev 2005; 6 : 13–21. 11. Briand M, Pibarot P, Despres JP, et al. Metabolic syndrome is associated with faster degeneration of bioprosthetic valves. Circulation 2006; 114 (suppl 1) : I512–7. 12. Bellamy MF, Pellikka PA, Klarich KW, et al. Association of cholesterol levels, hydroxymethylglutaryl coenzyme-a reductase inhibitor treatment, and progression of aortic stenosis in the community. J Am Coll Cardiol 2002; 40 : 1723–30. 13. Rosenhek R, Rader F, Loho N, et al. Statins but not angiotensin-converting enzyme inhibitors delay progression of aortic stenosis. Circulation 2004; 110 : 1291–5. 14. Cowell SJ, Newby DE, Prescott RJ, et al. A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N Engl J Med 2005; 352 : 2389–97. 15. Novaro GM, Sachar R, Pearce GL, et al. Association between apolipoprotein e alleles and calcific valvular heart disease. Circulation 2003; 108 : 1804–8. 16. Ortlepp JR, Hoffmann R, Ohme F, et al. The vitamin D receptor genotype predisposes to the development of calcific aortic valve stenosis. Heart 2001; 85 : 635–8. 17. Garg V, Muth AN, Ransom JF, et al. Mutations in Notch1 cause aortic valve disease. Nature 2005; 437 : 270–4. 18. Cripe L, Andelfinger G, Martin LJ, et al. Bicuspid aortic valve is heritable. J Am Coll Cardiol 2004; 44 : 138–43. 19. Bonow RO, Carabello BA, de Leon AC Jr, et al. Guidelines for the management of patients with valvular heart disease. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association task force on practice guide. Circulation 2006; 114 : 84–231. 20. Garcia D, Pibarot P, Dumesnil JG, et al. Assessment of aortic valve stenosis severity: A new index based on the energy loss concept. Circulation 2000; 101 : 765–71. 21. Briand M, Dumesnil JG, Kadem L, et al. Reduced systemic arterial compliance impacts significantly LV afterload and functions in aortic stenosis: implications for diagnosis and treatment. J Am Coll Cardiol 2005; 46 : 291–8. 22. Garcia D, Dumesnil JG, Durand LG, et al. Discrepancies between catheter and Doppler estimates of valve effective orifice area can be predicted from the pressure recovery phenomenon: practical implications with regard to quantification of aortic stenosis severity. J Am Coll Cardiol 2003; 41 : 435–42. 23. Kadem L, Dumesnil JG, Rieu R, et al. Impact of systemic hypertension on the assessment of aortic stenosis. Heart 2005; 91 : 354–61. 24. Garcia D, Barenbrug PJ, Pibarot P, et al. A ventricular-vascular coupling model in presence of aortic stenosis. Am J Physiol Heart Circ Physiol 2005; 288 : 1874–84. 25. Antonini-Canterin F, Huang G, Cervesato E, et al. Symptomatic aortic stenosis: does systemic hypertension play an additional role ? Hypertension 2003; 41 : 1268–72. 26. Blais C, Pibarot P, Dumesnil JG, et al. Comparison of valve resistance with effective orifice area regarding flow dependence. Am J Cardiol 2001; 1 : 45–52. 27. Blais C, Burwash IG, Mundigler G, et al. The projected valve area at normal flow rate improves the assessment of stenosis severity in patients with low flow aortic stenosis: the multicenter TOPAS (truly or pseudo severe aortic stenosis) study. Circulation 2006; 113 : 711–21. 28. Monin JL, Quere JP, Monchi M, et al. Low-gradient aortic stenosis: operative risk stratification and predictors for long-term outcome: a multicenter study using dobutamine stress hemodynamics. Circulation 2003; 108 : 319–24. 29. Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart 2005; 92 : 1022–9. 30. Blais C, Dumesnil JG, Baillot R, et al. Impact of prosthesis-patient mismatch on short-term mortality after aortic valve replacement. Circulation 2003; 108 : 983–8. 31. Tasca G, Mhagna Z, Perotti S, et al. Impact of prosthesis-patient mismatch on cardiac events and midterm mortality after aortic valve replacement in patients with pure aortic stenosis. Circulation 2006; 113 : 570–6. 32. Andelfinger G. La valve aortique n’a pas révélé tous ses secrets. Med Sci (Paris) 2007; 23 : 93–4. |