| |
| Med Sci (Paris). 2007 November; 23(11): 939–943. Published online 2007 November 15. doi: 10.1051/medsci/20072311939.La rétinopathie du prématuré Rôle de l’acide trans arachidonique dans la dégénérescence des micro-vaisseaux de la rétine Martin Leduc,1,2 Elsa Kermorvant-Duchemin,1 Daniella Checchin,1,3 Florian Sennlaub,1,4 and Sylvain Chemtob1,3* 1Départements de pédiatrie, d’ophtalmologie et de pharmacologie, Centre de recherche, CHU Sainte-Justine, Montréal, Québec, H3T 1C5 Canada 2Département de biochimie, Université de Montréal, Montréal, Québec, H3C 3J7, Canada 3Department of Pharmacology and Therapeutics, McGill University, Montréal, Québec, H3G 1Y6 Canada 4Inserm, Unité 598, Institut biomédical des Cordeliers, 75006 Paris, France |
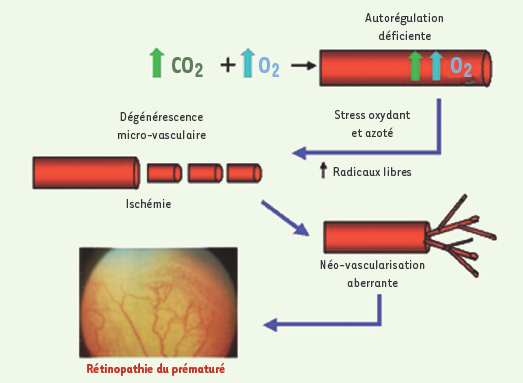
Les rétinopathies prolifératives provoquées par ischémie, telles que les rétinopathies des prématurés (RDP) et des diabétiques, sont caractérisées par un rétrécissement puis une dégénérescence des capillaires des micro-vaisseaux rétiniens [
1] (Figure 1). Cette situation peut entraîner une néo-vascularisation pré-rétinienne aberrante dans le corps vitré pouvant mener à la cécité. Avec 6 à 18 % des cas, la RDP représente la deuxième cause de cécité dans les pays industrialisés [
2]. L’excès d’oxygène (O2) et la formation de radicaux libres qui en résulte, particulièrement chez le sujet dont les défenses antioxydantes sont immatures, constituent des facteurs majeurs de la pathogenèse de la RDP [1]. Non seulement ces formes actives oxygénées aggravent-elles directement les dommages causés à la micro-vasculature [1] mais encore elles peuvent réagir avec le monoxyde d’azote (NO•) pour engendrer des formes hautement réactives d’azote [
3], comme le peroxynitrite, le dioxyde d’azote (NO2
•) et le trioxyde de diazote (N2O3), dont les effets néfastes sur les fonctions cellulaires sont connus sous le nom de stress azoté [
4]. Les mécanismes proposés pour expliquer ces effets néfastes comprennent l’inactivation de la respiration mitochondriale, la modulation de l’expression de gènes, principalement à la suite d’une nitration de protéines et de l’ADN ainsi que la peroxydation de lipides [
5]. Plusieurs études ont démontré le rôle critique du stress azoté dans les rétinopathies ischémiques (voir revue [1]). De son côté, l’acide trans-arachidonique (ATA), qui résulte de l’isomérisation de l’acide arachidonique via l’action du NO2
•, vient élargir le tableau de la toxicité associée au NO2
• [
6].  | Figure 1.
Développement de la rétinopathie du prématuré. Des concentrations élevées de CO2 provoquent une vasodilatation menant à une augmentation du débit sanguin rétinien, accompagnée d’une augmentation de l’apport d’O2. L’excès d’O2 et de CO2 mène à la formation de radicaux libres et à l’installation d’un stress oxydant et azoté, qui causent des dommages aux micro-vaisseaux. Cela provoque une ischémie suivie d’une néo-vascularisation pré-rétinienne aberrante. |
Une pression partielle de dioxyde de carbone (CO2) élevée dans le sang (hypercapnie), état qui affecte souvent les nouveau-nés atteints de dysplasie broncho-pulmonaire, peut aussi contribuer à l’apparition de la RDP [
7]. L’hypercapnie provoque une vasodilatation menant à une augmentation du débit sanguin rétinien, et donc un apport accru en O2 [
8], qui favorise l’apparition du stress azoté [
9]. Dans cet article nous abordons deux aspects inter-reliés et associés au stress azoté dans l’apparition de la RDP : (1) le mécanisme d’atténuation de la néo-vascularisation par l’hypercapnie, avec pour conséquence le stress azoté ; et (2) les effets et les mécanismes d’action des ATA comme médiateurs du stress azoté, avec pour suite la dégénérescence micro-vasculaire. |
Stress azoté induit par l’hypercapnie L’hypercapnie nuit à la néo-vascularisation rétinienne L’ischémie provoque une déficience en nutriments et en O 2 mais cause simultanément une augmentation de la concentration locale de CO 2 [
10]. Cette hypercapnie est due à une diminution de l’élimination des déchets, à la production aérobie de CO 2 jusqu’à l’épuisement des réserves d’O 2 et à une augmentation de la production anaérobie de CO 2 à partir du tamponnage d’ions hydrogènes (dérivés de la décomposition d’acides organiques) par le bicarbonate [ 10]. L’exposition de cellules endothéliales à l’hypercapnie entraîne une inhibition de leur prolifération, de leur migration et de leur différenciation en structures capillaires [
11]. Chez le sujet encore en phase de développement (nourrisson prématuré), l’hypercapnie nuit à la néo-vascularisation et à l’angiogenèse rétiniennes [ 7,
12] et contribue à l’apparition de la RDP. L’hypercapnie augmente l’expression d’eNOS et la nitration Nous avons montré que l’expression de la monoxyde d’azote synthase endothéliale ( endothelial Nitric Oxide Synthase, eNOS) augmente fortement dans la rétine de rats exposés à une hypercapnie induite par 10 % de CO 2 (PaCO 2 ~ 70 mm Hg) pendant les six premiers jours postnataux [ 12]. Des augmentations similaires de l’expression d’eNOS ont été observées lors d’ischémies cérébrales et cardiaques [
13,
14]. L’induction rapide d’eNOS dans la rétine en développement, associée à l’hypercapnie, suggère que des niveaux élevés de CO 2 jouent un rôle important sur la régulation d’eNOS ; celle-ci est accompagnée d’une hausse de la production de nitrite (le principal métabolite stable du NO •) [ 12]. Par ailleurs, nous savons que le CO2 peut favoriser la nitration (l’introduction d’un radical NO2
• dans un composé organique) en catalysant la conversion du peroxynitrite en nitrosoperoxocarbonate, un agent de nitration hautement efficace [9]. Ainsi, les niveaux des marqueurs de nitration 3-nitrotyrosine (NT) et les ATA augmentent de façon marquée dans la rétine de rats exposés à l’hypercapnie [12]. Des expériences d’histochimie et d’immunocytochimie ont permis de localiser l’augmentation de NT principalement dans les cellules endothéliales, mais aussi dans les astrocytes qui sont en contact avec ces dernières [12] ; ces résultats concordent avec les dommages micro-vasculaires observés dans la RDP [1]. Afin de confirmer l’effet de la nitration provoquée par l’hypercapnie sur le développement micro-vasculaire de la rétine, nous avons inhibé la NOS et favorisé la décomposition du peroxynitrite en injectant respectivement dans le corps vitré oculaire du N-nitro-L-arginine-methylester (L-NAME) et du chlorure de 5, 10, 15, 20-tetrakis (4-sulfonatophényl) porphyrinato-Fe (III) (FeTPPS). Ces deux agents ont prévenu la diminution de la vascularisation de la rétine en tant que conséquence secondaire à l’hypercapnie, tandis qu’un inhibiteur des NOS inductible (iNOS) et neuronale (nNOS), (le 1-(2-trifluorométhylphényl) imidazole) s’est montré inefficace [12]. L’hypercapnie affecte la viabilité cellulaire Étant donné que l’hypercapnie est associée à l’hyperémie, les effets cytotoxiques directs de l’hypercapnie ne peuvent pas être distingués des effets découlant de l’hyperoxie associée. Nous avons donc vérifié si l’ajout de niveaux physiologiques de NO • (avec le donneur de NO • DETA NONOate) en présence de 5 ou 10 % de CO 2 ( PaCO 2 respectivement de ~ 35 et 70 mmHg) en maintenant le pourcentage d’O 2 à 21 %, pouvait causer la mort de cellules endothéliales neurorétiniennes primaires en culture. Nous avons observé que la viabilité des cellules endothéliales en réponse au DETA NONOate était réduite sous des conditions hypercapniques, tandis que la viabilité des astrocytes n’était pratiquement pas affectée [ 12]. Dans l’ensemble, nos observations in vitro et in vivo démontrent donc que l’hypercapnie, indépendamment d’une variation des niveaux d’oxygénation, suscite un stress azoté qui est tout d’abord néfaste pour la viabilité des cellules endothéliales, et, par la suite, pour la vascularisation de la rétine en voie de formation. |
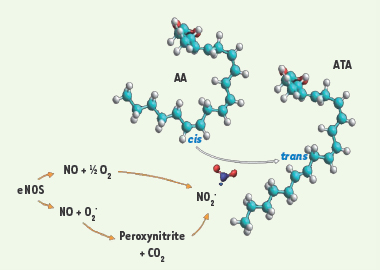
Les acides trans-arachidoniques (ATA) et la dégénérescence micro-vasculaire Les ATA et le stress azoté L’acide arachidonique (AA) est un acide gras abondant localisé dans les membranes cellulaires ; il est un précurseur de plusieurs médiateurs lipidiques importants. Un nouveau procédé de peroxydation où le NO 2
• entraîne l’isomérisation non enzymatique cis à trans de l’AA a récemment été décrit [
15] (Figure 2). Cette réaction dépendante du stress azoté engendre quatre mono-isomères stables d’ATA pouvant circuler librement dans le plasma humain : 5 E-AA, 8 E-AA, 11 E-AA et 14 E-AA [
16] ; bien que les deux derniers se retrouvent également dans l’alimentation, les quatre sont endogènes à l’organisme [ 6]. Jusqu’à récemment, les effets biologiques des ATA n’étaient pas connus. Nous avons évalué le rôle des ATA sur la vascularisation rétinienne dans un modèle de rétinopathie provoquée par oxygène (RPO) ; tout comme pour les rétinopathies résultant d’hypercapnie décrites précédemment, l’exposition à l’O 2 au cours d’une RPO mène à une augmentation du stress azoté [
17], ce qui devrait favoriser l’isomérisation de l’AA en ATA. Effectivement, nous avons observé une augmentation significative de la concentration des ATA libres (non-estérifiés aux phospholipides) et totaux (libres + liés aux phospholipides) dans un modèle expérimental de RPO, où des ratons et des souriceaux de 7 jours (P7) sont exposés à 75-80 % d’O 2 ou à l’air ambiant pendant 24 h [ 5]. L’injection dans le corps vitré de l’inhibiteur de NOS, le L-NAME avant l’exposition des animaux à l’O 2, ainsi que l’utilisation de souris C57/BL6 dont le gène eNOS est invalidé, ont empêché l’augmentation des niveaux d’ATA stimulée par l’O 2, associant la eNOS dans le stress azoté lors de la formation d’ATA dans la rétine [ 5]. 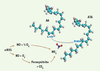 | Figure 2.
Nitration de l’acide arachidonique en acide trans-arachidonique. La monoxyde d’azote synthase endothéliale (eNOS) produit du monoxyde d’azote (NO) qui peut réagir avec l’oxygène ou des radicaux libres dérivés de l’oxygène pour produire du dioxyde d’azote (NO2
•). Ce dernier provoque l’isomérisation cis à trans de l’acide arachidonique (AA), engendrant la formation de l’acide trans-arachidonique (ATA). |
|
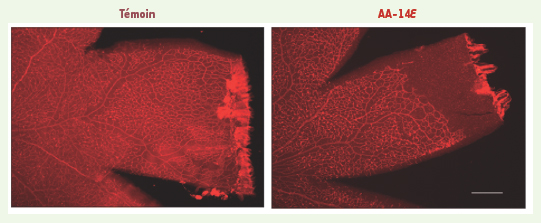
Les ATA provoquent une vaso-oblitération rétinienne par mort cellulaire sélective Chez l’humain au stade fœtal, la vascularisation rétinienne débute vers la 16e semaine de gestation et s’achève avec la naissance au 9e mois. On comprend que les prématurés naissent avec des rétines dont la vasculature est incomplète et vulnérable à l’oxygénation excessive en milieu extra-utérin. Chez les rongeurs, l’angiogenèse rétinienne commence immédiatement après la naissance à terme et les micro-vaisseaux superficiels atteignent l’extrémité de la rétine à l’âge de neuf jours (P9). Nous avons donc utilisé la rétine en voie de formation chez le raton pour étudier les effets des ATA sur la densité vasculaire. Des injections intra-oculaires d’ATA chez des ratons d’âge P6 (Figure 3) ainsi que le traitement d’explants rétiniens de porcelets nouveau-nés avec l’ATA conduisent à une diminution de la densité vasculaire comparativement aux animaux témoins [5]. Ces résultats démontrent que les ATA interfèrent avec l’angiogenèse physiologique et causent une vaso-oblitération, telle qu’observée dans les modèles de RPO [17]. 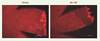 | Figure 3.
Effets de l’acide trans-arachidonique sur la vascularisation rétinienne et la densité vasculaire. Des ratons de 6 jours ont reçu une injection intra-oculaire d’acide trans-arachidonique-14E (14E-AA ; concentration finale estimée à 5 x 10−6 M) ou du véhicule (témoin). À l’âge du 9e jour, leurs vaisseaux sanguins ont été colorés avec la lectine de Griffonia simplicifolia conjuguée au TRITC, puis les rétines ont été montées à plat et photographiées. L’échelle graphique correspond à 500 µm. Les yeux ayant reçu une injection d’ATA ont une superficie de vascularisation de la rétine et une densité vasculaire réduites (p < 0,01) par rapport aux yeux contrôles. |
Afin de caractériser la nature des cellules vasculaires sensibles aux ATA, nous avons déterminé les effets des ATA sur la viabilité de cellules endothéliales neurorétiniennes, d’astrocytes ainsi que de cellules de muscles lisses en culture. Les ATA ont entraîné la mort des seules cellules endothéliales micro-vasculaires en fonction de la concentration et du temps de traitement, en revanche, les cellules de muscle lisse, les astrocytes ainsi que des cellules endothéliales de la veine ombilicale humaine (HUVEC) n’ont pas été affectés par l’exposition aux ATA [5]. La nature de la mort endothéliale micro-vasculaire neurorétinienne observée semble être apoptotique puisque le marquage de TUNEL (qui détecte la fragmentation nucléaire de l’ADN) et l’activité caspase étaient supérieurs dans les cellules exposées aux ATA [5]. L’ensemble de ces résultats concordent avec ceux observés lors d’un stress azoté [12, 17]. Les ATA augmentent l’expression de la thrombospondine-1 La thrombospondine-1 (TSP-1) est une protéine anti-angiogénique sécrétée par les cellules endothéliales. La TSP-1 active son récepteur trans-membranaire CD36 [
18], ce qui provoque l’inhibition de la migration et induit l’apoptose des cellules endothéliales [
19]. Nous avons montré que l’ajout d’ATA à des cellules endothéliales en culture augmente rapidement l’expression de TSP-1 [ 5]. Une augmentation de la quantité de TSP-1 et de son ARNm se manifeste dans l’endothélium rétinien de ratons exposés à une hyperoxie pendant 24 h ; cette augmentation est amoindrie chez des souris dont le gène eNOS est invalidé comparativement aux souris contrôles [ 5]. La kinase ERK1/2 semble intervenir dans la signalisation des ATA puisque l’ajout de l’inhibiteur de mitogen-activated protein kinase (MAPK) PD98059 aux cellules endothéliales en culture diminue l’expression de TSP-1 et la mort cellulaire provoquées par les ATA [ 5]. En revanche, les mécanismes moléculaires menant à une augmentation de l’expression de la TSP-1 par les ATA demeurent inconnus. Nous avons ensuite vérifié le rôle de TSP-1 et de son récepteur CD36 dans la mort des cellules endothéliales et la dégénérescence micro-vasculaire en réponse aux ATA. Des anticorps neutralisants dirigés contre TSP-1 ou CD36 ont complètement bloqué la vaso-oblitération provoquée par l’ATA dans des explants rétiniens de porcelets nouveau-nés [5]. Finalement, la vaso-oblitération rétinienne (causée par le stress azoté et par la production d’ATA) observée chez des rongeurs exposés à l’hyperoxie est significativement atténuée chez des souris déficientes en CD36 ou TSP-1 [5,
20]. |
Les mécanismes menant à la vaso-oblitération, une étape critique dans l’apparition de la RDP, sont complexes. L’hyperoxie postnatale joue à cet égard un rôle important, mais l’hypercapnie semble aussi participer à l’installation de la RDP. Des niveaux élevés et cliniquement pertinents de CO2 engendrent un stress azoté provenant de la stimulation d’eNOS et de la nitration, ce qui entraîne la mort de cellules endothéliales micro-vasculaires de la rétine et une atténuation de la néo-vascularisation rétinienne. Les ATA sont produits in vivo lors de stress azoté et causent des dommages aux micro-vaisseaux par le biais de l’activation de TSP-1 dans les cellules endothéliales micro-vasculaires de la rétine [5]. Nos résultats démontrent donc que les ATA peuvent reproduire les effets d’un stress azoté (comprenant une nitration) à l’origine de la dégénérescence des micro-vaisseaux observée dans les rétinopathies ischémiques, incluant les effets associés à l’hypercapnie et à l’hyperoxie [12, 17]. Bien que les effets des ATA aient été démontrés uniquement dans un modèle de RPO, tant l’hyperoxie que l’hypercapnie engendrent un stress azoté et, en conséquence, une augmentation des niveaux d’ATA. Il n’existe pas à l’heure actuelle de traitement efficace pour prévenir les dommages subis par les micro-vaisseaux qui surviennent lors de la genèse des rétinopathies ischémiques comme la RDP. En revanche, l’identification récente de l’augmentation de l’expression de TSP-1 par les ATA comme mécanisme important pouvant causer des dommages au réseau micro-vasculaire fournit de nouvelles cibles thérapeutiques pour le traitement de ces affections associées au stress azoté. Dans le même ordre d’idées, la détection éventuelle d’un récepteur des ATA pourrait mener à la mise au point d’antagonistes permettant de limiter leurs effets ; des interventions ciblant la formation de NO2
• ou d’ATA pourraient aussi être envisagées, par exemple, en modulant l’activité de la eNOS [5]. Ces traitements pourraient aussi s’appliquer aux nouveau-nés souffrant de maladies pulmonaires chroniques causant une hypercapnie, et qui présentent le risque d’être victimes d’une RDP. Idéalement, la prévention de la dysplasie bronchopulmonaire aurait un effet important sur l’atténuation de l’hypercapnie, et, en conséquence, éviterait l’apparition de la RDP. Comme la production de radicaux libres dérivés du NO• figure également dans la physiopathologie de plusieurs maladies [
21], les découvertes présentées ci-haut pourraient aussi permettre d’expliquer les dommages causés aux micro-vaisseaux et leurs conséquences néfastes observées dans les vasculopathies diabétiques, les encéphalopathies ischémiques et divers états inflammatoires. |
Les études présentées ont été financées par des subventions des Instituts de recherche en santé du Canada, la Fondation March of Dimes Birth Defects, la Fondation des maladies du cœur du Québec, le Fonds de la recherche en santé du Québec, le Réseau de recherche en santé de la vision et la Fondation du NO. Sylvain Chemtob est titulaire d’une Chaire de recherche du Canada en périnatalité.
|
1. Hardy P, Beauchamp M, Sennlaub F, et al. New insights into the retinal circulation : inflammatory lipid mediators in ischemic retinopathy. Prostaglandins Leukot Essent Fatty Acids 2005; 72 : 301–25. 2. Gilbert C, Rahi J, Eckstein M, et al. Retinopathy of prematurity in middle-income countries. Lancet 1997; 350 : 12–4. 3. Squadrito GL, Pryor WA. Oxidative chemistry of nitric oxide : the roles of superoxide, peroxynitrite, and carbon dioxide. Free Radic Biol Med 1998; 25 : 392–403. 4. Kroncke KD. Mechanisms and biological consequences of nitrosative stress. Biol Chem 2003; 384 : 1341. 5. Kermorvant-Duchemin E, Sennlaub F, Sirinyan M, et al. Trans-arachidonic acids generated during nitrative stress induce a thrombospondin-1-dependent microvascular degeneration. Nat Med 2005; 11 : 1339–45. 6. Balazy M, Poff CD. Biological nitration of arachidonic acid. Curr Vasc Pharmacol 2004; 2 : 81–93. 7. Holmes JM, Leske DA, Zhang S. The effect of raised inspired carbon dioxide on normal retinal vascular development in the neonatal rat. Curr Eye Res 1997; 16 : 78–81. 8. Harris A, Arend O, Wolf S, et al. CO2 dependence of retinal arterial and capillary blood velocity. Acta Ophthalmol Scand 1995; 73 : 421–4. 9. Radi R. Peroxynitrite reactions and diffusion in biology. Chem Res Toxicol 1998; 11 : 720–1. 10. Johnson BA, Weil MH. Redefining ischemia due to circulatory failure as dual defects of oxygen deficits and of carbon dioxide excesses. Crit Care Med 1991; 19 : 1432–8. 11. D’Arcangelo D, Facchiano F, Barlucchi LM, et al. Acidosis inhibits endothelial cell apoptosis and function and induces basic fibroblast growth factor and vascular endothelial growth factor expression. Circ Res 2000; 86 : 312–8. 12. Checchin D, Sennlaub F, Sirinyan M, et al. Hypercapnia prevents neovascularization via nitrative stress. Free Radic Biol Med 2006; 40 : 543–53. 13. Zhang ZG, Chopp M, Zaloga C, et al. Cerebral endothelial nitric oxide synthase expression after focal cerebral ischemia in rats. Stroke 1993; 24 : 2016–22. 14. Depre C, Fierain L, Hue L. Activation of nitric oxide synthase by ischaemia in the perfused heart. Cardiovasc Res 1997; 33 : 82–7. 15. Jiang H, Kruger N, Lahiri DR, et al. Nitrogen dioxide induces cis-trans-isomerization of arachidonic acid within cellular phospholipids. Detection of trans-arachidonic acids in vivo. J Biol Chem 1999; 274 : 16235–41. 16. Zghibeh CM, Raj Gopal V, Poff CD, et al. Determination of trans-arachidonic acid isomers in human blood plasma. Anal Biochem 2004; 332 : 137–44. 17. Beauchamp MH, Sennlaub F, Speranza G, et al. Redox-dependent effects of nitric oxide on microvascular integrity in oxygen-induced retinopathy. Free Radic Biol Med 2004; 37 : 1885–94. 18. Dawson DW, Pearce SF, Zhong R, et al. CD36 mediates the in vitro inhibitory effects of thrombospondin-1 on endothelial cells. J Cell Biol 1997; 138 : 707–17. 19. Nor JE, Mitra RS, Sutorik MM, et al. Thrombospondin-1 induces endothelial cell apoptosis and inhibits angiogenesis by activating the caspase death pathway. J Vasc Res 2000; 37 : 209–18. 20. Wang S, Wu Z, Sorenson CM, et al. Thrombospondin-1-deficient mice exhibit increased vascular density during retinal vascular development and are less sensitive to hyperoxia-mediated vessel obliteration. Dev Dyn 2003; 228 : 630–42. 21. Llorens S, Nava E. Cardiovascular diseases and the nitric oxide pathway. Curr Vasc Pharmacol 2003; 1 : 335–46. |