| |
| Med Sci (Paris). 2007 November; 23(11): 985–990. Published online 2007 November 15. doi: 10.1051/medsci/20072311985.Le foie : un organe du système immunitaire ? Pascal Lapierre* and Fernando Alvarez* Service et Unité de recherche en gastroentérologie, hépatologie et nutrition, CHU Sainte-Justine, 3175, Côte Sainte-Catherine, Montréal (Québec), H3T 1C5 Canada |
Le foie, un organe aux propriétés immunologiques paradoxales Le foie est un organe connu pour ses fonctions métaboliques de synthèse, de stockage et de détoxification. Cependant, au cours des récentes années, son rôle dans la régulation de la réponse immunitaire a fait l’objet d’une attention particulière. Situé entre le système veineux gastro-intestinal et systémique, le foie reçoit 75 % de son apport sanguin de l’intestin et de la rate via la veine porte. De ce fait, il est continuellement exposé aux antigènes alimentaires, à ceux provenant de la flore intestinale, ainsi qu’à d’éventuels microorganismes pathogènes. De plus, les lymphocytes provenant de la rate doivent traverser les sinusoïdes hépatiques pour atteindre la circulation systémique. Le foie doit donc être le siège de mécanismes immunitaires complexes qui ont pour finalité de permettre le maintien d’un état de tolérance immunitaire envers les antigènes intestinaux tout en étant capable de déployer une réponse efficace contre les agresseurs pathogènes. Le foie est aussi un organe important pour le maintien de l’homéostasie systémique des lymphocytes T, régulant leur apoptose et permettant l’élimination des cellules activées devenues inutiles à l’issue d’une réaction immune. |
Architecture et composition cellulaire du foie Le foie est principalement constitué d’hépatocytes : 60 % de sa population cellulaire. Il est également composé de cellules endothéliales, cellules de Kupffer (macrophages), cellules de l’épithélium biliaire (cholangiocytes), cellules étoilées (ou de Ito), cellules dendritiques et lymphocytes intrahépatiques. De la surface totale des hépatocytes, une proportion de 70 % est exposée au flux sanguin des sinusoïdes. Leur membrane forme des microvillosités qui traversent les pores fenestrés des cellules endothéliales de la paroi des sinusoïdes [
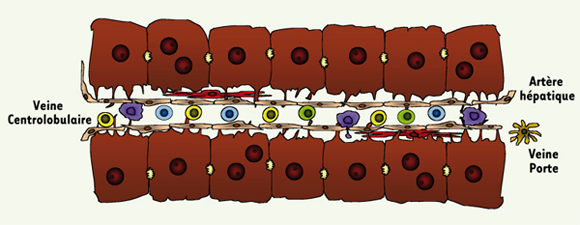
1]. Les pores fenestrés des cellules endothéliales permettent des échanges entre la circulation hépatique et l’espace de Disse et constituent des structures clés dans l’interaction des hépatocytes avec les cellules du système immunitaire (Figure 1).  | Figure 1.
Sinusoïdes hépatiques. Les sinusoïdes hépatiques sont des capillaires étroits délimités par des cellules endothéliales fenestrées reliant l’artère hépatique et la veine porte à la veine centrolobulaire. L’espace entre la membrane sinusoïdale des hépatocytes et les cellules endothéliales est appelé espace de Disse. Les hépatocytes, leurs prolongements cytoplasmiques, sont en contact avec l’espace de Disse, ainsi qu’avec la lumière des sinusoïdes par l’intermédiaire des pores fenestrés des cellules endothéliales. Le faible flux sanguin et le diamètre réduit des sinusoïdes permettent aux lymphocytes T (bleu), aux cellules NK (jaune) et aux cellules NKT (vert) d’interagir avec l’épithélium vasculaire, les hépatocytes et les cellules de Kupffer (violet). Ces cellules de Kupffer sont aussi en contact avec les antigènes, les toxines et les microorganismes provenant de l’intestin, permettant ainsi leur élimination. Les cellules de Ito (rouge), responsables du stockage de la vitamine A et de la synthèse de collagène, sont présentes dans l’espace de Disse. |
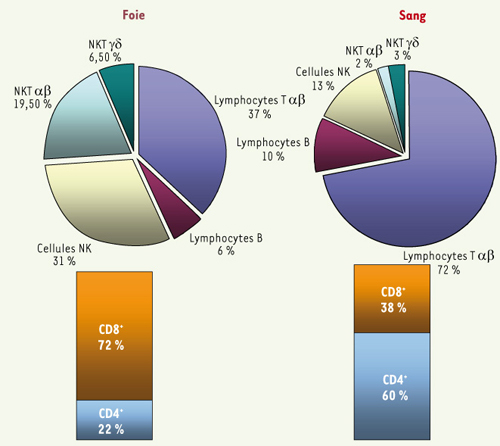
La composition lymphocytaire du foie est très particulière (Figure 2). Les cellules NKT, présentes en grand nombre, ont la faculté de sécréter des cytokines de type Th1 et Th2 et ainsi d’orienter la réponse immune subséquente [
2]. Récemment, deux sous-populations, les NKT CD4−CD8− et les NKT CD4+, ont respectivement été identifiées comme les cellules de la sécrétion de cytokines Th1 et Th2 [
3]. Le foie compte aussi une population de cellules présentatrices d’antigènes (CPA) résidentes. Il s’agit des cellules de Kupffer, macrophages dérivés de monocytes originaires de la moelle osseuse et qui résident dans l’espace sinusoïdal vasculaire (Figure 1). Lors d’une infection, elles orchestrent les premières phases de la réponse immune par l’intermédiaire de la sécrétion d’IL-12 et d’IL-18 qui déclenchent l’expansion et la différenciation des NK, cellules cytotoxiques sécrétant l’IFN-γ. Dans l’espace porte, loge une population de cellules dendritiques hépatiques. Peu nombreuses et généralement immatures, ces cellules d’origine myéloïde sont aptes à phagocyter et à apprêter divers antigènes [
4]. La sécrétion constitutive d’IL-10 et de TGF-ß par les cellules de Kupffer et les cellules endothéliales sinusoïdales créent un microenvironnement rendant les cellules dendritiques tolérogéniques [4]. L’architecture et la composition cellulaire particulière du foie, ainsi que les chimiokines et les cytokines qui y sont sécrétées, contribuent à faire du foie un milieu tolérogénique unique.  | Figure 2.
Population lymphoïde présente dans le foie et dans le sang. Le foie humain comporte environ 1010 lymphocytes des systèmes immunitaires inné et acquis. Cette population lymphocytaire est très différente de celle retrouvée dans le sang périphérique. Parmi les lymphocytes CD3+ hépatiques, le ratio CD4+/CD8+ est l’inverse de celui du sang périphérique. La majorité des cellules NKT αβ exprime un répertoire restreint de chaînes α et β qui reconnaissent des antigènes non-peptidiques présentés par la molécule CD1d. Ces cellules sont appelées iNKT (invariable natural killer T cell). Les cellules NK, les lymphocytes T γδ et les cellules iNKT αβ représentent près de 60 % des lymphocytes hépatiques, comparativement à 18 % à la périphérie. Cela suggère que le foie serait un lieu de rencontre initial d’antigènes où le système immunitaire inné, ou adaptatif de faible diversité, aurait un rôle important. |
|
Chez certains mammifères, la greffe de foie peut être tolérée sans immunosuppression [
5,
6]. Chez l’homme, l’immunosuppression est requise pour éviter le rejet, quoiqu’une discordance entre les antigènes leucocytaires humains (HLA) du donneur et du receveur n’affecte pas significativement l’évolution de la greffe [
7]. Autre observation surprenante : la greffe simultanée d’un foie et d’un rein provenant d’un même donneur améliore les chances de maintien du rein greffé comparé à la greffe d’un rein seul [
8]. La probabilité de survie d’un foie greffé au même moment qu’un autre organe, quant à elle, reste équivalente à celle d’un foie greffé seul. Le foie influencerait donc le système immunitaire du receveur et atténuerait la réponse immune dirigée contre d’autres greffons. L’irradiation d’un foie avant sa greffe chez le rat à une dose qui détruit tous les lymphocytes résidents mais qui épargne les hépatocytes, entraîne son rejet ; en revanche un foie non irradié survit indéfiniment sans immunosuppression chez ces animaux [
9]. Ce constat suggère que la tolérance observée serait médiée par les lymphocytes hépatiques. Ces allogreffes stables sont souvent accompagnées de microchimérisme [
10]. Le microchimérisme survient lors de la dissémination et de la survie dans l’organisme du receveur de cellules (lymphocytes) du donneur. Une étude récente montre que lors d’un microchimérisme stable, les clones T cytotoxiques de l’hôte, qui causent le rejet, sont éliminés de l’organisme [
11]. Un microchimérisme permanent est essentiel à l’acceptation du greffon. En effet, il serait à la source du maintien à long terme d’une tolérance envers le greffon car sa disparition entraîne la réapparition des lymphocytes T qui conduisent au rejet [11]. La sécrétion de chimiokines et de cytokines par les cellules hépatiques a souvent été envisagée comme un des mécanismes favorisant la tolérance hépatique [
12,
13]. Les cellules dendritiques hépatiques et les cellules NK et NKT ont la capacité de secréter l’IL-10, cytokine immunosuppressive [
14,
15]. Cependant, les cellules NK et NKT sécrètent aussi plusieurs cytokines pro-inflammatoires (comme l’IFN-γ). Ce paradoxe est évident chez la souris non-obese diabetic (NOD) et la souris déficiente en CD1d. Le transfert de cellules NKT à des souris NOD, dotées d’un nombre réduit de ce type de cellules, prévient l’apparition d’une encéphalomyélite autoimmune [
16]. La souris déficiente en CD1d, donc incapable d’activer les cellules NKT, manifeste une plus grande susceptibilité aux infections à Mycobacterium tuberculosis et à Borrelia burgdorferi [
17,
18]. Les cellules NKT jouent donc un rôle important tant dans l’installation de la tolérance immunitaire et la prévention de manifestations autoimmunes que dans la réponse aux infections. L’administration orale d’antigènes entraîne une tolérance immunitaire systémique pour ceux-ci. Ce processus, appelé tolérance orale, dépend du lien, via la veine porte, entre l’intestin et le foie. Une déviation chirurgicale du flux sanguin de la veine porte vers la veine cave inférieure empêche le déclenchement de la tolérance orale [
19]. Ce mécanisme est essentiel, car les antigènes alimentaires et ceux provenant de la flore intestinale sont des protéines du non soi et comportent donc le potentiel d’activer le système immunitaire. Les cellules NK1.1+ (NK et NKT) hépatiques seraient nécessaires pour l’induction d’une tolérance orale ; l’injection d’anticorps anti-NK1.1 prévient l’induction de la tolérance orale et l’injection de cellules NK1.1+ hépatiques d’animaux tolérisés transfère cette tolérance immunitaire [
20]. Récemment, dans un modèle expérimental de tolérance orale au nickel, Nowak et al. ont révélé l’existence d’un mécanisme par lequel les cellules iNKT (invariable natural killer T cell) participent au processus d’apparition d’une tolérance orale [
21]. Les cellules B exposées au nickel seraient plus sensibles à l’apoptose et les cellules iNKT, exprimant FasL, provoqueraient l’apoptose de ces cellules qui pourraient ensuite être phagocytées par les cellules dendritiques. Les cellules dendritiques devenues tolérogéniques au nickel donneraient naissance à une population de cellules T régulatrices spécifiques. Cette démonstration a permis de concilier plusieurs observations faites précédemment. En effet, on ne pouvait susciter une tolérance au nickel chez les souris Jα18−/-
chez lesquelles il y a absence de cellules iNKT et le transfert de cellules B provenant de souris ayant reçu du nickel permettait de transférer la tolérance à des souris de type sauvage et non aux souris Jα18−/-
. |
Le foie, cimetière ou champ d’exécution ? L’activation de cellules T par un super-antigène, un peptide soluble spécifique au récepteur T, ou par un anticorps anti-CD3 entraîne leur disparition des organes lymphoïdes. Pour étudier ce phénomène, Huang et al. ont injecté un peptide de l’antigène grand T de SV40 à des souris transgéniques exprimant un récepteur T spécifique à cet antigène lorsqu’il est présenté par le CMH de classe I. Après cette injection, ils ont observé des cellules CD8+ en apoptose dans le foie [
22]. Ainsi est apparue l’hypothèse selon laquelle le foie serait un « cimetière » où les cellules CD8+ activées, chez lesquelles l’apoptose aurait déjà commencé, seraient captées pour y être éliminées. Cette hypothèse fut ensuite infirmée devant l’observation, chez des souris déficientes en Fas, d’une capture normale de cellules CD8+ activées dans le foie. L’apoptose n’est donc pas une condition préalable pour qu’il y ait capture des lymphocytes T activés. L’hypothèse actuelle veut que le foie soit plutôt un « champ d’exécution » où des mécanismes hépatiques spécifiques provoqueraient l’apoptose de lymphocytes T CD8+ activés. Cette capture des lymphocytes CD8+ serait dépendante du TLR-4 (Toll-Like receptor 4), un membre de la famille des récepteurs de type Toll [
23]. Les lipopolysaccharides bactériens (LPS) provenant de la flore intestinale, les ligands naturels du TLR-4, l’activeraient et provoqueraient l’expression des molécules d’adhérence ICAM-1 et VCAM-1 dans les sinusoïdes hépatiques. Ces molécules d’adhérence, généralement exprimées aux sites d’inflammation, recruteraient les cellules CD8+ activées. La liaison de FasL, à la surface des CD8+ activées, à Fas exprimée sur les cellules de Kupffer déclencherait la sécrétion du TNF-α par les cellules de Kupffer, entraînant l’apoptose des cellules T CD8+ [
24]. Ce mécanisme essentiel pour l’élimination des cellules T activées à la suite d’une réponse immune, serait aussi en jeu dans le processus de la tolérance immunitaire. En effet, les souris vivant en milieu stérile, où l’absence de LPS hépatique diminue l’expression d’ICAM-1, et les souris déficientes en TLR-4 manifestent une tolérance orale réduite. |
Activation intrahépatique de lymphocytes T CD8+ Le foie, en l’absence d’inflammation, dispose de la faculté de recruter et d’activer, de façon antigène spécifique, des lymphocytes T CD8+ naïfs : il s’agit d’une caractéristique unique parmi les organes non lymphoïdes [
25]. À la suite d’un transfert de lymphocytes T CD8+ naïfs (spécifiques pour H-2Kb) à des souris dont les hépatocytes expriment H-2Kb, on observe une rapide séquestration et une activation par le foie des cellules injectées. Cette activation entraînerait une capacité effectrice réduite et une durée de vie diminuée, attribuable à un manque de signaux de survie. Cette élimination de clones CD8+ naïfs spécifiques des antigènes présentés par les cellules hépatiques, a été suggérée comme étant un mécanisme important dans le processus de la tolérance hépatique : tolérance orale aussi bien que tolérance d’allogreffe [
26]. Cette capacité qu’a le foie d’activer les cellules CD8+ naïves supposerait l’existence d’un contact direct entre les lymphocytes et les hépatocytes. Or, une telle interaction entre un lymphocyte naïf et une cellule du parenchyme va à l’encontre des principes établis en immunologie, qui décrètent que les cellules endothéliales forment une barrière efficace prévenant l’accès des cellules naïves aux tissus environnants [
27]. Récemment, il a été montré que les lymphocytes T CD8+ naïfs circulants peuvent, par des prolongements cytoplasmiques, traverser les pores des cellules endothéliales et faire contact avec les microvillosités des hépatocytes dans l’espace de Disse [1]. Malgré un état de base plutôt tolérogénique, l’activation intrahépatique de lymphocytes CD8+ dirigés contre des antigènes étrangers peut être efficace [
28]. L’absence d’activation des lymphocytes T CD8+ par le foie ne peut donc pas, à elle seule, expliquer la capacité de certains micro-organismes pathogènes, tels le virus de l’hépatite C, d’échapper au système immunitaire. La nécessité du soutien des lymphocytes T CD4+ dans l’activation primaire de lymphocytes T CD8+ naïfs est variable : elle dépend de l’antigène ; elle peut être requise pour la différenciation en cellules T CD8+ mémoires voire pour leur survie. Les lymphocytes T CD8+ sont préférentiellement retenus dans le foie, contrairement aux lymphocytes T CD4+. En effet, le faible nombre de cellules CD4+ décelées dans le foie (Figure 2) laisse croire que cet organe n’aurait pas la capacité de recruter ni d’activer les lymphocytes T CD4+ malgré la présence d’antigènes solubles et de molécules du CMH de classe II sur les cellules endothéliales des sinusoïdes [
29]. Cette constatation a mené à la formulation d’une hypothèse pour tenter de concilier les différentes observations concernant l’activation intrahépatique des lymphocytes T CD8+ en l’absence d’aide des CD4+ [13]. En situation physiologique, les cellules endothéliales activeraient les lymphocytes T CD8+ naïfs, mais l’absence d’aide des CD4+ entraînerait leur mort à cause du manque de signaux de survie, tels que l’IL-2 (Figure 3C) [
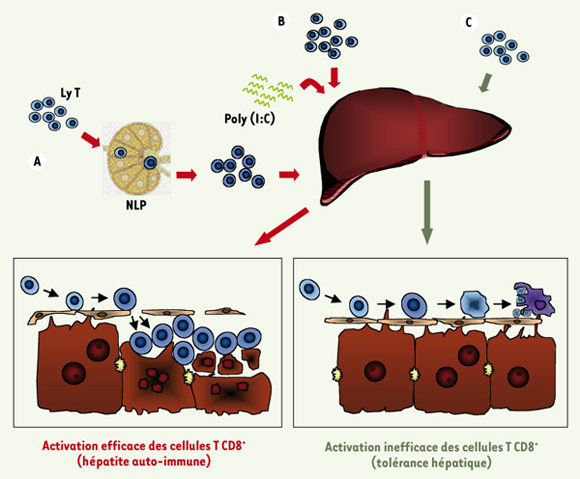
30]. Lors d’une infection, l’exposition des cellules endothéliales des sinusoïdes à des agents viraux ou bactériens entraînerait une activation primaire efficace des lymphocytesT CD8+, indépendante de l’aide des lymphocytes T CD4+, permettant ainsi la survie de ces cellules activées (Figure 3B).  | Figure 3.
Mécanismes physiologiques et pathologiques de l’immunité hépatique. A. Lorsque des lymphocytes T (Ly T) autoréactifs CD8+ naïfs (en bleu), spécifiques des antigènes hépatiques, sont activés dans les nodules lymphatiques périphériques (NLP) (en beige), cette activation est efficace et provoque une hépatite auto-immune. B. Après une exposition à des motifs viraux entraînant une activation du système immunitaire inné, comme, par exemple, la liaison du poly (I:C) (en vert) avec les TLR3 des cellules endothéliales, les cellules endothéliales des sinusoïdes sont aptes à activer les lymphocytes T CD8+ naïfs spécifiques des antigènes hépatiques. Cette activation, indépendante de l’aide des lymphocytes T CD4+, permet la survie des lymphocytes T CD8+ et l’élimination de cellules infectées ou le développement d’une hépatite auto-immune. C. En situation physiologique, les lymphocytes T CD8+ naïfs spécifiques des antigènes hépatiques reconnaissent les antigènes présentés par les cellules endothéliales des sinusoïdes, via le CMH I, ou par les hépatocytes eux-mêmes. L’expression de molécules de co-stimulation par les cellules endothéliales (CD80 et CD86) permet ensuite l’activation des lymphocytes T CD8+ mais l’absence de signaux de survie (IL-2, par exemple) entraîne leur mort par apoptose. Ce mécanisme de délétion de lymphocytes T CD8+ serait central dans le développement de la tolérance hépatique. Les flèches rouge représentent les mécanismes (A et B) d’activation efficace, tandis que les flèches vertes représentent le mécanisme (C) d’activation inefficace. |
|
Réponse immune efficace et auto-immunité Le transfert de lymphocytes T naïfs, spécifiques d’un antigène exprimé exclusivement par les hépatocytes, n’entraîne pas une hépatite [
31]. Un signal supplémentaire est donc nécessaire pour susciter une réponse immune contre les cellules hépatiques. Récemment, Lang et al. ont montré le rôle majeur des récepteurs de type Toll dans le mécanisme de réponse immune contre le foie [
32]. Le TLR-3, qui reconnaît les motifs poly (I:C) des ARN viraux à double brins, serait essentiel au processus qui conduit à une réponse contre le foie. L’activation du système immunitaire, via la liaison du poly (I :C) au TLR-3, déclencherait la sécrétion d’IFN-α et de TNF-α [32]. Ces cytokines entraîneraient l’expression hépatique de la chimiokine CXCL9, intermédiaire obligé de l’infiltration du foie par les lymphocytes T CD8+ [32]. Ainsi, la position anatomique du foie et sa constante exposition aux produits de la flore intestinale aurait permis l’émergence d’un mécanisme où un motif viral (poly I:C) permettrait de « briser » la tolérance hépatique et entraînerait une réponse immune efficace tandis qu’un motif bactérien, tel le LPS, induirait une activation inefficace et une tolérance immunitaire. L’équipe de notre laboratoire et celles d’autres groupes de recherche, ont montré que l’activation en périphérie de lymphocytes T dirigés contre des antigènes hépatiques provoque une hépatite auto-immune [31,
33,
34] mais que l’activation intrahépatique de ces mêmes cellules ne déclenche pas un processus similaire (Figure 3) [31]. L’acquisition d’une autoimmunité pourrait donc résulter soit d’une activation périphérique de lymphocytes T spécifiques à des antigènes hépatiques soit de l’activation hépatique de lymphocytes T naïfs en présence de motifs viraux pro-inflammatoires. |
Le foie s’avère un organe exerçant un rôle central dans l’homéostasie du système immunitaire et, de plus, doté de propriétés tolérogéniques uniques. À terme, la mise au point d’immunothérapies précises ciblant les mécanismes de l’homéostase immunitaire hépatique permettront la reconstitution d’une tolérance immunitaire ou l’induction d’une réponse immune efficace pour les patients atteints de maladies autoimmunes hépatiques ou d’infections chroniques par les virus B et C de l’hépatite.

|
Les auteurs remercient le Dr Claude C. Roy, MD pour ses commentaires et ses précieux conseils lors de la rédaction du manuscrit. M. Pascal Lapierre bénéficie d’une bourse de formation du Fonds de la recherche en santé du Québec.
|
1. Warren A, Le Couteur DG, Fraser R, et al. T lymphocytes interact with hepatocytes through fenestrations in murine liver sinusoidal endothelial cells. Hepatology 2006; 44 : 1182–90. 2. Doherty DG, Norris S, Madrigal-Estebas L, et al. The human liver contains multiple populations of NK cells, T cells, and CD3+CD56+ natural T cells with distinct cytotoxic activities and Th1, Th2, and Th0 cytokine secretion patterns. J Immunol 1999; 163 : 2314–21. 3. Thedrez A, de Lalla C, Allain S, et al. CD4 engagement by CD1d potentiates activation of CD4+ invariant NKT cells. Blood 2007; 110 : 251–8 4. Lau AH, Thomson AW. Dendritic cells and immune regulation in the liver. Gut 2003; 52 : 307–14. 5. Calne RY, Sells RA, Pena JR, et al. Induction of immunological tolerance by porcine liver allografts. Nature 1969; 223 : 472–6. 6. Houssin D, Gigou M, Franco D, et al. Specific transplantation tolerance induced by spontaneously tolerated liver allograft in inbred strains of rats. Transplantation 1980; 29 : 418–9. 7. Opelz G, Wujciak T, Dohler B, et al. HLA compatibility and organ transplant survival. Collaborative Transplant Study. Rev Immunogenet 1999; 1 : 334–42. 8. Rasmussen A, Davies HF, Jamieson NV, et al. Combined transplantation of liver and kidney from the same donor protects the kidney from rejection and improves kidney graft survival. Transplantation 1995; 59 : 919–21. 9. Sun J, McCaughan GW, Gallagher ND, et al. Deletion of spontaneous rat liver allograft acceptance by donor irradiation. Transplantation 1995; 60 : 233–6. 10. Starzl TE, Demetris AJ, Trucco M, et al. Systemic chimerism in human female recipients of male livers. Lancet 1992; 340 : 876–7. 11. Bonilla WV, Geuking MB, Aichele P, et al. Microchimerism maintains deletion of the donor cell-specific CD8+ T cell repertoire. J Clin Invest 2006; 116 : 156–62. 12. Lapierre P, Beland K, Alvarez F. Pathogenesis of autoimmune hepatitis: from break of tolerance to immune-mediated hepatocyte apoptosis. Transl Res 2007; 149 : 107–13. 13. Crispe IN, Giannandrea M, Klein I, et al. Cellular and molecular mechanisms of liver tolerance. Immunol Rev 2006; 213 : 101–18. 14. Goddard S, Youster J, Morgan E, et al. Interleukin-10 secretion differentiates dendritic cells from human liver and skin. Am J Pathol 2004; 164 : 511–9. 15. Godfrey DI, Kronenberg M. Going both ways: immune regulation via CD1d-dependent NKT cells. J Clin Invest 2004; 114 : 1379–88. 16. Mars LT, Laloux V, Goude K, et al. Cutting edge: V alpha 14-J alpha 281 NKT cells naturally regulate experimental autoimmune encephalomyelitis in nonobese diabetic mice. J Immunol 2002; 168 : 6007–11. 17. Behar SM, Dascher CC, Grusby MJ, et al. Susceptibility of mice deficient in CD1D or TAP1 to infection with Mycobacterium tuberculosis. J Exp Med 1999; 189 : 1973–80. 18. Kumar H, Belperron A, Barthold SW, et al. Cutting edge: CD1d deficiency impairs murine host defense against the spirochete, Borrelia burgdorferi. J Immunol 2000; 165 : 4797–801. 19. Yang R, Liu Q, Grosfeld JL, et al. Intestinal venous drainage through the liver is a prerequisite for oral tolerance induction. J Pediatr Surg 1994; 29 : 1145–8. 20. Trop S, Samsonov D, Gotsman I, et al. Liver-associated lymphocytes expressing NK1.1 are essential for oral immune tolerance induction in a murine model. Hepatology 1999; 29 : 746–55. 21. Nowak M, Kopp F, Roelofs-Haarhuis K, et al. Oral nickel tolerance: Fas ligand-expressing invariant NK T cells promote tolerance induction by eliciting apoptotic death of antigen-carrying, effete B cells. J Immunol 2006; 176 : 4581–9. 22. Huang L, Soldevila G, Leeker M, et al. The liver eliminates T cells undergoing antigen-triggered apoptosis in vivo. Immunity 1994; 1 : 741–9. 23. John B, Crispe IN. TLR-4 regulates CD8+ T cell trapping in the liver. J Immunol 2005; 175 : 1643–50. 24. Murray DA, Crispe IN. TNF-alpha controls intrahepatic T cell apoptosis and peripheral T cell numbers. J Immunol 2004; 173 : 2402–9. 25. Bertolino P, Bowen DG, McCaughan GW, et al. Antigen-specific primary activation of CD8+ T cells within the liver. J Immunol 2001; 166 : 5430–8. 26. Bowen DG, McCaughan GW, Bertolino P. Intrahepatic immunity: a tale of two sites ? Trends Immunol 2005; 26 : 512–7. 27. Mackay CR, Marston WL, Dudler L. Naive and memory T cells show distinct pathways of lymphocyte recirculation. J Exp Med 1990; 171 : 801–17. 28. Wuensch SA, Pierce RH, Crispe IN. Local intrahepatic CD8+ T cell activation by a non-self-antigen results in full functional differentiation. J Immunol 2006; 177 : 1689–97. 29. Mehal WZ, Juedes AE, Crispe IN. Selective retention of activated CD8+ T cells by the normal liver. J Immunol 1999; 163 : 3202–10. 30. Bertolino P, Trescol-Biemont MC, Thomas J, et al. Death by neglect as a deletional mechanism of peripheral tolerance. Int Immunol 1999; 11 : 1225–38. 31. Bowen DG, Zen M, Holz L, et al. The site of primary T cell activation is a determinant of the balance between intrahepatic tolerance and immunity. J Clin Invest 2004; 114 : 701–12. 32. Lang KS, Georgiev P, Recher M, et al. Immunoprivileged status of the liver is controlled by Toll-like receptor 3 signaling. J Clin Invest 2006; 116 : 2456–63. 33. Djilali-Saiah I, Lapierre P, Vittozi S, et al. DNA vaccination breaks tolerance for a neo-self antigen in liver: a transgenic murine model of autoimmune hepatitis. J Immunol 2002; 169 : 4889–96. 34. Lapierre P, Djilali-Saiah I, Vitozzi S, et al. A murine model of type 2 autoimmune hepatitis: xenoimmunization with human antigens. Hepatology 2004; 39 : 1066–74. |