| |
| Med Sci (Paris). 2007 November; 23(11): 1021–1023. Published online 2007 November 15. doi: 10.1051/medsci/200723111021.La fonction de TP53 Facteur prédictif majeur de la réponse à une chimiothérapie dose-intense dans le cancer du sein Jacqueline Lehmann-Che,1* Elisabeth Turpin,1 Philippe Bertheau,2 Marc Espié,3 and Hugues de Thé1 1Service de Biochimie et CNRS/ Université Paris VII UMR7151 2Laboratoire de Pathologie et Inserm/Université Paris VII U728 3Centre des maladies du sein, Assistance Publique/Hôpitaux de Paris, Hôpital Saint Louis, 1, avenue Claude Vellefaux, 75475 Paris Cedex 10, France MeSH keywords: Antinéoplasiques, Tumeurs du sein, Femelle, Humains, Analyse de survie, Survivants, Résultat thérapeutique, Protéine p53 suppresseur de tumeur |
Il apparaît maintenant clairement que le cancer du sein est constitué de pathologies hétérogènes. Les études de transcriptome de Perou et Sorlie [
1,
2] ont permis de définir, au niveau transcriptionnel, 5 phénotypes tumoraux différents. Cette hétérogénéité suggère que les thérapeutiques puissent ne pas être uniformes, mais adaptées à chaque type de tumeur. Seulement 20 % des patientes traitées par chimiothérapie première présentent une réponse histologique complète, qui prédit fortement la survie à long terme. Il est donc nécessaire de définir des marqueurs prédictifs de réponse aux différentes chimiothérapies proposées, dans le contexte des différentes tumeurs, afin d’adapter au mieux le traitement à chaque tumeur. Le gène TP53 est un gène suppresseur de tumeur impliqué dans le développement de nombreux cancers humains et qui joue un rôle majeur dans la réponse au stress. La protéine TP53 est un facteur de transcription qui contrôle l’expression de nombreux gènes impliqués dans l’apoptose et la régulation du cycle cellulaire. Dans les modèles animaux ou les lignées cellulaires, TP53 joue un rôle clé dans la réponse aux agents génotoxiques, en particulier les anti-cancéreux [
3,
4]. L’inactivation de TP53 pourrait accroître ainsi une sensibilité à certains agents et une résistance à d’autres. En clinique humaine, ce rôle de TP53 reste encore controversé. Nous avons recherché une relation entre la réponse à la chimiothérapie et le statut TP53 dans une cohorte de 80 patientes atteintes de cancers du sein localement avancés non inflammatoires, traités par chimiothérapie néoadjuvante dose-intense (épirubicine 75 mg/m2 et cyclophosphamide 1 200 mg/m2 tous les 14 j) [
5,
6]. Le statut TP53 est déterminé sur la biopsie de diagnostic, avant chimiothérapie, par le test fonctionnel FASAY [
7]. Ce test consiste à faire exprimer l’ADNc de TP53, obtenu à partir des ARN extraits de la tumeur, dans une levure dépendante de TP53 pour une voie métabolique majeure. L’absence de fonctionnalité de TP53 se traduit par le blocage de cette voie métabolique et l’apparition de colonies rouges. Ce test permet de détecter 90 % des mutations décrites (mutations faux-sens, non-sens, délétion/insertion, erreurs d’épissage) avec une sensibilité telle que 15 % de cellules mutées sont détectables. La réponse histologique est évaluée, après chimiothérapie, sur la pièce d’exérèse chirurgicale et définie comme complète lorsqu’il n’existe plus de foyer tumoral infiltrant. |
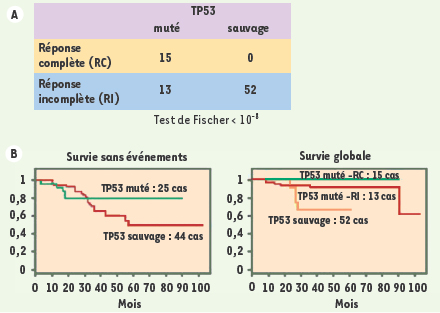
Le statut TP53 est fortement lié à la réponse à la chimiothérapie L’analyse de cette cohorte montre que les réponses histologiques complètes (RC) sont exclusivement observées dans le groupe des tumeurs mutées pour le gène TP53
(Figure 1A) (p < 10-8). Cependant, le statut TP53 muté est fortement associé à des tumeurs ne surexprimant pas le récepteur des œstrogènes (ESR1neg) et de haut grade. Le statut ESR1 pourrait donc être un facteur confondant, d’autant plus qu’il a été rapporté que les tumeurs surexprimant ESR1 (ESR1pos) sont beaucoup plus résistantes à la chimiothérapie. Nous avons donc analysé la distribution des 80 tumeurs en fonction de ces données (âge, stade et grade tumoral, statut TP53, expression d’ESR1, des cytokératines basales [KRT5/6 ou 17] d’ERBB2 [HER-2, c-erb B2] et CDKN2A). Le grade, ESR1, KRT5/6 ou 17 et CDKN2A sont fortement associés à la réponse, mais le statut TP53 reste significativement associé à la réponse, quelle que soit la stratification, alors que tous les autres facteurs perdent leur valeur significative, si l’on stratifie sur le statut TP53. Ainsi, la fonctionnalité TP53, et dans une moindre mesure les cytokératines, sont les seuls facteurs prédictifs de la réponse complète à cette chimiothérapie dose-intense.  | Figure 1.
A. Distribution de la réponse pathologique à la chimiothérapie dose-intense épirubicine (75 mg/m2) -cyclophosphamide (1 200 mg/m2) tous les 14 jours, selon le statut TP53 (80 patients). La valeur du p du test de comparaison χ2 est indiquée. B. Courbes de survie sans événement selon le statut TP53. Notez que les 5 rechutes dans le groupe TP53 muté ont lieu précocement, dans les 18 premiers mois. Courbe de survie globale selon le statut TP53 sauvage, TP53 muté répondeur (RC) ou TP53 muté non répondeur (RI). |
|
Le statut TP53 et la survie Les patientes présentant une tumeur mutée TP53 ont une meilleure survie sans événement que celles ayant une tumeur TP53 sauvage (Figure 1B). La différence observée n’est, cependant, pas statistiquement significative, compte tenu de la durée du suivi. Les patientes présentant une tumeur TP53 sauvage, malgré l’absence de réponse complète, ont également une bonne survie. Parmi les 15 tumeurs répondeuses, 9 sont de type basal, l’un des types définis par les analyses du transcriptome, caractérisé ici par la surexpression de KRT5/6 ou 17. Ces données sont inattendues et importantes puisque les tumeurs mutées TP53, et particulièrement le sous-type basal, sont classiquement considérées de très mauvais pronostic. Il semble donc que cette chimiothérapie dose-intense soit particulièrement adaptée aux tumeurs TP53 muté de type basal. |
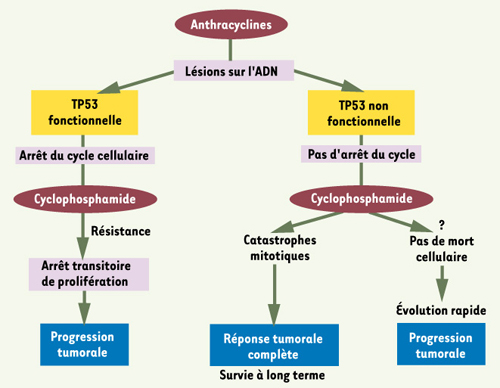
Existe-il une signature moléculaire de la réponse complète ? Afin de mieux caractériser les tumeurs répondeuses, nous avons analysé le transcriptome de 37 des 80 tumeurs. Après classification hiérarchique, nous avons retrouvé les grands groupes de tumeurs du sein initialement décrits. Nous avons également pu définir un certain nombre de gènes associés au statut TP53 muté, cette signature ne reflétant pas uniquement le statut ESR-1neg. En revanche, parmi les tumeurs mutées TP53, nous n’avons pas retrouvé de signature différenciant les tumeurs répondeuses des non-répondeuses. Ainsi, le statut tumoral TP53 muté constitue un facteur prédictif majeur de la réponse complète à cette chimiothérapie dose-intense épirubicine-cyclophosphamide dans les cancers du sein non inflammatoires. L’originalité de ce travail est d’avoir établi le statut TP53 à l’aide d’un test fonctionnel et d’avoir évalué une chimiothérapie très agressive en situation néoadjuvante, permettant l’analyse objective de la réponse. Il semble que cette chimiothérapie, véritable exception française, puisse être la plus adéquate pour un certain nombre de patientes jusque-là considérées de mauvais pronostic. Ces données accréditent l’hypothèse selon laquelle les lésions géniques induites par les anthracyclines n’activent pas la voie de l’apoptose via TP53 mais plutôt l’arrêt de cycle. Si TP53 est fonctionnelle, l’arrêt de cycle induit par l’épirubicine empêche l’action du cyclophosphamide, actif uniquement sur les cellules en cycle, créant un antagonisme fonctionnel entre ces deux agents. En revanche, lorsque TP53 n’est pas fonctionnelle, le cyclophosphamide peut agir et la conjonction des deux drogues induit des catastrophes mitotiques assurant une réponse tumorale complète (Figure 2). Cette implication du statut TP53 dans la chimiorésistance a également pu être démontrée, récemment, dans le cancer de l’ovaire [
8]. Ces résultats constituent une première illustration du rôle des facteurs moléculaires dans la réponse des tumeurs solides aux traitements. Reste maintenant à comprendre pourquoi 50 % des tumeurs mutées TP53 demeurent résistantes au traitement.  | Figure 2.
Modèle de mécanisme d’action proposé pour la chimiothérapie épirubicine-cyclophosphamide dose-intense dans les cancers du sein non inflammatoires selon le statut TP53 (détail dans le texte). |
|
1. Sorlie T, Perou CM, Tibshirani R, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci USA 2001; 98 : 10869–74. 2. Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours. Nature 2000; 406 : 747–52. 3. Bunz F, Hwang PM, Torrance C, et al. Disruption of p53 in human cancer cells alters the responses to therapeutic agents. J Clin Invest 1999; 104 : 263–9. 4. Lowe SW, Cepero E, Evan G. Intrinsic tumour suppression. Nature 2004; 432 : 307–15. 5. Bertheau P, Plassa F, Espie M, et al. Effect of mutated TP53 on response of advanced breast cancers to high-dose chemotherapy. Lancet 2002; 360 : 852–4. 6. Bertheau P, Turpin E, Rickman DS, et al. Exquisite sensitivity of TP53 mutant and basal breast cancers to a dose-dense epirubicin-cyclophosphamide regimen. PLoS
Med 2007; 4 : e90. 7. Flaman JM, Frebourg T, Moreau V, et al. A simple p53 functional assay for screening cell lines, blood, and tumors. Proc Natl Acad Sci USA 1995; 92 : 3963–7. 8. Moreno CS, Matyunina L, Dickerson EB, et al. Evidence that p53-mediated cell-cycle-arrest inhibits chemotherapeutic treatment of ovarian carcinomas. PLoS One 2007; 2 : e441. |