L’interprétation de l’information génétique en protéine est l’un des processus fondamentaux de toute cellule vivante. La complexité de ce phénomène se traduit par l’implication d’un grand nombre de protagonistes. Les aminoacyl-ARNt synthétases (aaRS) constituent une famille d’enzymes isofonctionnelles indispensables à ce processus (pour revue [ 1]). Leur fonction principale consiste à catalyser la réaction d’aminoacylation, c’est-à-dire l’estérification des acides aminés sur l’(les) ARNt correspondant(s), aminoacyl-ARNt qui seront alors utilisés par le ribosome pour assurer la synthèse protéique. La réaction d’aminoacylation se déroule en deux étapes successives : (1) l’activation de l’acide aminé lors de la formation d’un complexe stable aminoacyl adénylate : aaRS suivie de (2) son transfert sur le groupement 2’ ou 3’ hydroxyle du ribose de l’adénosine située à l’extrémité 3’ de l’ARNt. La précision de cette réaction conditionne la fidélité de la traduction de l’information génétique. En raison des similitudes qui existent entre certains acides aminés, certaines aaRS ont développé des mécanismes extrêmement précis de correction d’erreurs aboutissant à l’élimination des acides aminés mal activés (édition pré-transfert) et/ou des ARNt mal aminoacylés (édition post-transfert). La leucyl-ARNt synthétase (LeuRS), une des aaRS les plus étudiées par notre groupe, possède ainsi à cette fin un domaine d’édition distant de plus de 30 Å du domaine catalytique [ 2, 3]. Ce domaine comprend notamment une cavité (site d’édition) bordée de résidus hautement conservés, impliqués dans l’activité d’édition post-transfert [ 4, 5] (Figure 1).
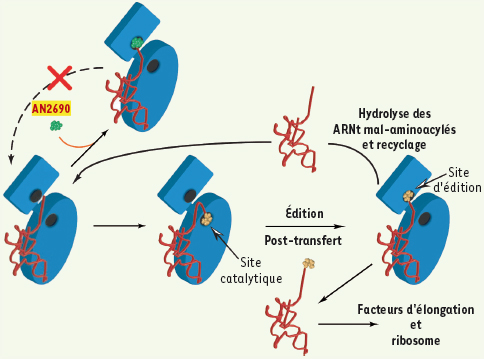
| Figure 1.
Mode d’action du AN2690. L’enzyme amino-acyl-ARNt synthétase est représentée en bleu, l’ARNt en rouge et l’acide aminé en jaune. L’ARNt synthétase est responsable de l’appariement correct d’un ARNt avec l’acide aminé correspondant (ici la leucine). Une première étape est la reconnaissance de l’acide aminé par le site catalytique, puis la vérification du produit d’adénylation dans le site d’édition. Le contrôle de qualité élimine les ARNt mal aminoacylés |
Anacor Pharmaceuticals, une compagnie pharmaceutique californienne, travaille au développement de molécules dérivées du bore, un élément naturellement présent dans l’environnement mais peu employé en dépit de son ubiquité, dans l’optique de traiter différentes maladies inflammatoires et/ou infectieuses. Le AN2690 (5-fluoro-1,3-dihydro-1-hydroxy-2,1-benzoxaborole) fait partie de ce contingent de nouveaux composés. Il a récemment prouvé son efficacité dans le traitement de l’onychomycose, une infection fongique affectant principalement les ongles des pieds (Figure 2A) [ 6, 7, 9]. Des essais cliniques sont actuellement en cours en vue de sa potentielle mise sur le marché.
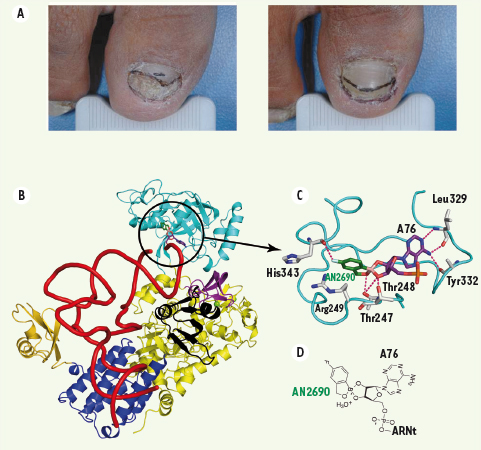
| Figure 2.
Le AN2690, effets thérapeutiques et mécanisme moléculaire. A. Effet du AN2690 sur le traitement de l’onychomycose. Le sujet présenté a bénéficié de l’application journalière d’une pommade contenant 7,5 % AN2690 pendant une période de six mois. Les photos montrent un ongle avant traitement (partie gauche) et 90 jours après le début du traitement (source [9]). B. Structure tridimensionnelle du complexe entre la LeuRS de T. thermophilus, l’ARNtLeu et le AN2690 (cerclé de noir). Le domaine d’édition post-transfert est représenté en cyan, le domaine catalytique en jaune avec le domaine de liaison du zinc en magenta et le domaine leucyl-spécifique en noir, le domaine de liaison à l’anticodon en bleu, le domaine C-terminal en jaune doré et l’ARNt en rouge.C. Détails de la stabilisation du produit résultant de la réaction entre le AN2690 et l’adénosine terminale (A76) de l’ARNtLeu dans le site d’édition de la LeuRS. Les résidus impliqués sont représentés en gris, l’adénosine terminale en violet et le AN2690 en vert. D. Formule topologique du produit. |
Pour identifier la cible de ce composé antifongique à large spectre d’action, des mutants de Saccharomyces cerevisiae résistant au AN2690 ont été isolés et caractérisés [ 8]. Leur séquençage a alors montré que la majorité des mutations, induites ou spontanées, affectaient spécifiquement le gène CDC60 codant pour la LeuRS cytoplasmique, et plus particulièrement les régions très conservées du site d’édition post-transfert de l’enzyme. La cible étant identifiée, les mesures d’activité enzymatique en présence du AN2690 ont permis d’amorcer la compréhension du mode d’action du composé. Ainsi le AN2690 supprime la capacité de la LeuRS à hydrolyser les ARNtLeu mal aminocylés (c’est-à-dire Ile-ARNtLeu) mais il inhibe également la réaction d’aminoacylation, bloquant de cette manière la synthèse protéique in vivo. Il apparaît cependant que l’effet inhibiteur du composé sur la réaction d’aminoacylation requiert uniquement la présence de l’ARNtLeu, le AN2690 se comportant comme un inhibiteur non compétitif vis-à-vis de la leucine et de l’ATP, les substrats de la première étape de la réaction.
L’obtention de la structure cristallographique du complexe entre la LeuRS, l’ARNtLeu et le AN2690 a permis d’élucider définitivement les bases moléculaires du mode d’action du composé (Figure 2B). La structure atomique du complexe a ainsi révélé que l’atome de bore présent dans le composé réagissait avec les deux groupements hydroxyles libres de l’adénosine terminale (A76) de l’ARNt, formant une structure spiroborate tétraédrique (Figure 2C et 2D). Cette structure particulière est de plus fortement stabilisée dans le site d’édition de la LeuRS, notamment par les résidus strictement conservés décrits comme étant largement impliqués dans la réaction d’édition post-transfert [4, 5]. La comparaison de cette structure avec celle de la LeuRS complexée au Nva2aa, un analogue structural du substrat de la réaction d’édition post-transfert [3], montre une parfaite superposition entre la partie correspondant au « mauvais » acide aminé du Nva2aa d’une part et la partie benzoxaborole plane du AN2690 d’autre part.
Dans le passé, les molécules ciblant les aaRS se contentaient principalement d’interagir, avec une affinité plus ou moins forte, au niveau de leur domaine catalytique empêchant ainsi la réaction d’aminoacylation. Le AN2690 ouvre de nouvelles perspectives quant à la conception de molécules inhibitrices ciblant ces enzymes. Interagissant avec le site d’édition post-transfert, ce composé présente la particularité d’inhiber la LeuRS en réagissant spécifiquement avec l’ARNtLeu, l’un de ses substrats, formant alors un complexe indissociable, dont la demi-vie a été estimée à plus de 7 heures dans le cas de l’enzyme de levure (Figure 1). L’atome de bore, constituant majeur du cycle oxaborole, requiert alors la présence des deux groupements hydroxyles libres uniquement présents sur l’adénosine terminale. Cela implique que seul l’ARNtLeu non aminoacylé peut être piégé par le AN2690, démontrant ainsi la grande spécificité de ce composé. Ainsi, grâce l’utilisation de molécules appropriées, ce mécanisme visant à piéger spécifiquement les ARNt pourrait être employé pour inhiber d’autres aaRS possédant une activité d’édition post-transfert. Ces résultats démontrent de plus le potentiel que constitue l’incorporation du bore, un élément naturel majeur peu utilisé jusqu’à maintenant, dans des inhibiteurs d’enzyme rationnellement conçus.