| |
| Med Sci (Paris). 2007 December; 23(12): 1089–1091. Published online 2007 December 15. doi: 10.1051/medsci/200723121089.p27Kip1, suppresseur de tumeur… et oncogène ? Arnaud Besson* LBCMCP - CNRS UMR 5088, Université Paul Sabatier, 118, Route de Narbonne, Batiment 4R3b1, 31062 Toulouse Cedex 09, France MeSH keywords: Animaux, Mouvement cellulaire, Inhibiteur p27 des kinases cycline-dépendantes, Cytoplasme, Modèles animaux de maladie humaine, Gènes suppresseurs de tumeur, Humains, Souris, Modèles biologiques, Tumeurs, Oncogènes |
Le rôle classique de p27 dans le noyau : inhibiteur des complexes cycline/CDK p27Kip1 (p27) est un inhibiteur du cycle cellulaire et peut entraîner un arrêt de la prolifération en phase G1 du cycle cellulaire en réponse à des signaux anti-mitotiques [
1,
11]. p27 exerce son activité anti-proliférative en inhibant les complexes cyclines/CDK (cyclin-dependent kinase) dont l’activité kinase est requise pour la progression dans le cycle cellulaire. La partie amino-terminale de p27 contient des domaines d’interaction spécifiques pour les cyclines et CDK, et la liaison de p27 d’une part occulte un domaine d’interaction entre la cycline et son substrat, et d’autre part empêche la liaison de l’ATP au site catalytique de la CDK [1]. L’importance de p27 dans le contrôle du cycle cellulaire est soulignée par les phénotypes des souris p27−/−, dont la taille est augmentée d’environ 30 %, divers organes sont hyperplasiques, et les épithéliums sensoriels de la rétine et de l’oreille interne sont désorganisés [
2]. Tous ces phénotypes sont attribués à une augmentation globale de la prolifération en l’absence de p27. p27 est également un suppresseur de tumeur, puisque dans les souris p27−/−, l’absence de la protéine entraîne des tumeurs spontanées de l’hypophyse et augmente la sensibilité des animaux à la tumorigenèse induite par des carcinogènes ou par une irradiation [2,
3]. De plus, chez la souris, la perte de p27 augmente la prédisposition à la tumorigenèse causée par la perte d’autres suppresseurs de tumeurs (comme PTEN, APC, ou p18INK4c). La perte de l’expression nucléaire de p27 est communément observée dans de nombreux types de cancers chez l’homme (dont sein, côlon, prostate, ovaire, poumon, cerveau, estomac…) et la diminution du niveau de p27 est un facteur pronostic négatif, souvent associée à des tumeurs agressives [
4]. |
Un rôle nouveau, oncogénique, de la forme cytoplasmique de p27 Cependant, un certain nombre de données expérimentales indiquent que le rôle de p27 au cours de la tumorigenèse n’est pas aussi simple qu’initialement anticipé et pourrait s’étendre au-delà de l’inhibition des complexes cycline/CDK et du contrôle de la prolifération. Tout d’abord, p27 est un suppresseur de tumeurs atypique puisque les mutations du gène de p27 dans les tumeurs sont extrèmement rares, alors qu’elles sont fréquentes dans les suppresseurs de tumeurs classiques comme p53 ou Rb [3, 4]. En fait, p27 est préferentiellement inactivé par une augmentation de sa dégradation protéolytique ou par son exclusion du noyau [
5]. De plus, le niveau de p27 dans les tumeurs n’est pas toujours corrélé avec l’index prolifératif et p27 est un marqueur pronostique indépendant de marqueurs de prolifération comme Ki 67 ou la cycline E [4]. De plus en plus de données indiquent que la localisation cellulaire de p27 est cruciale pour le contrôle de sa fonction, et sa localisation cytoplasmique est généralement un facteur pronostic négatif [4, 5]. Ceci est conforté par les résultats d’études in vivo : les souris hétérozygotes p27+/-
sont plus sensibles à la tumorigenèse que les animaux p27−/−
dans des modèles de tumeurs de la prostate et des glandes mammaires, suggérant une contribution active de l’allèle restant de p27 à la tumorigenèse [4]. En revanche, comme nous l’avons montré, des souris knock-in portant un allèle p27S10A, qui est presque exclusivement nucléaire, sont résistantes à la tumorigenèse induite par l’uréthane, malgré une réduction globale de la quantité de p27 dans ces animaux [
6]. L’ensemble de ces données suggère donc que p27 pourrait avoir un autre rôle, indépendamment de son inhibition des complexes cycline/CDK, qui s’exercerait dans le cytoplasme, et pourrait contribuer à la tumorigenèse. |
Contrôle de l’activité de RhoA par p27 Plusieurs études ont commencé à caractériser ces fonctions de p27 indépendantes des cycline/CDK. Notamment, nous avons découvert que p27 pouvait réguler le cytosquelette d’actine et la migration cellulaire en modulant l’activité de la GTPase RhoA, une activité localisée dans la moitié carboxy-terminale de p27 [
7]. p27 peut se lier à RhoA et de ce fait empêche RhoA d’interagir avec, et d’être activée par, ses GEF (guanine-nucleotide exchange factor) qui activent les GTPases en facilitant l’échange du GDP pour le GTP [7]. Cette fonction de p27 est cruciale pour le contrôle de la migration des neurones corticaux au cours du développement embryonnaire chez la souris [
8]. De plus, via sa partie amino-terminale, p27 module la différenciation des progéniteurs neuronaux in vivo, indépendamment de la régulation des cyclines/CDK, en stabilisant la Neurogénine-2 [8]. Afin de déterminer l’importance de la contribution des fonctions indépendantes des cyclines/CDK de p27 in vivo, notamment au cours de la tumorigenèse, nous avons construit un modèle de souris knock-in dans lequel le gène de p27 a été remplacé par un allèle (p27CK-
) codant pour une protéine qui ne peut plus interagir avec les complexes cyclines/CDK [6,
9]. Un certain nombre de phénotypes des souris p27CK-/CK-
sont identiques à ceux des souris p27−/−, comme l’augmentation de la taille et la stérilité des femelles [2, 6], confirmant ainsi que p27CK- n’est plus capable de réguler les complexes cyclines/CDK. Cependant, d’autres phénotypes diffèrent et indiquent l’existence de fonctions indépendantes des cyclines/CDK pour p27 in vivo. En particulier, l’allèle p27CK- provoque, et ce de manière dominante (même chez les animaux p27+/CK-
), l’apparition de lésions hyperplasiques et de tumeurs dans divers organes, dont l’hypophyse (avec une période de latence inférieure à celle qui est observée dans les souris p27−/−
), le poumon, la rétine, l’ovaire, les surrénales, la rate, ainsi que des lymphomes [9]. p27CK- paraît donc fonctionner comme un oncogène in vivo. Des analyses plus approfondies dans la rétine et le poumon ont révélé que la dérégulation de cellules progénitrices ou de cellules souches était responsable de la formation de lésions cancéreuses dans ces tissus. Dans le poumon, l’amplification d’une population de cellules souches bronchio-alvéolaires, récemment décrites [
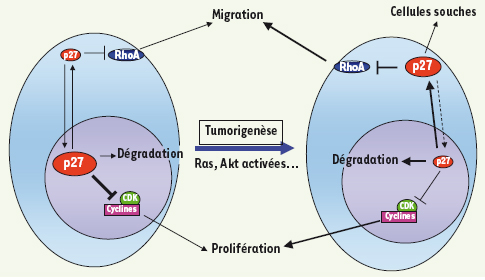
10], semble responsable de la formation de lésions hyperplasiques et dysplasiques, qui progressent vers la formation d’adénomes puis d’adénocarcinomes [9]. Le mécanisme exact par lequel p27CK- cause l’amplification de cette population de cellules souches reste inconnu pour le moment, cependant, des données préliminaires suggèrent une contribution de la dérégulation de la voie de signalisation de RhoA par p27CK-. Ces nouvelles données fournissent donc une explication potentielle pour l’absence de mutations dans le gène p27 associées aux tumeurs. En effet, le mécanisme oncogénique lui-même pourrait éliminer la fonction suppresseur de tumeur (nucléaire) de p27, tout en maintenant les fonctions oncogéniques (cytoplasmiques) de la protéine (Figure 1). La poursuite de l’étude de ce modèle de souris knock-in permettra d’en découvrir plus sur les rôles oncogéniques de p27, et également de déterminer les mécanismes qui régissent le devenir des cellules souches bronchio-alvéolaires et la tumorigenèse dans le poumon.  | Figure 1.
Modèle proposé pour les différentes actions de p27. Dans l’état actuel de nos connaissances, le modèle suivant peut être envisagé : dans les cellules normales, la dégradation et la localisation de p27 sont soigneusement controlées. p27 est principalement nucléaire et restreint la prolifération en inhibant les complexes cyclines-CDK. Une fraction de p27 dans le cytoplasme participe à la régulation de la migration (notamment des progéniteurs neuronaux) en modulant l’activité de RhoA. Dans les cellules tumorales, l’activation de voies de signalisation oncogéniques (comme Ras, PI3-K (phosphatidyl inositol 3-kinase) et Akt/PKB) conduit à la perte de la fonction nucléaire de régulation du cycle cellulaire de p27, soit par augmentation de sa dégradation, soit par exclusion du noyau. L’augmentation de la fraction cytoplasmique de p27 pourrait contribuer activement à la tumorigenèse via la dérégulation des voies de signalisation de RhoA, et également à la dérégulation des cellules souches dans certains tissus. |
|
1. Sherr CJ, Roberts JM. CDK inhibitors : positive and negative regulators of G1-phase progression. Genes Dev 1999; 13 : 1501–12. 2. Fero ML, Rivkin M, Tasch M, et al. A syndrome of multiorgan hyperplasia with features of gigantism, tumorigenesis, and female sterility in p27(Kip1)-deficient mice. Cell 1996; 85 : 733–44. 3. Fero ML, Randel E, Gurley KE, et al. The murine gene p27Kip1 is haplo-insufficient for tumour suppression. Nature 1998; 396 : 177–180. 4. Besson A, Assoian RK, Roberts JM. Regulation of the cytoskeleton : an oncogenic function for CDK inhibitors ? Nat Rev Cancer 2004; 4, 948–55. 5. Slingerland J, Pagano M. Regulation of the CDK inhibitor p27 and its deregulation in cancer. J Cell Physiol 2000; 183 : 10–17. 6. Besson A, Gurian-West M, Chen X, et al. A Pathway in Quiescent Cells that Controls p27Kip1 Stability, Subcellular Localization and Tumor Suppression. Genes Dev 2006; 20 : 47–64. 7. Besson A, Gurian-West M, Schmidt A, et al. p27Kip1 modulates cell migration through the regulation of RhoA activation. Genes Dev 2004; 18 : 862–76. 8. Nguyen L, Besson A, Heng J, et al. p27Kip1 independently promotes neuronal differentiation and migration in the cerebral cortex. Genes Dev 2006; 20 : 1511–24. 9. Besson A, Hwang HC, Donovan SL, et al. Discovery of an Oncogenic Activity in p27Kip1 that causes Stem Cell Expansion and a Multiple Tumor Phenotype. Genes Dev 2007; 21 : 1731–46. 10. Kim CF, Jackson EL, Woolfenden AE, et al. Identification of bronchioalveolar stem cells in normal lung and lung cancer. Cell 2005; 121 : 823–35. 11. Roisin-Bouffay, Gomer RH. Comment atteindre la bonne taille. Med Sci (Paris) 2004; 20 : 219–24. |