| |
| Med Sci (Paris). 2007 December; 23(12): 1125–1132. Published online 2007 December 15. doi: 10.1051/medsci/200723121125.Vers la caractérisation des cellules souches de la glande mammaire murine adulte Marie-Ange Deugnier,* Valérie Petit, Ilaria Taddéi-De La Hosseraye, Marisa Faraldo, and Marina A. Glukhova Équipe Mécanismes moléculaires du développement de la glande mammaire, Institut Curie, CNRS UMR144, 26, rue d’Ulm, 75248 Paris Cedex 05, France |
La glande mammaire adulte est formée d’un réseau de canaux ramifiés et d’alvéoles sécrétrices inséré dans un stroma fibro-adipeux. L’épithélium mammaire dérive de l’ectoderme et la glande mammaire fait partie des glandes annexes de la peau. La mammogenèse commence durant la vie embryonnaire mais le développement de la glande est essentiellement post-natal. Ses propriétés de développement et de régénération ont conduit à suggérer que l’épithélium mammaire adulte comprenait un réservoir de cellules souches [
1,
2]. Cette hypothèse est depuis quelques années soutenue par de nouvelles données expérimentales. Nous présentons ici une synthèse des approches utilisées pour tenter d’isoler et caractériser des cellules souches et progénitrices issues de la glande mammaire murine et des résultats essentiels obtenus à ce jour. |
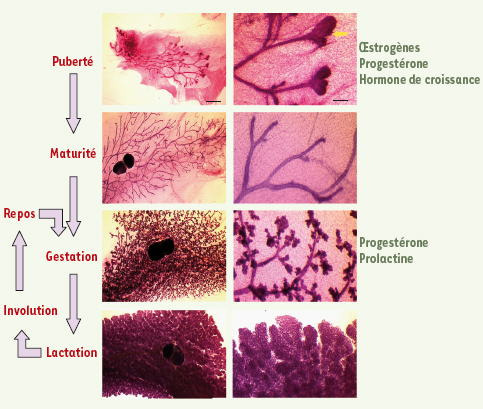
Développement post-natal de la glande mammaire Le développement post-natal de la glande mammaire comprend deux étapes majeures de morphogenèse, canalaire durant la puberté, et lobulo-alvéolaire au cours de la gestation et de la lactation. Chaque lactation est suivie d’une période de remodelage tissulaire, l’involution (Figure 1). De la naissance à la puberté, la glande est rudimentaire et comprend, chez la souris femelle, un canal primaire et quelques ramifications secondaires. À la puberté, de larges structures bulbaires, les bourgeons terminaux, se forment à l’apex des canaux. Les bourgeons progressent rapidement dans le stroma en se ramifiant, puis régressent à la fin de la puberté, laissant chez la souris vierge adulte un système de canaux ramifiés qui a entièrement envahi le stroma. Le développement lobulo-alvéolaire commence lors de la gestation avec la formation de bourgeons latéraux, qui donneront naissance aux alvéoles, unités de sécrétion du lait. La différenciation fonctionnelle de la glande est atteinte au début de la lactation. Dès que la lactation cesse, les cellules épithéliales sécrétoires s’engagent massivement dans un processus d’apoptose, et, en régressant, la glande mammaire reprend une morphologie similaire à celle de la femelle vierge adulte. De nouvelles structures alvéolaires se forment à chaque cycle de gestation et lactation. 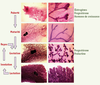 | Figure 1.
Développement postnatal de la glande mammaire murine. Vues générales (à gauche) et détaillées (à droite) de colorations in toto au carmin. Le développement de la glande commence à la puberté par la croissance et la ramification des canaux ; les bourgeons terminaux (indiqués par la flèche jaune) sont des structures transitoires de la glande pubère. La morphogenèse mammaire se poursuit par la formation des alvéoles au cours de la gestation et de la lactation. A la fin de la lactation, le tissu sécrétoire involue. Un nouveau cycle d’expansion alvéolaire est initié à chaque gestation. Les hormones contrôlant la croissance canalaire et le développement alvéolaire sont indiquées à droite. Barres d’échelle : 1,5 mm à gauche, 0,25 mm à droite. |
Différents facteurs hormonaux contrôlent le développement post-natal de la glande. Les œstrogènes, la progestérone et l’hormone de croissance sont nécessaires à la croissance canalaire durant la puberté, tandis que la progestérone et la prolactine gouvernent le développement lobulo-alvéolaire [
3]. |
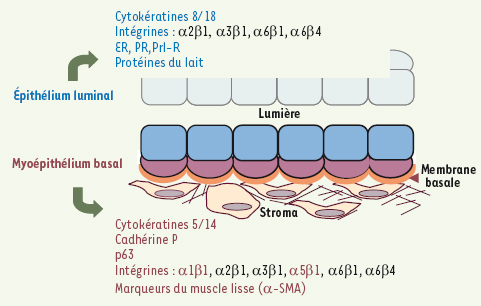
Organisation et marqueurs spécifiques de l’épithélium mammaire Dans les canaux comme dans les alvéoles, l’épithélium mammaire est organisé en une bicouche composée de deux types cellulaires, les cellules basales myoépithéliales et les cellules luminales épithéliales (Figure 2). Une membrane basale sépare l’épithélium du stroma fibro-adipeux environnant. La cohésion de la bicouche épithéliale mammaire est assurée par des interactions intercellulaires - dans lesquelles interviennent des molécules d’adhérence appartenant à la famille des cadhérines - et par des interactions cellulaires avec la membrane basale principalement assurées par des intégrines [
4,
5]. 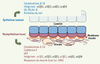 | Figure 2.
Organisation et marqueurs de la bicouche épithéliale mammaire. Un canal est représenté. L’épithélium luminal est en bleu, le myoépithélium basal en rose. Les marqueurs discriminants de chaque couche apparaissent en couleur. ER, PR, Prl-R : récepteurs aux œstrogènes, progestérone et prolactine. |
In situ, on distingue les cellules luminales et myoépithéliales par leur localisation et leur expression de protéines spécifiques. Les cellules myoépithéliales expriment les cytokératines K5 et K14, la cadhérine P et le facteur de transcription p63, caractéristiques des cellules basales des épithéliums stratifiés ; elles contiennent aussi des protéines spécifiques des cellules du muscle lisse (comme l’α-actine du muscle lisse, α-SMA) responsables de leurs propriétés contractiles. Les cellules luminales sont caractérisées par l’expression des cytokératines K8 et K18, des récepteurs hormonaux aux œstrogènes, à la progestérone et à la prolactine (respectivement ERα, PR, Prl-R), et par la production de protéines du lait dès la mi-gestation. Des études ultrastructurales ont révélé la présence de rares cellules peu différenciées, pauvres en organites, en contact avec la membrane basale ou en position suprabasale [1]. Les bourgeons terminaux pubertaires, outre leur taille importante (0,1-0,5 mm de diamètre), présentent une organisation particulière. Ils sont composés de plusieurs couches internes de cellules épithéliales - exprimant majoritairement les cytokératines luminales - et d’une couche externe de cellules apicales de type basal, positives pour l’actine du muscle lisse et p63. Les récepteurs Néogénine et Robo-1, reconnaissant les molécules de guidage sécrétées Nétrine-1 et Slit-2, sont exprimés par les cellules apicales et joueraient un rôle dans l’adhérence intercellulaire des cellules du bourgeon [
6,
44]. Sites d’une prolifération cellulaire intense, les bourgeons terminaux sont des structures transitoires probablement riches en cellules progénitrices, et non en cellules souches permanentes. Les cellules apicales notamment sont considérées comme précurseurs des cellules myoépithéliales canalaires [2]. |
Caractéristiques de régénération de l’épithélium mammaire in vivo
Depuis les travaux pionniers de De Ome et al. [
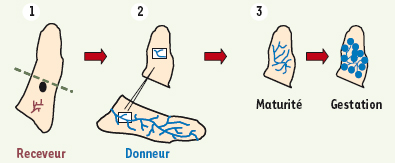
7], l’on dispose d’un test fonctionnel pour analyser in vivo les capacités de développement de l’épithélium mammaire (Figure 3). Chez la souris prépubère âgée de 3 semaines, l’épithélium mammaire est très peu développé tandis que le stroma - ou coussin - adipeux est déjà assez important. On peut par microchirurgie éliminer le rudiment épithélial des glandes inguinales d’une souris hôte prépubère, puis greffer dans la partie intacte du stroma des fragments de glande mammaire ou des cellules épithéliales mammaires isolées. Le développement du greffon peut être analysé chez une souris hôte vierge ou gestante, révélant ses capacités de morphogenèse canalaire et alvéolaire. En revanche, le transplant mammaire ne peut pas être fonctionnel durant la lactation puisqu’il n’est pas connecté au mamelon. L’existence de glandes bilatérales permet de comparer, dans le contexte hormonal d’un même animal receveur, le potentiel de développement - et de tumorigenèse - de deux fragments tissulaires ou deux populations cellulaires. Des transplantations sériées permettent de tester leur capacité de régénération à long terme. 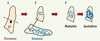 | Figure 3.
Analyse du potentiel de régénération de l’épithélium mammaire in vivo
. (1) Ablation chirurgicale du rudiment épithélial mammaire d’une souris hôte prépubère. La portion de coussin adipeux éliminée comprend le rudiment épithélial (en violet) et le ganglion lymphatique (en noir). (2) Transplantation d’un fragment épithélial issu de glande mammaire de souris donneuse dans la partie intacte du coussin adipeux de l’hôte. (3) Développement de l’épithélium transplanté dans la souris hôte vierge puis gestante. |
Chez la souris, les premiers travaux de transplantation d’épithélium mammaire ont identifié des cellules ayant un potentiel régénératif dans toutes les régions de la glande mammaire et à tous les stades de développement [1,
8]. La sénescence de l’épithélium mammaire est atteinte après six transplantations successives. Chez la femelle vierge, le nombre de cellules ayant un potentiel régénératif, estimé par dilution limite, est d’environ 1 sur 2 000-2 500 cellules épithéliales mammaires. Enfin, l’analyse du patron d’intégration rétroviral d’un épithélium mammaire adulte transplanté chez des receveurs successifs a révélé que les régénérations obtenues pouvaient être clonales, indiquant que des cellules présentant des propriétés de cellules souches seraient responsables de la morphogenèse mammaire [
9]. En effet, une cellule souche adulte se définit fondamentalement par sa capacité à reconstituer à long terme et à l’état clonal la structure et la fonction de son tissu d’origine [
10]. |
Populations candidates de cellules souches et progénitrices mammaires Les étapes de ségrégation des lignages mammaires ne sont pas encore clairement établies. Le développement de greffons présentant des ramifications de type canalaire, alvéolaire ou mixte ayant été observé dans des souris hôtes gestantes, l’hypothèse de la ségrégation de lignages canalaire et alvéolaire distincts à partir d’une cellule souche épithéliale commune a été avancée [
11]. Issues de cellules souches par division asymétrique, des cellules progénitrices formant un compartiment d’amplification transitoire donneraient naissance aux cellules luminales et myoépithéliales des canaux et des alvéoles [
12–
15]. Cellules retenant des marqueurs de l’ADN in vivo
La rétention à long terme d’un marqueur de l’ADN fait partie des propriétés attribuées aux cellules souches tissulaires adultes. Celle-ci reposerait sur le statut essentiellement quiescent des cellules souches [
16] et/ou sur leur capacité, lors de la division asymétrique, à hériter préférentiellement du brin d’ADN matrice, hypothèse proposée par Cairns et récemment reconsidérée [ 12,
17]. Des cellules épithéliales retenant à long terme un marqueur de l’ADN - ou label-retaining cells (LRC) - ont été identifiées dans la glande mammaire en développement [
18,
19]. Les LRC (2 % environ des cellules de l’épithélium) sont distribuées de façon isolée dans tout l’arbre mammaire, en position basale ou luminale. Deux populations, caractérisées par l’absence ou la présence des récepteurs hormonaux ERα et PR, ont été identifiées [
20]. Parmi les LRC, certaines peuvent se diviser de façon asymétrique, en conservant préférentiellement le brin d’ADN matrice [18]. Grâce au modèle transgénique d’expression inductible de l’histone 2B-GFP développé par le groupe d’E. Fuchs, la purification de cellules fluorescentes viables présentant des propriétés analogues à celles des LRC est maintenant possible [
21]. Cette approche devrait permettre de mieux définir les caractéristiques moléculaires des LRC identifiées dans l’épithélium mammaire et d’analyser leurs capacités régénératives. Cellules à fort potentiel régénératif in vivo
Les premières tentatives de purification des cellules souches mammaires adultes fondées sur l’analyse de leur phénotype de surface sont récentes, et c’est en 2006 seulement que deux groupes décrivent l’enrichissement notable (1 cellule sur 60 à 90) de cellules épithéliales mammaires adultes présentant un fort potentiel de régénération à long-terme in vivo [
22,
23]. La population cellulaire enrichie en cellules souches est positive pour la molécule d’adhérence CD24, et exprime fortement soit la sous-unité β1 (CD29) soit la chaîne α6 (CD49f) des intégrines. De façon remarquable, la transplantation d’une cellule unique isolée à partir des populations CD24 pos β1 fort ou CD24 pos α6 fort entraîne la régénération d’une glande entière comprenant un ensemble de canaux ramifiés chez les souris hôtes vierges, et des structures alvéolaires chez les souris hôtes gestantes. L’épithélium formé comprend des cellules myoépithéliales et des cellules luminales qui, durant la gestation, synthétisent des protéines du lait. Les fréquences de régénération lorsqu’une seule cellule est greffée sont de l’ordre de 1 % à 6 %. L’ajout de cellules de soutien n’améliore pas le succès des greffes. Des greffes secondaires et tertiaires sont obtenues à partir des greffons primaires dérivés d’une cellule unique, démontrant les capacités d’autorenouvellement de la cellule initialement transplantée. L’ensemble de ces résultats confirme l’existence de cellules épithéliales mammaires présentant des propriétés de cellules souches. Les populations CD24pos β1fort et CD24pos α6fort représentent moins de 10 % des cellules mammaires isolées [22, 23]. Elles comprennent des LRC, mais ne sont pas enrichies en cellules excluant les colorants Hoechst 33342 et rhodamine 123, une propriété des cellules souches hématopoïétiques murines. Les populations CD24pos β1fort et CD24pos α6fort expriment faiblement Sca-1, contredisant l’enrichissement obtenu dans des cultures d’épithélium mammaire à l’aide de ce marqueur de cellules souches [
24]. Ce désaccord serait dû au fait que Sca-1 est induit à la surface d’une proportion importante de cellules épithéliales mammaires après leur mise en culture [22]. Enfin, la population CD24pos β1fort exprime la chaîne β3 des intégrines [
25]. La fraction CD24pos α6 fort isolée par Stingl et al. est hétérogène, constituée d’un mélange de cellules myoépithéliales (K14+ α-SMA+), luminales (K18+) et de cellules négatives pour K14 et K18 [23]. Au contraire, les travaux du groupe de J. Visvader indiquent que la population CD24pos β1fort est très appauvrie en cellules luminales et nettement enrichie en cellules myoépithéliales [22,
26,
43]. Comme il est peu probable que des cellules myoépithéliales pleinement différenciées soient à l’origine des régénérations observées, Visvader et al. émettent l’hypothèse selon laquelle ces greffes pourraient être attribuées au faible pourcentage de cellules négatives pour K14 et SMA présentes dans la population CD24pos β1fort [
14]. Une étude récente précise que l’intensité d’expression de CD24 permet de distinguer trois populations cellulaires dans le tissu mammaire dissocié : des cellules non épithéliales (CD24neg), basales (CD24faible/modéré), et luminales (CD24fort) [
27]. Les cellules basales CD24faible/modéré sont négatives pour CD133, un marqueur de cellules souches tissulaires adultes, tandis que la fraction luminale comprend une sous-population CD133pos (et Sca-1pos). En accord avec les données précédentes, les auteurs montrent que les cellules ayant un fort potentiel régénératif sont enrichies dans le compartiment basal CD24faible/modéré qui comprend 90 % de cellules myoépithéliales différenciées. De façon intéressante, ce compartiment contient aussi un faible pourcentage de cellules basales non différenciées exprimant K14 mais négatives pour α-SMA. Nous avons révélé l’existence de sous-populations stables de cellules basales présentant ce phénotype particulier dans des lignées épithéliales mammaires de souris [
28,
29]. Les cellules basales isolées à partir de la lignée Comma-Dβ s’autorenouvellent en culture et se différencient in vivo en cellules myoépithéliales et luminales sécrétoires. Comme dans l’épithélium mammaire normal, la fraction de cellules basales exprime modérément CD24, fortement les chaînes α6 et β1 des intégrines, et elle est enrichie en cellules possédant un potentiel morphogénétique [29]. Compte tenu de leur enrichissement encore modeste et de leur relative hétérogénéité, les cellules épithéliales mammaires à fort potentiel régénératif restent à caractériser de façon précise. Toutefois les résultats des expériences de transplantation indiquent que ces cellules sont notablement enrichies dans le compartiment basal mammaire. Les activités résiduelles mais non négligeables de régénération mammaire localisées dans le compartiment luminal restent à explorer. Cellules formant des colonies in vitro
Des essais de formation de colonies in vitro ont été utilisés pour tenter d’identifier des progéniteurs mammaires ( mammary colony-forming cells, Ma-CFC) présentant un potentiel de développement plus restreint que les cellules souches. Des cellules Ma-CFC ont été localisées dans les populations luminales, CD24 pos α6 faible ou CD24 pos β1 faible, et pour cette dernière, plus précisément dans une sous-population exprimant la chaîne β3 des intégrines [ 23, 25]. La sous-population luminale CD24 pos β1 faible β3 pos est majoritairement négative pour ERα. L’ablation du facteur de transcription GATA3 spécifiquement dans les cellules luminales de la glande mammaire conduit à une expansion de progéniteurs ERα - et à un défaut de différenciation luminale [ 25,
30] (→) (→) voir la Nouvelle de M.L. Asselin-Labat, page 1077 de ce numéro). GATA3 jouerait donc un rôle régulateur critique dans la spécification du lignage luminal. Sleeman et al. rapportent également que l’activité Ma-CFC est enrichie dans une population de cellules luminales n’exprimant pas ERα [27]. Celle-ci est identifiable en cytométrie de flux par une forte expression de CD24 et par l’absence de CD133. La descendance présumée des Ma-CFC, les cellules luminales ERα+, est au contraire caractérisée par son expression de CD133 (et de Sca-1) et sa faible capacité à former des colonies in vitro. En résumé, la capacité à former des colonies in vitro n’est pas localisée dans le compartiment basal enrichi en cellules ayant un fort potentiel de régénération in vivo, mais est associée à une sous-population de cellules luminales n’exprimant pas ERα. Deux types de progéniteurs, unipotents et bipotents, semblent capables de se développer dans ces tests car les colonies formées sont, selon les études, soit homogènes de type luminal [23, 25], soit hétérogènes, comprenant des cellules luminales et myoépithéliales [27]. Cellules luminales participant à l’alvéologenèse : approches transgéniques Peu d’études encore mettent à profit l’utilisation de promoteurs spécifiques et de gènes rapporteurs pour suivre le destin des deux lignages mammaires, basal et luminal. À l’aide d’un modèle transgénique d’expression du gène rapporteur LacZ dans des souris exprimant la recombinase Cre sous contrôle du promoteur de la Whey Acidic Protein (WAP-cre/Rosa-LacZ), Wagner et al. ont révélé l’existence d’une population de cellules dites parity-induced mammary epithelial cells ou PI-MEC. Cette population active le promoteur du gène WAP durant la seconde partie de la gestation et pendant la lactation, mais, contrairement à la majeure partie des cellules luminales, elle résiste à l’involution et persiste durant toute la vie de la femelle [
31]. Transplantée in vivo, elle peut contribuer de façon répétée à des régénérations mammaires, essentiellement alvéolaires [
32]. Les PI-MEC et leur descendance comprennent des cellules luminales et myoépithéliales [
33]. Ces études indiquent la contribution de cellules issues du compartiment luminal au développement alvéolaire, et leur capacité à engendrer les deux lignages mammaires. De plus, des travaux très récents de notre groupe montrent que des alvéoles fonctionnelles apparaissent à la mi-gestation à la suite du recrutement d’un progéniteur bipotent résidant dans le compartiment luminal (Taddéi et al., soumis pour publication). |
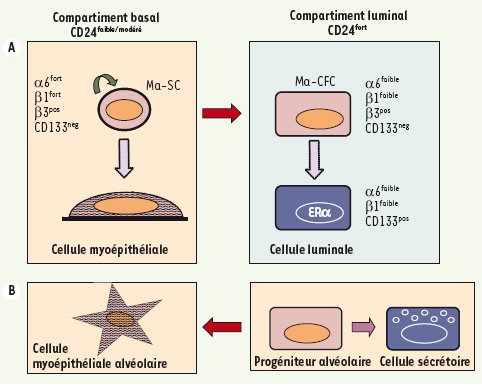
Il existe maintenant différents arguments expérimentaux en faveur de l’existence, dans l’épithélium mammaire murin adulte, de cellules présentant des propriétés de cellules souches. Les stratégies utilisées pour identifier les cellules souches et progénitrices mammaires ne mesurent pas des entités cellulaires aussi bien définies que dans le système hématopoïétique ou la peau. Il est donc encore difficile d’établir un schéma satisfaisant de la ségrégation des lignages mammaires. La Figure 4 en propose un et résume les caractéristiques moléculaires de surface des deux compartiments mammaires, basal et luminal. Dans leur ensemble, les études fondées sur des expériences de transplantation in vivo sont en faveur de l’hypothèse d’une cellule souche mammaire de type basal, exprimant modérément CD24 et fortement les intégrines α6, β1, et β3, récepteurs majeurs des protéines de la matrice extracellulaire. Ces cellules sont copurifiées avec le compartiment myoépithélial différencié, et probablement comme lui en contact avec la membrane basale. Des progéniteurs de type luminal participent à la mammogenèse, notamment à l’alvéologenèse. Ainsi, des populations de cellules souches et progénitrices de type basal et luminal donneraient naissance à la bicouche épithéliale des canaux et des alvéoles. On notera que l’analyse des profils transcriptionnels de carcinomes mammaires humains a révélé l’existence de tumeurs de type basal et de type luminal [
34–
36] dont l’origine pourrait être des cellules souches ou progénitrices mammaires présentant une dérégulation de leurs propriétés d’autorenouvellement et de différenciation. En accord avec cette hypothèse, des « cellules initiatrices de tumeurs » ayant des caractéristiques de cellules souches ont été isolées dans des carcinomes mammaires humains [
37]. 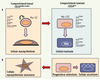 | Figure 4.
Ségrégation et caractéristiques moléculaires des lignages mammaires chez la souris. Les cellules basales et luminales de la glande adulte sont localisées dans les compartiments CD24faible/modéré et CD24fort respectivement. A. Dans la glande mammaire de souris vierges, les cellules épithéliales à fort potentiel régénératif in vivo (cellule souche mammaire, Ma-SC) sont enrichies dans une population CD24faible/modéré α6fort β1fort β3pos, probablement de type basal. Elles sont à l’origine de régénérations mammaires canalaires puis alvéolaires comprenant des cellules myoépithéliales et luminales. Des progéniteurs de type luminal à faible potentiel régénératif in vivo mais formant des colonies en culture (Ma-CFC) ont été localisés dans une population CD24fort α6faible β1faible β3pos CD133neg. Leur descendance présumée, des cellules luminales positives pour ERα, est CD133pos. Les Ma-CFC pourraient aussi engendrer des cellules myoépithéliales. B. Durant la gestation, des progéniteurs de type luminal participent à l’alvéologenèse en donnant naissance à des cellules myoépithéliales et luminales sécrétoires. |
Chez la souris, les quelques modèles génétiques de perturbation ciblée de la fonction des cellules basales mammaires ont montré l’importance de cette couche dans le contrôle du développement normal de la glande [
38]. En particulier, les résultats de notre groupe suggèrent que la voie de signalisation Wnt-βcaténine pourrait participer à la régulation de la prolifération de cellules basales non différenciées présentant des caractéristiques de cellules souches ou progénitrices mammaires [
39]. Plus récemment, nos données montrent que l’ablation spécifique de la chaine β1 des intégrines dans les cellules basales entraîne l’abolition du potentiel régénératif de l’épithélium mammaire, indiquant l’absence de cellules souches fonctionnelles (Taddéi et al., soumis pour publication). La voie est maintenant ouverte pour une meilleure caractérisation des sous-populations épithéliales mammaires à l’aide de nouveaux marqueurs et pour l’étude de leurs potentialités de développement in vivo et en culture. Des stratégies identiques sont utilisées pour isoler et caractériser des cellules souches mammaires humaines [
40,
45] (→). L’adjonction de fibroblastes humains améliore les compétences du stroma murin à induire in vivo la morphogenèse et la différenciation de cellules mammaires normales humaines [
41]. De plus, des cultures cellulaires non adhérentes, ou mammosphères, permettent de maintenir in vitro les propriétés de progéniteurs mammaires humains [
42]. De nombreuses questions restent posées, relatives notamment aux différents facteurs qui contrôlent les fonctions des cellules souches mammaires, aux composants de leur niche, et à leurs propriétés de plasticité. (→) voir l’article de C. Ginestier et al., p. 1133 de ce numéro
|
Nous remercions la Ligue Nationale contre le Cancer (équipe labellisée 2006) et l’Association de Recherche Contre le Cancer (ARC 3771) pour leur soutien. V. Petit bénéficie d’un contrat de l’Institut Curie, I. Taddéi d’une bourse de la Fondation pour la Recherche Médicale. M. Glukhova est directrice de Recherche, M.A. Deugnier et M. Faraldo sont chargées de recherche à l’Inserm.
|
1. Smith GH, Medina DA. Morphologically distinct candidate for an epithelial stem cell in mouse mammary gland. J Cell Sci 1988; 90 : 173–83. 2. Williams JM, Daniel CW. Mammary ductal elongation : differentiation of myoepithelium and basal lamina during branching morphogenesis. Dev Biol 1983; 97 : 274–90. 3. Hennighausen L, Robinson GW. Information networks in the mammary gland. Nat Rev Mol Cell Biol 2005; 6 : 715–25. 4. Daniel CW, Strickland P, Friedmann Y. Expression and functional role of E- and P-cadherins in mouse mammary ductal morphogenesis and growth. Dev Biol 1995; 169 : 511–9. 5. Taddei I, Faraldo MM, Teuliere J, et al. Integrins in mammary gland development and differentiation of mammary epithelium. J Mammary Gland Biol Neoplasia 2003; 8 : 383–94. 6. Strickland P, Shin GC, Plump A, et al. Slit 2 and Netrin 1 act synergistically to generate tubular bi-layers during ductal morphogenesis. Development 2006; 133 : 823–32. 7. Deome KB, Faulkin LJ Jr, Bern HA, Blair PB. Development of mammary tumors from hyperplastic alveolar nodules transplanted into gland-free mammary fat pads of female C3H mice. Cancer Res 1959; 19 : 515–20. 8. Young LJ, Medina D, DeOme KB, Daniel CW. The influence of host and tissue age on life span and growth rate of serially transplanted mouse mammary gland. Exp Gerontol 1971; 6 : 49–56. 9. Kordon EC, Smith GH. An entire functional mammary gland may comprise the progeny from a single cell. Development 1998; 125 : 1921–30. 10. Weissman, IL, Anderson, DJ, Gage, F. Stem and progenitor cells: origins, phenotypes, lineage commitments, and transdifferentiations. Annu Rev Cell Dev Biol 2001; 17 : 387–403. 11. Smith GH. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat 1996; 39 : 21–31. 12. Smalley M, Ashworth A. Stem cells and breast cancer: a field in transit. Nat Rev Cancer 2003; 3 : 832–44. 13. Smith GH. Mammary stem cells come of age, prospectively. Trends Mol Med 2006; 12 : 287–9. 14. Visvader JE, Lindeman GJ. Mammary stem cells and mammopoiesis. Cancer Res 2006; 66 : 9798–801. 15. Woodward WA, Chen MS, Behbod F, Rosen JM. On mammary stem cells. J Cell Sci 2005; 118 : 3585–94. 16. Bickenbach, JR. Identification and behavior of label-retaining cells in oral mucosa and skin. J Dent Res 1981; 60 : 1611–20. 17. Cairns J. Mutation selection and the natural history of cancer. Nature 1975; 255 : 197–200. 18. Smith GH. Label-retaining epithelial cells in mouse mammary gland divide asymmetrically and retain their template DNA strands. Development 2005; 132 : 681–7. 19. Zeps N, Dawkins HJ, Papadimitriou JM, et al. Detection of a population of long-lived cells in mammary epithelium of the mouse. Cell Tissue Res 1996; 286 : 525–36. 20. Booth BW, Smith GH. Estrogen receptor-alpha and progesterone receptor are expressed in label-retaining mammary epithelial cells that divide asymmetrically and retain their template DNA strands. Breast Cancer Res 2006; 8 : R49. 21. Blanpain C, Horsley V, Fuchs E. Epithelial stem cells: turning over new leaves. Cell 2007; 128 : 445–58. 22. Shackleton M, Vaillant F, Simpson KJ, et al. Generation of a functional mammary gland from a single stem cell. Nature 2006; 439 : 84–8. 23. Stingl J, Eirew P, Ricketson I, et al. Purification and unique properties of mammary epithelial stem cells. Nature 2006; 439 : 993–7. 24. Welm BE, Tepera SB, Venezia T, et al. Sca-1(pos) cells in the mouse mammary gland represent an enriched progenitor cell population. Dev Biol 2002; 245 : 42–56. 25. Asselin-Labat ML, Sutherland KD, Barker H, et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol 2007; 9 : 201–9. 26. Asselin-Labat ML, Shackleton M, Stingl J, et al. Steroid hormone receptor status of mouse mammary stem cells. J Natl Cancer Inst 2006; 98 : 1011–4. 27. Sleeman KE, Kendrick H, Robertson D, et al. Dissociation of estrogen receptor expression and in vivo stem cell activity in the mammary gland. J Cell Biol 2007; 176 : 19–26. 28. Deugnier MA, Faraldo MM, Janji B, et al. EGF controls the in vivo developmental potential of a mammary epithelial cell line possessing progenitor properties. J Cell Biol 2002; 159 : 453–63. 29. Deugnier MA, Faraldo MM, Teuliere J, et al. Isolation of mouse mammary epithelial progenitor cells with basal characteristics from the Comma-Dbeta cell line. Dev Biol 2006; 293 : 414–25. 30. Kouros-Mehr H, Slorach EM, Sternlicht MD, Werb Z. GATA-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell 2006; 127 : 1041–55. 31. Wagner KU, Boulanger CA, Henry MD, et al. An adjunct mammary epithelial cell population in parous females: its role in functional adaptation and tissue renewal. Development 2002; 129 : 1377–86. 32. Boulanger CA, Wagner KU, Smith GH. Parity-induced mouse mammary epithelial cells are pluripotent, self-renewing and sensitive to TGF-beta1 expression. Oncogene 2005; 24 : 552–60. 33. Matulka LA, Triplett AA, Wagner KU. Parity-induced mammary epithelial cells are multipotent and express cell surface markers associated with stem cells. Dev Biol 2007; 303 : 29–44. 34. Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours. Nature 2000; 406 : 747–52. 35. Sorlie T, Tibshirani R, Parker J, et al. Repeated observation of breast tumor subtypes in independent gene expression data sets. Proc Natl Acad Sci USA 2003; 100 : 8418–23. 36. Charafe-Jauffret E, Chaffanet M, Bertucci F, et al. Les cancers du sein : vers un modèle cellulaire et moléculaire intégré. Med Sci (Paris) 2007; 23 : 626–32. 37. Clarke MF, Fuller M. Stem cells and cancer: two faces of Eve. Cell 2006; 124 : 1111–15. 38. Faraldo MM, Teuliere J, Deugnier MA, et al. Myoepithelial cells in the control of mammary development and tumorigenesis: data from genetically modified mice. J Mammary Gland Biol Neoplasia 2005; 10 : 211–9. 39. Teuliere J, Faraldo MM, Deugnier MA, et al. Targeted activation of beta-catenin signaling in basal mammary epithelial cells affects mammary development and leads to hyperplasia. Development 2005; 132 : 267–77. 40. Villadsen R, Fridriksdottir AJ, Ronnov-Jessen L, et al. Evidence for a stem cell hierarchy in the adult human breast. J Cell Biol 2007; 177 : 87–101. 41. Proia DA, Kuperwasser C. Reconstruction of human mammary tissues in a mouse model. Nat Protoc 2006; 1 : 206–14. 42. Dontu G, Abdallah WM, Foley JM, et al.
In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes Dev 2003; 17 : 1253–70. 43. Asselin-Labat ML. Cellules souches et progéniteurs dans la glande mammaire : rôle critique du facteur de transcription Gata-3. Med Sci (Paris) 2007; 23 : 1075–7. 44. Nasarre P, Constantin B, Drabkin HA, Roche J. Sémaphorines et cancers : état des lieux. Med Sci (Paris) 2005; 21 : 641–7. 45. Ginestier C, Korkaya H, Dontu G, et al. La cellule souche cancéreuse : un pilote aux commandes du cancer du sein. Med Sci (Paris) 2007; 23 : 1133–39. |