| |
| Med Sci (Paris). 2007 March; 23(3): 240–242. Published online 2007 March 15. doi: 10.1051/medsci/2007233240.La transplantation de photorécepteurs immatures Un moyen pour réparer la rétine Thierry Léveillard,* Saddek Mohand-Saïd, and José-Alain Sahel Laboratoire de Physiopathologie Cellulaire et Moléculaire de la Rétine. Inserm U592, Université Pierre et Marie Curie Paris, Institut de la Vision,Centre Hospitalier national des Quinze-Vingts, 28, rue de Charenton, 75012 Paris, France. Faculté de Médecine, Hôpital Saint-Antoine, 27, rue Chaligny, 75571 Paris Cedex 12, France MeSH keywords: Animaux, Apoptose, Facteurs de transcription à motif basique et à glissière à leucines, Différenciation cellulaire, Protéines de liaison à l'ADN, Protéines de l'oeil, Thérapie génétique, Humains, Souris, Souris knockout, Souches mutantes de souris, Souris transgéniques, Cellules photoréceptrices de vertébré, Rétine, Cellules bipolaires rétiniennes, Dégénérescence de la rétine, Rhodopsine, Transplantation de cellules souches, Synapses, Thiorédoxines |
Les dégénérescences rétiniennes héréditaires constituent une famille de maladies « cécitantes »1 aujourd’hui incurables. Ces maladies sont très hétérogènes génétiquement puisque des mutations dans plus d’une centaine de gènes aujourd’hui répertoriés (http://www.sph.uth.tmc.edu/Retnet/) entraînent la mort des photorécepteurs par apoptose et donc la cécité. Bien que les fondements d’une thérapie par remplacement génique aient été établis dans un modèle canin de la maladie [
1], les coûts considérables du développement d’une telle approche appliquée à chaque gène ont conduit de nombreux chercheurs à envisager des solutions alternatives. |
Transplantation de précurseurs de photorécepteurs La transplantation de photorécepteurs sains est une de ces alternatives à laquelle les travaux de MacLaren et al. [
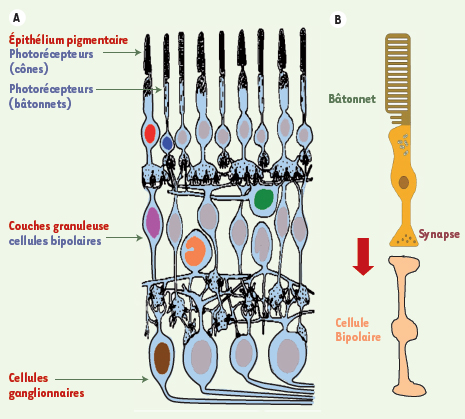
2] viennent d’apporter une importante contribution. En effet, pour que le tissu transplanté puisse jouer son rôle de remplacement fonctionnel des photorécepteurs manquants, il est impératif que ceux-ci établissent des connexions synaptiques avec les neurones bipolaires de l’hôte, eux-mêmes connectés aux prolongements du nerf optique (Figure 1A, B). Les chercheurs se sont donc intéressés aux tissus embryonnaires dont on pouvait penser que, parce qu’ils sont constitués de cellules immatures, ils conserveraient assez de plasticité pour s’intégrer au tissu de l’hôte et y établir les contacts synaptiques nécessaires. Cette approche s’est révélée infructueuse et, comme le démontrent MacLaren et al., bien que ces cellules immatures soient capables de survivre comme le sont d’ailleurs les cellules rétiniennes adultes, de s’intégrer et de migrer dans la rétine, il manque le signal qui leur permettrait de reconnaître les cellules bipolaires de la rétine greffée comme les partenaires avec lesquels elles doivent établir des contacts. L’étude de la séquence des événements contrôlant le développement de ces cellules immatures en cellules rétiniennes différenciées et fonctionnelles, un thème de recherche majeur en neurobiologie, a conduit, entre autres, à l’identification des facteurs de transcription contrôlant ce processus [
3]. La maturation des cellules rétiniennes est orchestrée par des combinaisons de ces facteurs de transcription qui spécifient le devenir des progéniteurs rétiniens. Le facteur de transcription NRL (neural leucine zipper) participe à la différenciation en photorécepteurs à bâtonnets (les photorécepteurs les plus nombreux chez les mammifères). Chez la souris, son expression est initialement détectée dans les précurseurs post-mitotiques des bâtonnets un jour après la naissance (P1). Puisque la transplantation de photorécepteurs concerne en premier lieu les bâtonnets, qui représentent 97 % des photorécepteurs, MacLaren et al. [2] ont transplanté les cellules rétiniennes au stade correspondant à l’apparition, dans la séquence de développement de la rétine, des précurseurs des bâtonnets. Ces cellules P1, à la différence des cellules plus immatures utilisées précédemment, ont démontré leur capacité à se différencier chez l’hôte en bâtonnets matures et à établir des contacts synaptiques avec les cellules bipolaires de l’hôte. Les auteurs démontrent ainsi qu’il existe une fenêtre de temps (P1-P6) pendant laquelle les précurseurs des bâtonnets peuvent être utilisés pour remplacer les cellules dégénérées. De plus, la transplantation de ces précurseurs dans deux modèles murins de dégénérescence rétinienne, la souris rds et la souris dont le gène de la rhodopsine est inactivé, permet de restaurer les fonctions visuelles. Cette observation est une étape supplémentaire vers une application thérapeutique. Néanmoins, et comme le note Thomas Reh [
4], le transfert vers la clinique de ces résultats se heurte au fait que cette période utile correspond chez l’homme à la troisième semaine de développement embryonnaire. Cependant, ce travail pourrait aussi préparer une approche fondée sur l’utilisation de cellules souches embryonnaires reprogrammées par le facteur de transcription NRL. Ainsi comme le démontrent MacLaren et al. [2], les cellules exprimant NRL, isolées à P1 (un jour post-natal) à partir d’une souris transgénique exprimant le marqueur GFP sous le contrôle du promoteur NRL et construite par le groupe de Anand Swaropp [
5], sont capables de récapituler les effets de la transplantation, ce que ne font pas les cellules nrl-GFP+ purifiées chez des embryons au 11e jour de développement. L’avenir dira si ce seul facteur est suffisant pour contrôler le processus de maturation et de reconnexion.  | Figures 1.
Organisation schématique de la rétine (A) et d’un photorécepteur à bâtonnet (B).
|
|
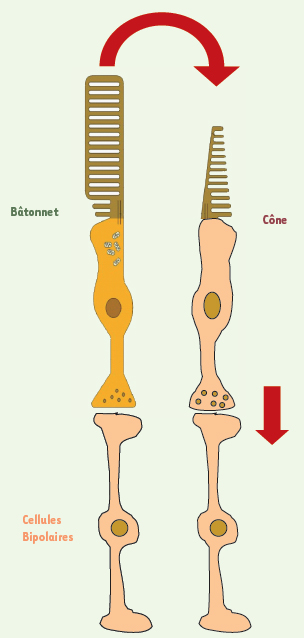
Agir sur la survie des cônes : une alternative à la greffe de photorécepteurs Le bénéfice de la transplantation sur la fonction visuelle avait d’ailleurs déjà été observé suivant d’autres modalités [
6]. En effet, dans la majeure partie des cas, les mutations associées aux dégénérescences rétiniennes affectent directement les bâtonnets, mais c’est la perte secondaire des cônes qui représente le handicap principal pour ces patients puisque les cônes sont les photorécepteurs les plus importants pour la vision. Le maintien de la fonction visuelle est ici attribuable aux cônes de l’hôte qui sont protégés, comme nous l’avons nous-mêmes montré [
7]. Il s’agit ici d’une alternative thérapeutique envisageable (Figure 2). Cette recherche nous a d’ailleurs conduit à isoler un nouveau facteur trophique, rod-derived cone viability factor (RdCVF), qui est sécrété par les bâtonnets et est nécessaire à la survie des cônes [
8]. Restaurer l’expression de RdCVF permettrait de maintenir les cônes et donc la vision chez les patients, une approche dans laquelle nous sommes pleinement engagés.  | Figure 2.
Interactions entre les bâtonnets et les cellules bipolaires, et les bâtonnets et les cônes.
|
Le groupe de Robin Ali [2] ouvre donc une nouvelle voie dans la recherche thérapeutique des dégénérescences rétiniennes. En fait, que ce soit la thérapie génique corrective [1], l’utilisation de facteurs trophiques agissant sur les cônes [8], ici la manipulation de facteurs de transcription [2] ou encore l’utilisation d’implants artificiels [
9], les chercheurs se livrent à une compétition qui apporte un espoir pour les patients souffrant de ces affections. |
Footnotes |
1. Acland GM, Aguirre GD, Ray J, et al. Gene therapy restores vision in a canine model of childhood blindness. Nat Genet 2001; 28 : 92–5. 2. MacLaren RE, Pearson RA, MacNeil A, et al. Retinal repair by transplantation of photoreceptor precursors. Nature 2006; 444 : 203–7. 3. Cepko CL. The roles of intrinsic and extrinsic cues and bHLH genes in the determination of retinal cell fates. Curr Opin Neurobiol 1999; 9 : 37–46. 4. Reh TA. Neurobiology: right timing for retina repair. Nature 2006; 444 : 156–7. 5. Akimoto M, Cheng H, Zhu D, et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proc Natl Acad Sci USA 2006; 103 : 3890–5. 6. Arai S, Thomas BB, Seiler MJ, et al. Restoration of visual responses following transplantation of intact retinal sheets in rd mice. Exp Eye Res 2004; 79 : 331–41. 7. Mohand-Said S, Hicks D, Dreyfus H, Sahel JA. Selective transplantation of rods delays cone loss in a retinitis pigmentosa model. Arch Ophthalmol 2000; 118 : 807–11. 8. Léveillard T, Mohand-Said S, Lorentz O, et al. Identification and characterization of rod-derived cone viability factor. Nat Genet 2004; 36 : 755–9. 9. Zrenner E. Will retinal implants restore vision ? Science 2002; 295 : 1022–5. |