Dans les systèmes sensoriels, le relais de l’information repose sur des réseaux de connexions nerveuses très organisés. La mise en place de cette connectivité neuronale complexe résulte de la capacité des axones à sélectionner leur trajet, à se brancher et à établir des connexions stables avec leurs neurones cibles au sein du cerveau. Un des exemples les plus remarquables d’organisation neuronale et de raffinement des circuits neuronaux est l’établissement des cartes somatotosensorielles (soma : corps) du cerveau. Le relais de l’information du toucher, de température, et de la nociception (douleur) venant des différentes parties de notre corps (face, langue, lèvres, doigts, tronc, etc.) est topographiquement organisé dans notre cerveau sous la forme d’un ensemble de cartes de représentation neuronale plus connu chez l’homme sous le nom d’ « homunculus de Penfield » [ 1]. Les mécanismes moléculaires qui coordonnent la mise en place de ces circuits topographiquement ordonnés dans le système somatosensoriel restent cependant encore très peu connus. Récemment, le gène Hoxa2 a été identifié comme un gène clé pour la mise en place de la carte somatosensorielle de la face [ 2].
Les cartes somatosensorielles sont à la base du traitement précis des informations sensitives collectées par les récepteurs périphériques. Elles résultent d’un important réseau de connexions nerveuses qui permet de relayer l’information de manière ordonnée à travers différentes stations dans le cerveau. Au sein de chacune de ces stations, les connexions entre les éléments axonaux et neuronaux reproduisent et conservent fidèlement la distribution spatiale et la densité des récepteurs sensitifs distribués à la surface de notre corps. L’ensemble des régions de notre corps est ainsi cartographié dans notre cerveau, en fonction de l’importance fonctionnelle sensitive et non pas de la taille corporelle réelle de ces différentes régions. Par exemple, chez l’homme la représentation des lèvres, organe très sensible, occupe proportionnellement un espace cérébral beaucoup plus important que celle du dos.
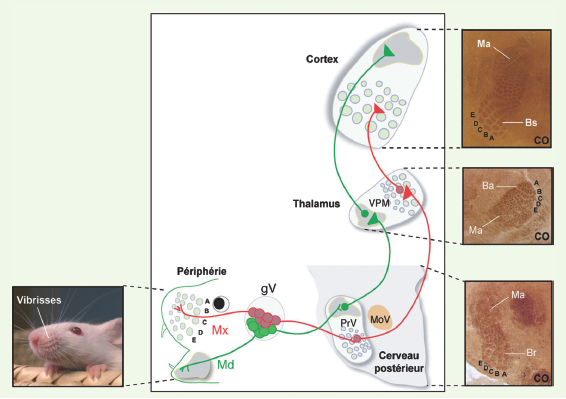
Chez les rongeurs, les vibrisses (ou moustaches) représentent l’organe tactile le plus développé et utilisé dans l’exploration de leur environnement (beaucoup plus que leurs pattes ou leur système visuel). Le relais de l’information sensitive de la face (et donc des vibrisses) entre la périphérie et le cerveau est assuré par le nerf trijumeau dont les neurones sont localisés dans le ganglion de Gasser. Ensuite, l’information est reliée au sein du cerveau par le circuit trigéminal qui s’organise topographiquement au niveau de trois stations cérébrales : le cerveau postérieur, le thalamus, et le cortex somatosensoriel [ 3] (Figure 1). Les connexions entre les éléments axonaux afférents et les neurones cibles de chacune de ces stations reproduisent fidèlement l’arrangement spatial des récepteurs sensoriels des vibrisses sous la forme de véritables modules neuronaux - chaque module contrôlant l’information sensorielle d’une vibrisse [ 4] (Figure 1). Cette organisation modulaire forme une carte neuronale « somatotopique » de représentation des vibrisses que l’on peut clairement visualiser par une simple coloration à la cytochrome oxydase (Figure 1). Grâce à cette organisation spécifique, ce modèle est devenu le paradigme dans l’étude de la mise en place du relais de l’information sensitive et du développement des cartes neuronales somatosensorielles.
| Figure 1.
Représentation schématique du circuit sensoriel trigéminal chez la souris. L’information somatosensorielle de la face est collectée par trois branches périphériques du nerf trijumeau : la branche ophtalmique (non représentée), la branche maxillaire (Mx) (en rouge) et la branche mandibulaire (Md) (en vert), qui innervent les différents territoires de la face. L’information est ensuite relayée topographiquement par trois stations cérébrales : le cerveau postérieur, qui contient le noyau sensoriel trigéminal principal (PrV) et le noyau spinal trigéminal (non représenté) ; le thalamus, au niveau du noyau ventral postéro-médial (VPM); et le cortex somatosensoriel (région pariétale du cortex). Les photos montrent l’arrangement modulaire de la carte de représentation des vibrisses au niveau des différentes stations par une coloration enzymatique à la cytochrome oxydase (CO). Les modules neuronaux reproduisent fidèlement l’arrangement spatial des vibrisses sur le museau de l’animal et sont appelés (en anglais): barrelettes (Br) au niveau de la station rhombencéphalique, barreloids (Ba) au niveau de la station thalamique et barrels (Bs) au niveau de la station corticale. Ma : carte de la région mandibulaire. gV : ganglion trigéminal. |
Nous possédons aujourd’hui une bonne connaissance de l’anatomie et de la physiologie de ce circuit. Cependant, peu de choses sont connues sur les mécanismes cellulaires et moléculaires qui contrôlent sa mise en place durant le développement embryonnaire. Les limites de nos connaissances concernent en particulier les mécanismes qui permettent l’organisation somatotopique des neurones sensoriels du système trigéminal au niveau du cerveau postérieur, qui constituent pourtant la première station cérébrale du circuit et forme le véritable socle de la carte somatosensorielle de la face. Chez les vertébrés, le cerveau postérieur ou rhombencéphale est transitoirement segmenté, au cours du développement embryonnaire, le long de son axe antéro-postérieur (A-P) en 7-8 segments (suivant les espèces) appelés « rhombomères » [ 5, 6]. Chaque compartiment se comporte comme une véritable unité de lignage polyclonale, car les cellules des différents rhombomères restent bien ségrégées et ne se mélangent pas avec celles des rhombomères voisins. Le processus de segmentation est ainsi à la base de l’identité positionnelle A-P des neurones dérivés des différents rhombomères [5, 6]. Nous avons très récemment montré que l’origine rhombomérique des neurones joue aussi un rôle déterminant dans la mise en place de l’organisation somatotopique du noyau sensoriel principal (PrV) du système trigéminal (Figure 1), qui constitue le relais majeur de l’information sensitive de la face au niveau du cerveau postérieur [2]. Nous avons en particulier observé que la partie du PrV qui contient la carte de représentation des vibrisses est uniquement composée de neurones dérivant du rhombomère (r)3 (Figure 2). En revanche, la région du PrV qui relie l’information sensorielle en provenance de la mâchoire et de la lèvre inférieure est entièrement dérivée du rhombomère 2. Donc, l’origine des neurones du PrV au niveau de différents rhombomères est responsable de la ségrégation spatiale des différentes « aires » de la carte somatosensorielle de la face présentes dans le cerveau de l’animal adulte.
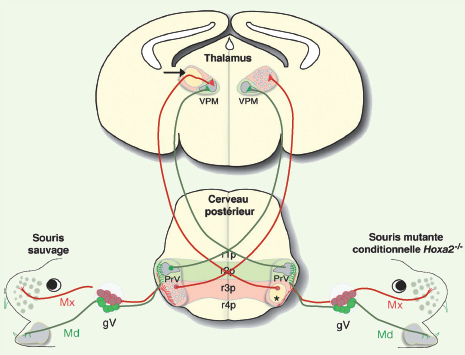
| Figure 2.
Représentation schématique du rôle du gène
Hoxa2
et de la segmentation rhombomérique dans la mise en place du système trigéminal. Le diagramme montre des sections de cerveau prélevé au cours de la première semaine post-natale. Dans le rhombencéphale, les territoires formés par les dérivés du r2 et r3 sont représentés respectivement en vert et en rouge. La carte neuronale de représentation des vibrisses au niveau du noyau PrV est entièrement composée de neurones qui dérivent du rhombomère (r)3. En revanche, la carte de représentation de la région mandibulaire est entièrement composée de neurones qui dérivent du r2. Les afférences trigéminales primaires de la région mandibulaire (Md) sont représentées en vert et s’arborisent avec les neurones du PrV qui dérivent du r2 ; les neurones du PrV qui dérivent du r3 ne reçoivent quant à eux que des afférences de la région maxillaire (Mx) qui contient les vibrisses (représentés en rouge). Les projections axonales des neurones du PrV s’organisent au niveau du thalamus controlatéral selon un patron topographique et complémentaire de distribution qui est en accord avec l’origine rhombomérique de ces neurones. Les domaines de distribution des terminaisons axonales provenant des neurones qui dérivent du r2 et r3 sont représentés respectivement en vert et en rouge. Une inactivation « conditionnelle » du gène Hoxa2 spécifiquement au niveau de r3 ou pendant le branchement des axones du nerf trijumeau avec le PrV conduit à une réduction drastique de l’arborisation des afférences en provenance des vibrisses avec leurs neurones cibles du PrV (astérisque).Ces mêmes neurones montrent aussi un défaut de la topographie de leurs projections axonales au niveau de la station thalamique (flèche). Ces défauts de mise en place de la connectivité neuronale conduisent à une absence de la carte de représentation des vibrisses au niveau des stations rhombencéphalique et thalamique (représentées par les zones jaunes). gV : ganglion trigéminal. |
Nous nous sommes ensuite demandés si les gènes qui spécifient l’identité A-P des différents rhombomères ne pourraient pas aussi jouer un rôle dans l’organisation de la connectivité des neurones dérivés de ces segments et dans la mise en place de la somatotopie du système trigéminal. Chez les vertébrés, les facteurs de transcription à homéodomaine codés par la famille des gènes Hox joue un rôle essentiel dans la détermination de l’identité positionnelle des cellules le long de l’axe A-P de l’embryon [5, 6]. Durant le développement précoce du cerveau postérieur, les progéniteurs neuronaux de chaque rhombomère expriment une combinaison spécifique de gènes Hox, qui est ensuite traduite par une identité positionnelle spécifique. Les neurones dérivés de chaque segment adoptent de ce fait une localisation précise le long de l’axe. Cependant, jusqu’à aujourd’hui nous ne savions pas si les gènes Hox pourraient être également nécessaires à l’organisation ultérieure de ces neurones en réseaux topographiquement organisés [ 7].
Nous avons récemment mis en évidence le rôle crucial de l’un des membres de la famille Hox, le gène Hoxa2, dans la mise en place de la somatotopie du PrV et en particulier dans l’établissement de la carte des vibrisses chez la souris [2]. D’une part, son expression précoce dans le rhombencéphale est requise pour le guidage et l’arrêt des afférences du nerf trijumeau au niveau du futur emplacement du noyau PrV : en l’absence d’expression du gène Hoxa2, les afférences sensorielles trigéminales ne s’arrêtent pas au niveau du pons mais projettent de manière aberrante au cervelet. D’autre part, une expression plus tardive du gène Hoxa2 dans les neurones du PrV est nécessaire pour l’arborisation des afférences en provenance des vibrisses avec leurs neurones cibles, ainsi que pour le contrôle de la distribution topographique des projections des neurones du PrV au niveau de la station thalamique du circuit (Figure 2). Enfin, l’inactivation du gène Hoxa2 conduit à l’absence de la carte des vibrisses au sein des différentes stations du circuit (Figure 2).
Ce travail constitue une avancée importante dans la compréhension des mécanismes transcriptionnels qui contrôlent la connectivité neuronale. De plus, il démontre pour la première fois qu’un membre de la famille des gènes Hox, connus pour leur rôle dans des phases précoces du développement, joue également un rôle majeur au cours la mise en place de la topographie du système somatosensoriel [2]. Une étude récente a montré que d’autres membres de cette famille de gènes jouent également un rôle fondamental dans la connectivité des motoneurones avec leurs cibles musculaires [ 8]. Les gènes Hox pourraient ainsi constituer des acteurs moléculaires majeurs dans le développement des circuits sensorimoteurs chez les vertébrés pour la mise en place de réseaux de connexions topographiques entre l’ensemble du corps et le système nerveux central.