| |
| Med Sci (Paris). 2007 March; 23(3): 279–284. Published online 2007 March 15. doi: 10.1051/medsci/2007233279.Les cellules dendritiques transfectées avec de l’ARN messager Une approche prometteuse en immunothérapie Karine Maisnier-Patin,1,2,3* Sandrine Crabé,1,2,3 Gaëlle Breton,1,2,3 Franck P. Dupuy,1,2,3 Bader Yassine-Diab,1,2 and Rafick-Pierre Sékaly1,2,3,4* 1Laboratoire d’immunologie,Centre de recherche du CHUM Saint-Luc,264, boulevard René-Lévesque Est,Pavillon Édouard Asselin,Montréal, Québec H2X 1P1,Canada. 2Laboratoire d’Immunologie, Département de microbiologieet d’immunologie, Université de Montréal,Montréal, Québec, Canada 3Inserm U743 en immunologie humaine, CR-CHUM,Université de Montréal, Montréal, Québec, Canada 4Département de microbiologie et d’immunologie,Université McGill, Montréal, Québec, Canada |
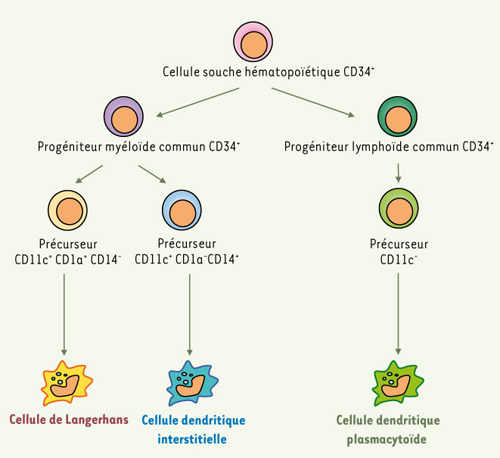
Les cellules dendritiques et leurs fonctions Il existe deux types de cellules dendritiques issues de précurseurs différents : les cellules dendritiques plasmacytoïdes et myéloïdes. Les cellules dendritiques plasmacytoïdes, d’origine lymphoïde, se trouvent dans les zones T des organes lymphoïdes, dans le thymus et dans le sang ; les cellules dendritiques interstitielles et les cellules de Langerhans, d’origine myéloïde, se trouvent dans des sites en contact avec l’environnement extérieur (muqueuses et peau) (Figure 1). 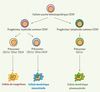 | Figure 1.
Origine des cellules dendritiques plasmacytoïdes et myéloïdes. Les cellules dendritiques se différencient à partir de cellules souches hématopoïétiques CD34+ de la moelle osseuse selon deux voies de différenciation classiquement décrites : la voie lymphoïde et la voie myéloïde. Dans la voie lymphoïde, le progéniteur lymphoïde commun CD34+, issu de cellules souches hématopoïétiques CD34+, donne naissance aux lignées de cellules B, T et NK (natural killer) et à un précurseur lymphoïde CD11c- qui se différencie en cellule dendritique plasmacytoïde. Ces dernières se trouvent dans le thymus, les zones T des organes lymphoïdes et le sang. Dans la voie myéloïde, le progéniteur myéloïde commun CD34+, issu de cellules souches hématopoïétiques CD34+, donne naissance à un précurseur myéloïde CD11c+ CD1a+ CD14- qui migre dans l’épiderme pour se différencier en cellule de Langerhans ou à un précurseur myéloïde CD11c+ CD1a- CD14+ qui migre dans le derme et les tissus conjonctifs pour se différencier en cellule dendritique interstitielle. |
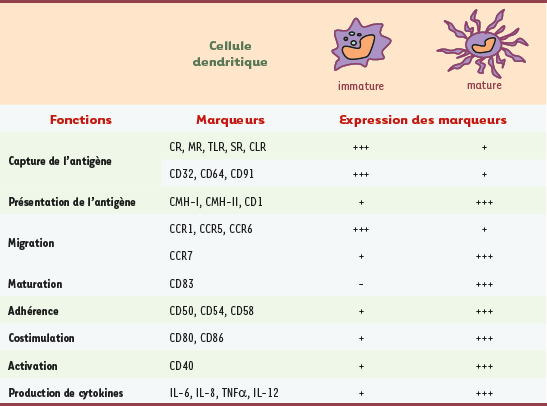
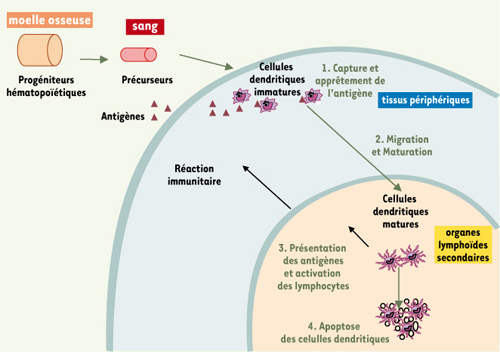
En périphérie, les cellules dendritiques, à l’état immature, sondent continuellement leur environnement à la recherche d’antigènes (Ag), qu’elles capturent par phagocytose ou endocytose. En présence de molécules issues de pathogènes comme les PAMP (pathogen-associated molecular pattern), reconnus par les TLR (toll-like receptors), de molécules associées à l’inflammation, comme les cytokines pro-inflammatoires interleukine-1β (IL-1β) et tumor necrosis factor α (TNFα), les cellules dendritiques entrent alors dans un processus de maturation. Celui-ci induit une série de modifications morphologiques (apparition de dendrites), immunophénotypiques et fonctionnelles qui vont transformer ces cellules spécialisées dans la capture d’Ag (immatures) en cellules spécialisées dans la présentation d’Ag (matures). Elles vont migrer des tissus périphériques vers les organes lymphoïdes secondaires afin de stimuler les lymphocytes T CD4 et/ou CD8 (naïfs ou mémoires) spécifiques de l’Ag et déclencher leur différenciation en cellules effectrices [
1–
3] (Figure 2). Les cellules dendritiques matures expriment alors le marqueur de maturation CD83 et surexpriment les molécules du complexe majeur d’histocompatibilité (CMH), les molécules d’adhérence (comme CD50, CD54 et CD58) et de costimulation (comme CD40, CD80 et CD86), ainsi que le récepteur des chimiokines CCL19 et CCL21 : CCR7 qui contrôle la migration vers les zones T ganglionnaires [
4–
6]. Enfin, elles produisent de nombreuses cytokines comme l’IL-6, l’IL-8, le TNFα et l’IL-12 qui vont stimuler la réponse immunitaire [
7] (Tableau I).  | Tableau I.
Principales molécules associées à la maturation des cellules dendritiques. CR : complement receptor ; MR : mannose receptor ; TLR : toll-like receptor ; SR : scavenger receptor ; CLR : c-type lectin receptor ; - : absence d’expression ; + : faible expression ; +++ : forte expression. |
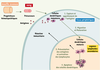 | Figure 2.
Activation des lymphocytes T par les cellules dendritiques. Les cellules dendritiques dérivent de précurseurs circulants. Ces précurseurs dérivent de progéniteurs hématopoïétiques qui prolifèrent dans la moelle osseuse. Situées dans les tissus périphériques, les cellules dendritiques à l’état immature capturent les antigènes issus de différents pathogènes (1). En présence de molécules issues de pathogènes comme les PAMP (pathogen-associated molecular pattern, reconnus par les TLR, toll-like receptors), de molécules associées à l’inflammation, comme les cytokines pro-inflammatoires interleukine-1β (IL-1β) et tumor necrosis factor α (TNFα), ces cellules dendritiques entrent ensuite dans un processus de maturation et migrent vers les organes lymphoïdes secondaires (2). Dans les organes lymphoïdes secondaires, les cellules dendritiques matures présentent aux lymphocytes T CD4 et/ou CD8 les peptides issus des antigènes en association avec les molécules du CMH, ce qui déclenche la différenciation des lymphocytes spécifiques de l’antigène en cellules effectrices. Ces lymphocytes T activés quittent les organes lymphoïdes secondaires pour rejoindre le site original de l’infection (présence de l’antigène) (3). Les cellules dendritiques meurent par apoptose (4). |
|
L’immunothérapie fondée sur l’utilisation de cellules dendritiques transfectées avec de l’ARN messager Différentes stratégies sont employées pour livrer les Ag d’intérêt aux cellules dendritiques [
8,
9]. Les cellules dendritiques peuvent être chargées avec des peptides synthétiques [
10]. Cette méthode requiert la détermination préalable d’épitopes immunogènes et demeure limitée aux patients exprimant un certain haplotype du CMH. De plus, la présentation antigénique reste transitoire car le peptide est rapidement dégradé ou possède une affinité vis-à-vis des molécules du CMH qui ne suffit généralement pas pour activer de façon optimale les cellules T CD4 et CD8 spécifiques. Afin d’élargir la réponse à d’autres épitopes non identifiés sans la contrainte liée à la restriction au CMH, il est possible de charger les cellules dendritiques avec des protéines tumorales ou virales, des extraits de cellules tumorales ou bien encore des corps apoptotiques [
11]. Cette dernière approche n’est cependant pas appropriée dans le cas de certaines pathologies qui présentent un défaut dans l’apprêtement de l’Ag. D’autres essais ont tenté de livrer directement les Ag dans les cellules dendritiques en transfectant ces dernières avec de l’ADN ou en les infectant avec des virus recombinants de type rétroviral ou adénoviral codant pour les Ag étudiés. L’utilisation des virus recombinants pose néanmoins le problème de la réaction immunitaire dirigée en grande partie contre le vecteur viral lui-même. Une autre approche vaccinale consiste à utiliser des cellules dendritiques transfectées avec des ARN messagers (ARNm) codant pour des Ag connus, ou avec l’ensemble des ARNm isolés directement à partir de tumeurs, afin d’induire une réponse immunitaire spécifique. Une étude, menée par D. Boczkowski et ses collaborateurs, a montré que des cellules dendritiques transfectées avec les ARNm issus d’une tumeur sont capables : (1) d’engendrer des lymphocytes T cytotoxiques spécifiques (cytotoxic T lymphocyte, CTL) in vitro et (2) de protéger des souris contre une injection létale de cellules tumorales d’où sont issus les ARNm [
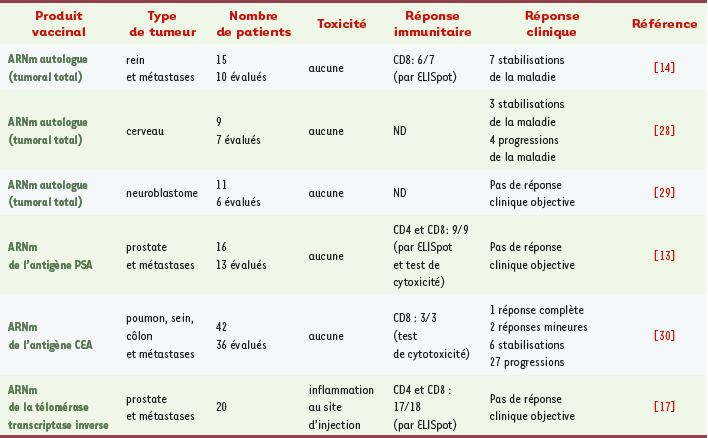
12]. En outre, le développement des techniques de biologie moléculaire a permis l’amplification d’ARNm rares ou encore non identifiés à partir de faibles quantités de tissus tumoraux. Trois techniques pour transfecter l’ARNm sont utilisées : la transfection passive, l’électroporation et l’utilisation des liposomes. La transfection passive consiste à incuber l’ARNm avec les cellules dendritiques qui l’incorporent par macropinocytose. L’ARNm contenu dans les vésicules intracellulaires ainsi formées, les macropinosomes, va en partie être libéré dans le cytoplasme. Cepe ndant, le transfert d’ARNm par cette méthode a une efficacité trop faible pour induire une réponse immune satisfaisante. En revanche, l’électroporation, qui consiste à envoyer une décharge électrique aux cellules pour forcer l’ouverture des pores membranaires, permet l’entrée de l’ARNm de façon plus efficace dans le cytoplasme. Enfin, les liposomes sont de petites sphères phospholipidiques artificielles contenant l’ARNm, qui ont la capacité de fusionner avec la membrane plasmique pour introduire l’ARNm dans la cellule. Une fois dans le cytoplasme, l’ARNm transfecté est traduit en protéines qui vont être dégradées en peptides par le protéasome. Ces peptides sont transportés dans le réticulum endoplasmique, associés au CMH-I et présentés aux cellules T CD8. Des essais cliniques prometteurs en immunothérapie anti-tumorale Dans un premier essai de vaccination chez l’homme, publié par le groupe d’A. Heiser, des cellules dendritiques transfectées avec l’ARNm codant pour l’Ag PSA ( prostate specific antigen) ont été injectées à des patients atteints d’un cancer de la prostate. Les résultats montrent que la vaccination induit une augmentation des lymphocytes T CD8 activés, sécréteurs d’interféron γ (IFNγ), spécifiques de l’Ag PSA chez neuf des treize patients associée à une diminution du marqueur sanguin PSA chez six patients sur sept évalués [
13]. Dans un autre essai de phase I mené par Z. Su, dix patients atteints d’un cancer rénal métastatique ont été vaccinés avec des cellules dendritiques transfectées avec les ARNm tumoraux totaux. Sept des dix patients ont eu une stabilisation de la maladie ou une atténuation de la croissance tumorale. Chez cinq des six patients analysés, une réponse T CD8 polyclonale spécifique de la tumeur a été observée. De plus, ces CTL spécifiques de la tumeur présentent une activité cytotoxique dans des tests ex vivo [
14]. Ces études montrent aussi que ce type de vaccination est bien toléré chez les patients et aucune toxicité n’a été observée. Les cellules T CD4 ont un rôle important dans le déclenchement, le maintien et la potentialisation d’une réponse T CD8 anti-tumorale efficace [
15]. Une réponse T CD4 requiert la présentation des peptides antigéniques par les molécules de CMH-II. S.K. Nair et son groupe ont ainsi utilisé des ARNm codant pour l’Ag CEA (carcinoembryonic antigen) associé à la séquence LAMP-1 (lysosome-associated membrane protein-1) afin de cibler l’Ag vers les compartiments lysosomaux. Cette stratégie permet d’induire in vitro une réponse T à la fois cytotoxique et auxiliaire spécifique de CEA [
16]. À la suite de ces résultats, Z. Su et ses collaborateurs ont démontré dans un essai clinique récent que des cellules dendritiques transfectées avec l’ARNm codant pour la protéine chimérique LAMP/TERT (telomerase reverse transcriptase) s’avère une stratégie prometteuse capable de provoquer des réponses T CD4 prolifératives et des CTL spécifiques de l’Ag tumoral chez des patients atteints d’un cancer de la prostate métastatique [
17] (Tableau II). Cependant, l’utilisation de ces séquences d’adressage au lysosome s’applique uniquement aux ARNm tumoraux déjà identifiés. Afin d’augmenter la présentation d’Ag issus d’ARNm tumoraux totaux dans la voie de présentation restreinte au CMH-II, Y. Zhao et ses collaborateurs ont montré que l’inhibition de l’expression de la chaîne invariante (molécule qui s’échange contre un peptide exogène pour la liaison au CMH-II) avec des oligonucléotides antisens conduit à une meilleure présentation des peptides engendrés en association avec le CMH-II. Les expériences in vivo mettent en évidence un effet anti-tumoral corrélé à des réponses CTL et CD4 prolifératives spécifiques de l’Ag [
18].  | Tableau II.
Récapitulatif des essais cliniques fondés sur l’utilisation des cellules dendritiques transfectées avec de l’ARNm spécifique d’antigène ou avec l’ensemble des ARNm issus d’une tumeur. PSA : prostate-specific antigen ; CEA : carcinoembryonic antigen ; ND : non détecté. |
|
Un espoir dans le contexte de l’immunothérapie anti-VIH Chez l’homme, diverses stratégies de vaccination thérapeutique contre le VIH ont été développées. Mais l’efficacité des vaccins s’avère limitée car le virus a une forte capacité à créer des variants qui diffèrent non seulement d’un individu à l’autre mais encore chez un même patient. Une manière de contourner ce problème consiste à élaborer un vaccin individuel ciblant spécifiquement l’ensemble des variants présents chez chacun des patients. En réactivant la réponse immunitaire contre ces variants individuels, un vaccin dit « autologue », plus efficace car plus spécifique, pourrait alors être en mesure d’induire une immunité protectrice à long terme. Notre groupe a ainsi évalué la capacité de cellules dendritiques électroporées avec des ARNm viraux issus du même patient (autologues) et amplifiés à partir d’échantillons de sang, à induire une réponse immune spécifique. Sur les dix patients étudiés, neuf ont montré des réponses T CD8 prolifératives spécifiques du VIH in vitro. Comparativement, les cellules dendritiques électroporées avec de l’ARNm consensus n’ont induit qu’une réponse anti-virale très faible, ce qui confirme bien l’importance de travailler avec des ARNm viraux autologues. Récemment, D.G. Kavanagh et ses collaborateurs ont transfecté des cellules dendritiques avec des ARNm codant pour la protéine Nef du VIH fusionnée à des signaux permettant le transport de cette protéine vers les compartiments lysosomaux. Bien que la réponse immunitaire décrite dans cette étude ne soit pas dirigée contre tous les variants du virus présents chez le patient, l’avantage de cette approche est qu’elle permet d’obtenir des réponses T à la fois CD8 et CD4 [
19]. Enfin, dans une autre étude, E.R. Van Gulck et ses collaborateurs ont électroporé des cellules dendritiques avec les ARNm codant pour les protéines Gag et Env du VIH amplifiés à partir des formes provirales et plasmatiques du virus [
20]. Cette approche a permis de déclencher des réponses T CD4 et CD8 dirigées contre les différents variants individuels du virus qui se répliquent, mais également contre les formes latentes qui constituent les réservoirs du virus. La combinaison de ces différentes stratégies (ciblage de tous les épitopes autologues, induction d’une réponse à la fois CD4 et CD8 contre les formes latentes et réplicatives du virus) semble donc être l’approche vaccinale la plus pertinente pour stimuler des réponses mémoires protectrices à long terme chez les patients infectés [
21]. |
Manipuler les cellules dendritiques pour améliorer la réponse immunitaire Les résultats obtenus en utilisant les cellules dendritiques transfectées avec de l’ARNm autologue sont très encourageants. Toutefois, de nombreuses équipes tentent actuellement d’explorer les propriétés intrinsèques de ces cellules, à l’aide d’immunomodulateurs ou par modification génétique, afin d’augmenter leur pouvoir immunostimulateur et par conséquent d’amplifier l’efficacité et la persistance de la réponse immunitaire. Pour obtenir une réponse T spécifique optimale, il semble intéressant, par exemple, d’augmenter la durée de vie des cellules dendritiques après leur injection dans l’organisme en surexprimant des protéines anti-apoptotiques telles que Bcl-2 [
22] ou en diminuant l’expression de protéines pro-apoptotiques comme Bak et Bax [
23]. L’inefficacité de certaines cellules dendritiques à stimuler des lymphocytes T spécifiques peut également être à l’origine d’une faible réponse immunitaire. Ce défaut d’activation peut être dû à l’absence de signaux de co-stimulation ou de production de cytokines immunostimulatrices comme l’IL-12. Il est notamment connu que la voie CD40/CD40L est essentielle à l’obtention d’une réponse immunitaire efficace et durable. Les cellules dendritiques qui expriment fortement la molécule CD40 sont activées par le CD40L exprimé à la surface des lymphocytes T activés. Cette interaction induit la maturation des cellules dendritiques ainsi que la production de cytokines par ces cellules (en particulier l’IL-12) leur conférant ainsi un pouvoir immunostimulateur plus élevé [
24]. Cette même interaction est cruciale pour permettre la différenciation des cellules T de cellules naïves ou mémoires en cellules effectrices productrices de cytokines, comme l’a récemment montré M. MacLeod et ses collaborateurs [
25]. La molécule CD40 apparaît donc comme une cible potentielle importante en immunothérapie. Enfin, il a été montré que seule une minorité des cellules dendritiques injectées chez les patients, moins de 1 %, étaient capables de migrer vers les organes lymphoïdes secondaires [
26]. N. Okada et ses collaborateurs ont montré que les cellules dendritiques qui expriment fortement le CCR7 s’accumulent 5 fois plus dans les ganglions lymphatiques drainant le site d’injection [
27]. Ces observations sont essentielles dans la mesure où seules les cellules dendritiques qui auront migré dans les ganglions lymphatiques, zone principale d’interaction avec les lymphocytes T, seront susceptibles de déclencher des réponses immunes efficaces. |
Différents essais cliniques ont désormais apporté la preuve de l’efficacité des cellules dendritiques transfectées avec de l’ARNm à présenter des Ag (tumoraux/viraux) et à induire des réponses cytotoxiques et auxiliaires spécifiques associées dans certains essais à un réel bénéfice clinique. De plus, cette approche vaccinale s’avère une méthode simple, facilement utilisable en clinique : elle permet de stimuler des réponses immunes contre des Ag identifiés et non identifiés, sans restriction au CMH. La possibilité d’administrer à plusieurs reprises ce vaccin chez les patients sans être limité par l’immunité préexistante observée avec les vecteurs viraux recombinants, représente un avantage supplémentaire de cette approche. Enfin, il est envisageable de renforcer l’efficacité de ce type de vaccin en améliorant la génération d’épitopes immunogènes par des stratégies visant à cibler les Ag vers les compartiments lysosomaux ou vers le protéasome (pour une meilleure présentation CMH-II et I respectivement), ou en utilisant des immuno-modulateurs tels que des antagonistes de PD-1 et CTLA-4 ou encore des agonistes de CD40. |
Footnotes |
1. Banchereau J, Brière F, Caux C, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18 : 767–811. 2. Mellman I, Steinman RM. Dendritic cells: specialized and regulated antigen processing machines. Cell 2001; 106 : 255–8. 3. Mempel TR, Henrickson SE, Von Andrian UH. T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature 2004; 427 : 154–9. 4. Caux C, Vanbervliet B, Massacrier C, et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med 1994; 180 : 1841–47. 5. Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998; 392 : 245–52. 6. Sallusto F, Schaerli P, Loetscher P, et al. Rapid and coordinated switch in chemokine receptor expression during dendritic cell maturation. Eur J Immunol 1998; 28 : 2760–9. 7. Lanzavecchia A, Sallusto F. Regulation of T cell immunity by dendritic cells. Cell 2001; 106 : 263–6. 8. Gilboa E, Nair SK, Lyerly HK. Immunotherapy of cancer with dendritic-cell-based vaccines. Cancer Immunol Immunother 1998; 46 : 82–7. 9. Lu W, Arraes LC, Ferreira WT, Andrieu JM. Therapeutic dendritic-cell vaccine for chronic HIV-1 infection. Nat Med 2004; 10 : 1359–65. 10. Banchereau J, Palucka AK, Dhodapkar M, et al. Immune and clinical responses in patients with metastatic melanoma to CD34+ progenitor-derived dendritic cell vaccine. Cancer Res 2001; 61 : 6451–58. 11. Nestle FO, Alijagic S, Gilliet M, et al. Vaccination of melanoma patients with peptide- or tumor lysate-pulsed dendritic cells. Nat Med 1998; 4 : 328–32. 12. Boczkowski D, Nair SK, Snyder D, Gilboa E. Dendritic cells pulsed with RNA are potent antigen-presenting cells in vitro and in vivo. J Exp Med 1996; 184 : 465–72. 13. Heiser A, Coleman D, Dannull J, et al. Autologous dendritic cells transfected with prostate-specific antigen RNA stimulate CTL responses against metastatic prostate tumors. J Clin Invest 2002; 109 : 409–17. 14. Su Z, Dannull J, Heiser A, et al. Immunological and clinical responses in metastatic renal cancer patients vaccinated with tumor RNA-transfected dendritic cells. Cancer Res 2003; 63 : 2127–33. 15. Pardoll DM, Topalian SL. The role of CD4+ T cell responses in antitumor immunity. Curr Opin Immunol 1998; 5 : 588–94. 16. Nair SK, Boczkowski D, Morse M, et al. Induction of primary carcinoembryonic antigen (CEA)-specific cytotoxic T lymphocytes in vitro using human dendritic cells transfected with RNA. Nat Biotechnol 1998; 16 : 364–9. 17. Su Z, Dannull J, Yang BK, et al. Telomerase mRNA-transfected dendritic cells stimulate antigen-specific CD8+ and CD4+ T cell responses in patients with metastatic prostate cancer. J Immunol 2005; 174 : 3798–807. 18. Zhao Y, Boczkowski D, Nair SK, Gilboa E. Inhibition of invariant chain expression in dendritic cells presenting endogenous antigens stimulates CD4+ T-cell responses and tumor immunity. Blood. 2003; 102 : 4137–42. 19. Kavanagh DG, Kaufmann DE, Sunderji S, et al. Expansion of HIV-specific CD4+ and CD8+ T cells by dendritic cells transfected with mRNA encoding cytoplasm- or lysosome-targeted Nef. Blood 2006; 107 : 1963–9. 20. Van Gulck ER, Ponsaerts P, Heyndrickx L, et al. Efficient stimulation of HIV-1-specific T cells using dendritic cells electroporated with mRNA encoding autologous HIV-1 Gag and Env proteins. Blood 2006; 107 : 1818–27. 21. Janssen EM, Lemmens EE, Wolfe T, et al. CD4+ T cells are required for secondary expansion and memory in CD8+ T lymphocytes. Nature 2003; 421 : 852–6. 22. Nopora A, Brocker T. Bcl-2 controls dendritic cell longevity in vivo. J Immunol 2002; 169 : 3006–14. 23. Peng S, Kim TW, Lee JH, et al. Vaccination with dendritic cells transfected with BAK and BAX siRNA enhances antigen-specific immune responses by prolonging dendritic cell life. Hum Gen Ther 2005; 16 : 584–93. 24. Cella M, Scheidegger D, Palmer-Lehmann K, et al. Ligation of CD40 on dendritic cells triggers production of high levels of interleukin-12 and enhances T cell stimulatory capacity: T-T help via APC activation. J Exp Med 1996; 184 : 747–52. 25. Macleod M, Kwakkenbos MJ, Crawford A, et al. CD4 memory T cells survive and proliferate but fail to differentiate in the absence of CD40. J Exp Med 2006; 203 : 897–906. 26. Morse MA, Coleman RE, Akabani G, et al. Migration of human dendritic cells after injection in patients with metastatic malignancies. Cancer Res 1999; 59 : 56–8. 27. Okada N, Mori N, Koretomo R, et al. Augmentation of the migratory ability of DC-based vaccine into regional lymph nodes by efficient CCR7 gene transduction. Gene Ther 2005; 12 : 129–39. 28. Caruso DA, Orme LM, Neale AM, et al. Results of a phase 1 study utilizing monocyte-derived dendritic cells pulsed with tumor RNA in children and young adults with brain cancer. Neuro Oncol 2004; 6 : 236–46. 29. Caruso DA, Orme LM, Amor GM, et al. Results of a phase I study utilizing monocyte-derived dendritic cells pulsed with tumor RNA in children with Stage 4 neuroblastoma. Cancer 2005; 103 : 1280–91. 30. Morse MA, Nair SK, Mosca PJ, et al. Immunotherapy with autologous human dendritic cells transfected with carcinoembryonic antigen mRNA. Cancer Invest 2003; 21 : 341–9. |