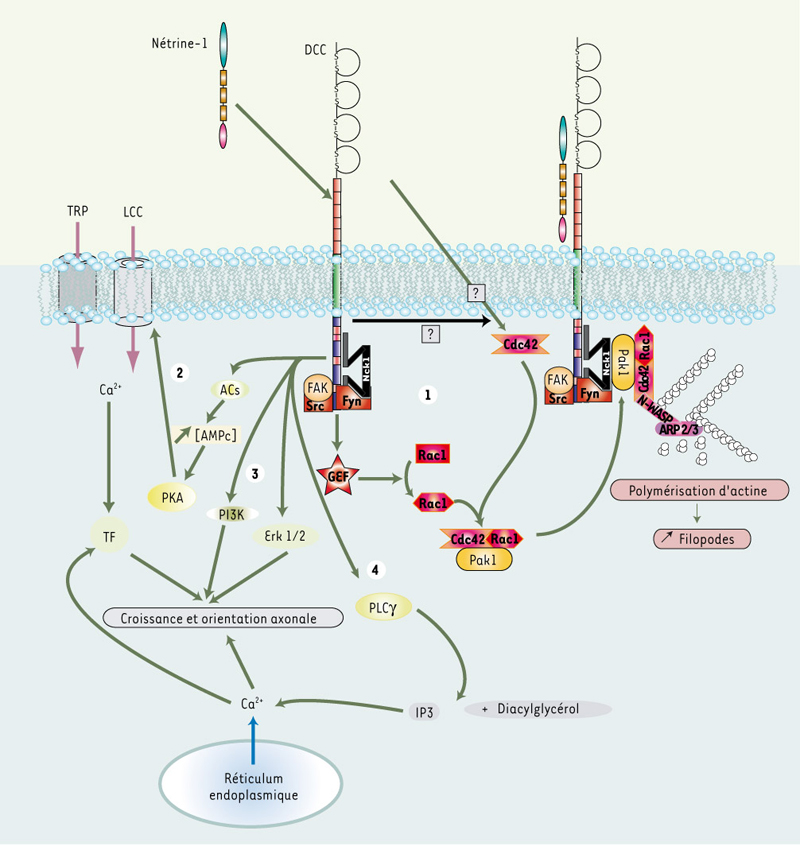
En 2001, une publication « scandaleuse » paraissait : Christine Holt et al. [
17] osaient prétendre que : (1) le cône de croissance pouvait répondre à la nétrine-1 indépendamment du corps cellulaire, et (2) la traduction au niveau du cône de croissance pouvait être un régulateur clé de la réponse à la nétrine-1. Trois ans après ce crime de lèse-majesté, l’importance de la traduction dans le cône de croissance a été plusieurs fois confirmée et deux publications viennent encore conforter cette notion. Clairement, la nétrine-1 est impliquée dans la régulation de la traduction et de la dégradation protéique [17] puisque l’inhibition d’un de ces deux processus conduit à une absence de réponse du cône de croissance mis en présence de nétrine-1. Ainsi, la nétrine-1 activerait la PI3K (phosphoinositide-OH-3 kinase) qui, via une cascade de phosphorylation, libère eIF-4E, un facteur d’initiation de la traduction qui permet le recrutement du complexe ribosomique sur l’ARNm.
Plus récemment, Leung et al. [
7] ont montré que la nétrine-1 participe au transport, vers le cône de croissance, du transcrit de la β-actine qui est essentielle à la mobilité du cône de croissance (Figure 2). En effet, une étude sur des cônes de croissance d’axones de xénope montre que le transcrit de la β-actine est associé constitutivement, via sa région 3’ non transcrite (3’ UTR), à la protéine Vg1RBP (Vg1 RNA binding protein). Cette protéine est connue pour être impliquée dans le transport du transcrit de β-actine dans des fibroblastes en migration. De plus, l’analyse de la dynamique des granules (transcrit de β-actine/Vg1RBP) indique qu’en présence de nétrine-1, les granules se localisent au niveau des filopodes suggérant ainsi que la nétrine-1 induit un mouvement des granules dans le cône de croissances vers les filopodes par lesquels arrivent les signaux extracellulaires. Par ailleurs, en présence de nétrine-1, l’ARNm de β-actine est traduit localement dans le cône de croissance puisqu’un inhibiteur de la traduction protéique empêche l’augmentation de β-actine associée à la présence de nétrine-1. De plus, il semble que l’effet de la nétrine-1 sur la traduction de β-actine est contrôlé par DCC car la présence d’un anticorps bloquant dirigé contre DCC inhibe la traduction de β-actine. Cette régulation de la traduction de β-actine par la nétrine-1 est réalisée via l’extrémité 3’UTR du transcrit de β-actine.
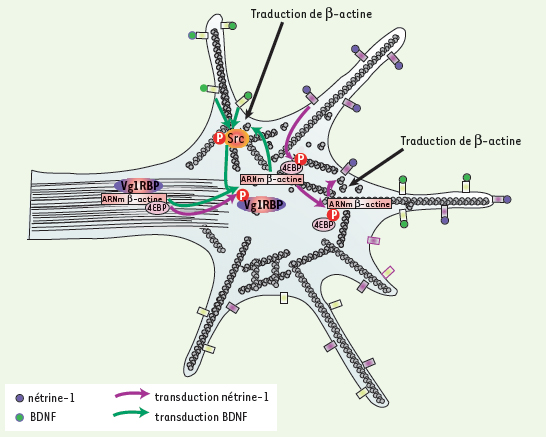
 | Figure 2.
Modèle de la traduction polarisée sur le cône de croissance en présence de deux molécules chimiotropiques : la nétrine-1 et le BDNF.
Voie violette : La fixation de la nétrine-1 sur DCC conduit à la localisation asymétrique des granules sur le cône de croissance du côté de la source de nétrine-1. Cette localisation des granules est associée à la phosphorylation asymétrique du facteur inhibiteur de la traduction 4EBP permettant la traduction polarisée du transcrit de la β-actine. Voie verte : l’arrivée du BDNF sur les récepteurs Trk conduit aussi à la localisation asymétrique de Vg1RBP-transcrit de β-actine sur le cône de croissance et à l’activation asymétrique de la protéine src. La protéine src phosphorylée va pouvoir à son tour phosphoryler Vg1RBP libérant ainsi le transcrit de d-actine qui va pouvoir être traduit de façon polarisée sur le cône de croissance. |
Ces résultats suggèrent donc que la nétrine-1 induit la translocation des granules à proximité du site de réception du signal et pourrait être à l’origine d’un transport polarisé des granules. Par conséquent, Leung et al. ont analysé la localisation des granules dans le cône de croissance en présence d’un gradient de nétrine-1. Ils ont effectivement mis en évidence un transport polarisé des granules dans le cône de croissance vers la source de nétrine-1. De plus, en présence d’un gradient de nétrine-1, il y a aussi une distribution asymétrique de la forme phosphorylée (4EBP-P) de 4EBP qui se localise du côté de la source de nétrine-1. 4EBP-P initie la traduction, et la phosphorylation de cette protéine semble dépendre de la protéine kinase TOR (target of rapamycin) puisqu’un inhibiteur de TOR prévient l’asymétrie du facteur 4EBP-P dans le cône de croissance.
Par conséquent, la localisation asymétrique dans le cône de croissance des granules et de 4EBP-P du côté de la source de nétrine-1 suggère une production asymétrique de β-actine, que confirme l’analyse de la synthèse de β-actine en présence d’un gradient de nétrine-1. Par ailleurs, l’inhibition de la synthèse de β-actine dans le cône de croissance prévient l’attraction du cône de croissance mais ni sa répulsion, ni la croissance axonale, suggérant ainsi que le transport des granules et la traduction asymétrique de β-actine jouent un rôle majeur, mais spécifique, dans la réponse attractive de la nétrine-1.
Ces résultats tout à fait intéressants sur l’effet de la nétrine-1 sur la traduction asymétrique de messagers spécifiques ont été renforcés par l’étude de Yao et al. [8]. Ces auteurs ont utilisé comme modèle un système artificiel d’analyse du guidage axonal, induit par l’activation d’un couple ligand/récepteur à activité tyrosine kinase BDNF (brain derived neurotrophic factor)/récepteur Trk. Leurs résultats sont tout à fait similaires à ceux de Leung et al.
(Figure 2). Les activités attractive et répulsive relayées par le BDNF requièrent la présence de Ca2+ et une synthèse protéique puisqu’en présence d’un gradient de BDNF, l’inhibition de la synthèse protéique abolit la réponse du cône de croissance. De plus, une augmentation locale de Ca2+ associée à des inhibiteurs de la synthèse protéique atténue l’attraction du cône de croissance habituellement observée, plaçant l’intervention de la synthèse protéique en aval des récepteurs Trk et de la signalisation du Ca2+. Tout comme le montraient Leung et al., en présence de BDNF, la protéine Vg1RBP colocalise avec le transcrit de β-actine, alors qu’en son absence cette colocalisation est faible suggérant que, comme le faisait la nétrine, le BDNF favorise la localisation du transcrit de β-actine au niveau du cône de croissance via l’interaction de l’ARNm avec Vg1RBP. De plus, une stimulation localisée par du BDNF sur le cône de croissance conduit à l’augmentation de la colocalisation de la protéine Vg1RBP et du transcrit de β-actine à proximité de la source de BDNF.
L’inhibition de l’interaction entre Vg1RBP et le transcrit de β-actine en présence d’oligonucléotides antisens capables d’interférer avec la liaison Vg1RBP-transcrit de β-actine, bloque à la fois l’attraction et la répulsion relayées par le BDNF et par le Ca2+, suggérant que l’interaction entre Vg1RBP et le transcrit de β-actine est nécessaire lors d’une réponse attractive ou répulsive du cône de croissance. Les auteurs ont ensuite analysé la localisation sur le cône de croissance de la protéine β-actine. En présence d’un gradient de BDNF, l’attraction du cône de croissance conduit à une distribution asymétrique de la production de β-actine impliquant Vg1RBP, le Ca2+ et les protéines de la famille des src. En outre, une telle distribution asymétrique de β-actine est également retrouvée lors de la répulsion du cône de croissance induite par le BDNF en présence d’un inhibiteur de la PKA, mais dans ce cas, elle est inversée. En effet, la β-actine se concentre du côté opposé à la source de BDNF lorsque la PKA est inhibée. Une diminution locale de la synthèse de β-actine associée à l’inhibition de la PKA pourrait ainsi être à l’origine de l’asymétrie inverse associée à la répulsion.
Par ailleurs, on sait que la phosphorylation de Vg1RBP, contrôlée par la kinase src régule la traduction du transcrit de β-actine via la levée de l’inhibition de la traduction de β-actine. Or, le BDNF module l’activité des protéine kinases src. Yao et al. ont alors mis en évidence une distribution asymétrique de la phosphorylation de src du côté de la source de BDNF lorsqu’il y a attraction du cône de croissance, mais du côté opposé à la source de BDNF lorsqu’il y a répulsion du cône de croissance, suggérant l’implication de P-src dans la régulation de la traduction de β-actine.
Ces deux articles montrent donc que les molécules chimiotropiques induisent un transport et une traduction asymétriques de β-actine par les protéines de la famille Vg1RBP dans le cône de croissance qui pourraient être à l’origine d’un remaniement du cytosquelette du cône de croissance favorisant ainsi l’orientation des lamellipodes et des filopodes en direction de la source de facteur chimiotropique. Néanmoins, pour Leung et al., la régulation de la traduction de β-actine par la nétrine-1 passerait par la régulation du facteur 4EBP, alors que, pour Yao et al., la régulation de la traduction de β-actine par le BDNF passerait par le Ca2+ et l’activité src. À ce jour, cependant, un lien entre Src, nétrine-1 et β-actine n’a pas été démontré, même s’il est intéressant de noter que la nétrine-1 active fyn, une protéine de la famille des src. Même si ces deux articles semblent diverger quant au rôle de la β-actine, qui, pour l’un agirait uniquement dans l’attraction, pour l’autre à la fois dans l’attraction et la répulsion, ils offrent une nouvelle perception des signaux de guidage du cône de croissance. Jusqu’ici notre vision, sans doute simpliste, relevait de la classique vision de la transduction du signal, activation en cascade de seconds messagers, de kinases et autre GTPases dans laquelle la traduction protéique ne représentait que l’usine à produire les composants du cône de croissance. Aujourd’hui, notre vision doit considérer ce signal de guidage comme un signal intégrant la « régionalisation » - donc l’asymétrie possible - de la traduction locale de protéines spécifiques comme un élément clé du système.