Pendant le développement embryonnaire, la croissance des vaisseaux sanguins, ou angiogenèse, s’opère suivant un contrôle précis. Insuffisante, ou au contraire excessive, l’angiogenèse perturbera la circulation et souvent entraînera la mort des embryons.
Parmi les molécules régulatrices de l’angiogenèse, la mieux étudiée est un facteur de croissance pro-angiogénique, le VEGF (vascular endothelial growth factor). Le VEGF est fortement exprimé par les tissus en hypoxie, qui recrutent de nouveaux vaisseaux à partir des territoires environnants pour assurer leurs besoins en oxygène et nutriments. Plus la vascularisation des tissus, et donc leur oxygénation, se développe, plus l’expression du VEGF diminue. Cet élégant mécanisme de rétrocontrôle négatif est une clef de la régulation de la croissance des vaisseaux. Toutefois, les vaisseaux exposés à de fortes concentrations de VEGF ne bourgeonneront pas tous. La réponse vasculaire au VEGF est affinée par d’autres mécanismes régulateurs. Sept articles récemment publiés dans Nature, Development et Proc Natl Acad Sci USA révèlent le rôle d’un autre partenaire, Delta-like 4 (Dll4), un ligand de Notch, dans la restriction de la réponse des vaisseaux au VEGF [ 1– 7].
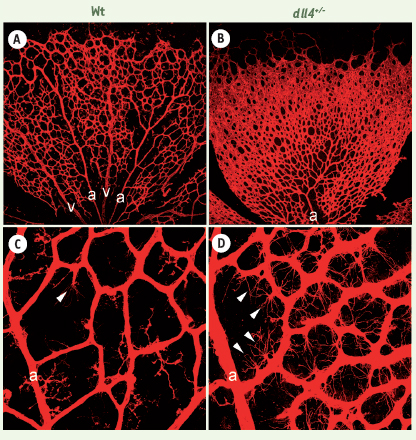
La famille des récepteurs transmembranaires Notch et celles de leurs ligands jouent un rôle essentiel dans les phénomènes de spécification et de différenciation, pour de multiples types cellulaires, lors du développement embryonnaire [ 8, 9]. Parmi les molécules intervenant dans la voie Notch impliquées dans le développement vasculaire, le ligand Dll4 a suscité un intérêt particulier puisqu’il est spécifique des artères et capillaires en bourgeonnement. Les sept nouvelles études, dont la nôtre, ont examiné la contribution de Dll4/Notch à l’angiogenèse embryonnaire et pathologique. Les divers modèles expérimentaux utilisés démontrent que l’absence de la signalisation Dll4/Notch, soit par ablation génétique, inhibition pharmacologique, ou administration d’anticorps antagonistes, provoque une angiogenèse excessive par bourgeonnement vasculaire. Notre étude, par exemple, montre que l’ablation d’un seul allèle dll4 chez la souris accroît de façon spectaculaire le bourgeonnement et le branchement vasculaires au sein de la rétine (Figure 1).
| Figure 1.
Augmentation du branchement des vaisseaux de la rétine et de la formation de tip cells après délétion d’un allèle dll4. A. Réseau vasculaire normal avec alternance d’artères et de veines connectées par des capillaires. B. Les vaisseaux dll4
+/- montrent un branchement excessif et une fusion excessive du réseau vasculaire. À plus fort grossissement (C, D) les vaisseaux dll4
+/-
(D) présentent plus de tip cells, chacune étant à l’origine d’un nouveau point de branchement. a : artères ; v : veines ; les têtes de flèches montrent quelques tip cells dans chaque image. |
Par quels mécanismes cellulaires et moléculaires naît cette profusion de vaisseaux ? La microscopie à haute résolution a permis d’observer un grand nombre de tip cells endothéliales un peu partout dans le plexus vasculaire des rétines dll4+/- . Les tip cells sont situées à l’extrémité des capillaires en bourgeonnement. Ce sont des cellules dotées de nombreuses extensions filopodiales qui fonctionnent comme des senseurs de l’environnement et guident la croissance des vaisseaux. Cette augmentation significative des tip cells chez les animaux dll4+/- indique que, dans les conditions normales, leur formation est inhibée par une signalisation impliquant Dll4. En bloquant avec un inhibiteur pharmacologique spécifique la voie de signalisation Notch activée par la fixation de Dll4 à son récepteur, nous avons par ailleurs observé un phénotype similaire à celui du mutant dll4+/- , ce qui montre que Notch est l’intermédiaire par lequel Dll4 agit dans ces vaisseaux.
Comment une déficience dans la signalisation de la voie Notch peut-elle entraîner une profusion vasculaire ? Le VEGF est, comme nous l’avons vu précédemment, nécessaire au développement des vaisseaux dans la rétine. Nous avons pensé que la réponse des vaisseaux à ce signal VEGF pouvait être modulée par la voie Dll4/Notch. Le niveau d’expression du VEGF n’étant pas modifié chez les animaux déficients en Dll4, nous avons examiné une possible altération de la présentation des récepteurs au VEGF, VEGFR1 et VEGFR2. L’expression du VEGFR2 (KDR/FLK-1), qui relaie les effets pro-angiogéniques du VEGF, est augmentée chez les mutants dll4+/- . En revanche, celle de VEGFR1 (FLT1 - fms-related tyrosine kinase 1), qui est un régulateur négatif du VEGF, est réduite. L’absence de Dll4 semble donc entraîner une dérégulation de la balance d’expression des récepteurs au VEGF, avec pour effet ultime une réponse accrue au VEGF.
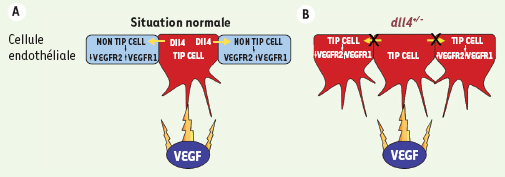
Le VEGF et les voies de signalisation Notch sont encore plus étroitement liés. En inhibant la signalisation du VEGF dans la rétine, nous avons observé une diminution de l’expression de dll4 dans les tip cells. L’expression de Dll4 est donc dépendante de celle du VEGF qui agit, in vivo, en amont de Dll4. Le VEGF induit l’expression de Dll4, qui à son tour agit pour limiter la réponse du VEGF, se comportant comme un frein intrinsèque de l’angiogenèse, nécessaire au contrôle affiné de la croissance vasculaire (Figure 2).
| Figure 2.
Modèle proposé pour le mécanisme d’action de Dll4/Notch. En situation normale (A), le VEGF provoque l’acquisition par une cellule endothéliale (CE) d’un phénotype de tip cell ce qui se traduit par l’émergence d’un bourgeonnement capillaire. Le VEGF induit également l’expression de dll4. En se liant à son récepteur Notch présent sur la CE adjacente, Dll4 inhibera la formation d’une autre tip cell en induisant une altération du taux d’expression des récepteurs au VEGF, rendant la cellule moins sensible au VEGF. Les vaisseaux dll4
+/-
(B) sont incapables de transmettre le signal inhibiteur et le nombre de CE qui répondent de façon inapproprié au VEGF et deviennent des tip cells augmente. Il en résulte un branchement et une fusion excessifs de ces vaisseaux. |
Une angiogenèse inopportune accompagne certaines pathologies, notamment la croissance de tumeurs solides. Ces découvertes sur la boucle de régulation VEGF/Dll4-Notch ont donc un intérêt thérapeutique potentiel dans le traitement de ces angiogenèses pathologiques. Des anticorps bloquant la signalisation Dll4 ont ainsi été développés, indépendamment, par deux sociétés de biotechnologies américaines [ 6, 7].
Dans des modèles de xénogreffes tumorales humaines chez la souris, l’administration d’anticorps anti-Dll4 provoque une augmentation spectaculaire de l’angiogenèse tumorale avec, de manière paradoxale en apparence, une réduction de la taille des tumeurs. Les nombreux nouveaux vaisseaux sont en fait hérissés de tip cells, et deviennent non fonctionnels, incapables d’assurer la circulation sanguine et la croissance tumorale qui en dépend. Il faut souligner que ce blocage de Dll4 s’est avéré efficace dans le traitement de tumeurs résistantes à des thérapies anti-VEGF. Avec la mise au point d’anticorps humanisés anti-Dll4, les thérapies anti-angiogéniques pourraient donc prochainement s’enrichir d’un nouvel outil élargissant leur spectre d’application.