Les lymphocytes T se développent dans le thymus à partir de précurseurs lymphoïdes originaires de la moelle osseuse. À l’issue de phénomènes développementaux complexes, deux grands types de lymphocytes T sont produits, se distinguant par l’expression membranaire d’un récepteur antigénique (TCR) composé de chaînes α/β ou γ/δ [ 1]. Cette différence structurelle se double d’une diversité fonctionnelle dont l’ampleur est encore imparfaitement cernée. En parallèle, les mécanismes moléculaires qui dirigent les précurseurs vers un lignage plutôt qu’un autre demeurent énigmatiques. Une étude récente identifiant un facteur de transcription (FT) nécessaire au développement des cellules Tγδ vient faire évoluer cette problématique [ 2].
Le développement des cellules thymiques peut être suivi via l’expression de marqueurs de surface tels que CD4 et CD8. Aux stades immatures précoces CD4-CD8- (abrégés DN pour double negative), les gènes TCRγ, δ et β font l’objet de recombinaisons V(D)J1 qui, éventuellement, conduisent à l’expression de complexes protéiques TCRγδ ou pré-TCR (ce dernier associant une chaîne β à la protéine invariante pTα). Ces complexes assurent le développement T vers, respectivement, les cellules Tγδ ou un stade ultérieur de maturation dans la voie αβ. Dans ce second cas, les cellules prolifèrent de façon intensive avant d’atteindre le stade CD4+CD8+ (DP, double positive), de débuter les réarrangements TCRα et, enfin, de se doter de récepteurs TCRαβ. Suivent alors des processus de sélection d’affinité du TCR, présidant à l’émergence de cellules Tαβ fonctionnelles CD4+ ou CD8+ (stades de thymocyte SP ou single positive) puis de lymphocyte T matures.
D’emblée, deux modèles se sont opposés pour expliquer le choix développemental Tγδ ou Tαβ par les thymocytes DN [1, 3]. Le modèle instructif proposait que l’issue des recombinaisons TCR en termes d’expression de complexes fonctionnels TCRγδ ou pré-TCR détermine à elle seule la bifurcation entre ces lignées. Au contraire, le modèle stochastique envisageait un choix aléatoire, antérieur et indifférent aux événements moléculaires régissant l’expression des produits TCR. Un modèle instructif « pur » est vite apparu improbable dans la mesure où des précurseurs exprimant un TCRγδ ou αβ parviennent, dans certaines conditions, à se différencier en cellules de phénotype opposé. Il reste que la différence d’intensité des signaux intracellulaires induits par les complexes TCRγδ ou pré-TCR influence, au moins en partie, le devenir des précurseurs [ 4, 5]. Par ailleurs, la voie de signalisation Notch, généralement impliquée dans les choix binaires d’engagement cellulaire, semble renforcer globalement le développement Tαβ [ 6– 8]. Au final, le choix définitif entre développement Tαβ versus Tγδ dépendrait donc de la synergie entre signaux TCR et Notch.
Peut-on, dans ces conditions, envisager une orientation initiale plus précoce ? L’article référencé [2] montre que, dans les lignées lymphoïdes, l’expression d’un FT de la famille HMG (high mobility group), Sox13, est restreinte aux populations DN les plus précoces (désignées DN1 et DN2) et aux cellules Tγδ, faisant de ce facteur un acteur potentiel dans le contrôle décisionnel d’engagement vers cette lignée. Effectivement, des souris transgéniques qui surexpriment Sox13 dans les cellules T présentent un défaut partiel de différenciation Tαβ alors que le développement Tγδ est normal. De façon significative, le profil d’expression obtenu à partir de cellules DP présentes chez les souris transgéniques Sox13 évoque celui caractéristique des cellules Tγδ. À l’inverse, la délétion génique (knockout) de Sox13 induit une diminution dose-dépendante du nombre de cellules Tγδ , sans affecter celui des Tαβ. Enfin, Sox13 paraît inhiber l’activité transcriptionnelle d’un autre FT de la famille HMG, TCF1, cible du signal Wnt/β-caténine qui permet notamment la transition cellulaire DN→DP [ 9]. Ainsi, Sox13 agirait en tant qu’antagoniste du développement cellulaire dans la voie Tαβ.
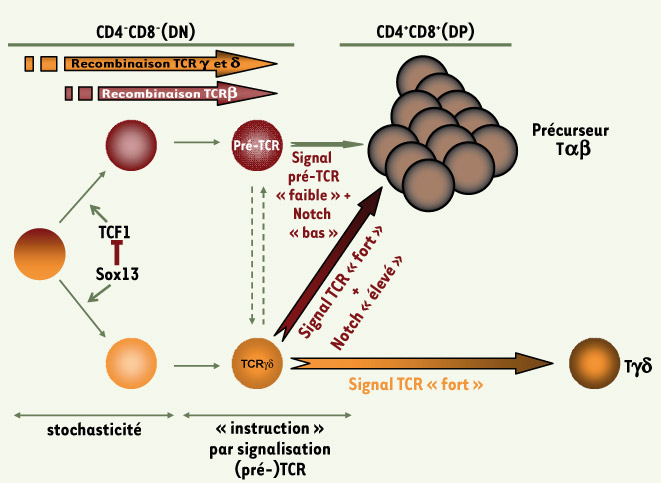
Il est établi que les précurseurs DN2 ont un potentiel développemental γδ ou αβ hétérogène [6, 7, 10]. Dans ce contexte, l’expression différentielle de Sox13 dans ce compartiment (un peu moins de 50 % des cellules DN2 expriment ce facteur) et ses propriétés inductrices Tγδ donnent, pour la première fois, une assise moléculaire au processus d’engagement aléatoire vers l’une ou l’autre des deux lignées. Il est ainsi maintenant justifié d’envisager une étape initiale de choix aléatoire entre voies αβ et γδ, antérieure aux recombinaisons TCR et impliquant Sox13. Ultérieurement, les signaux issus des complexes TCR ou pré-TCR, et/ou ceux convoyés par la voie Notch, viendraient renforcer ou invalider ce premier choix (Figure 1). Dans ce contexte, il est frappant de constater que le nombre de cellules Tαδ n’est pas augmenté chez les souris transgéniques Sox13 ; et que la population Tγδ n’a pas totalement disparu chez les animaux Sox13-déficients. Vraisemblablement, des facteurs supplémentaires entrent en jeu dans le contrôle homéostatique des cellules Tγδ. L’objectif dans le domaine est de cataloguer l’ensemble de ces facteurs et, au-delà, de décrypter le(s) réseau(x) de régulation génique sous jacent(s). L’identification des gènes cibles (directs et indirects) de Sox13 intervenant lors du développement des cellules T serait une première étape dans ce sens.
| Figure 1.
Différents modèles du choix entre les voies αβ et γδ. Les précurseurs T DN sont pré-engagés dans l’une ou l’autre des deux voies de façon indépendante des réarrangements et de l’expression des TCR. L’expression aléatoire (stochastique) de Sox13 jouerait un rôle important à ce stade, par exemple en inhibant dans certaines cellules l’activité de TCF1, favorisant ainsi la voie γδ. Ensuite, le signal TCRγδ (ou, occasionnellement, TCRαβ), généralement fort, dirige les cellules vers la voie γδ. Le signal pré-TCR, généralement plus faible, les oriente vers la voie αβ. Le niveau de signalisation Notch, en synergie avec les signaux TCR, module éventuellement ce choix (un niveau faible de Notch confirme l’engagement dans la voie αβ ; un niveau élevé pourrait rediriger vers la voie αβ des cellules exprimant un TCRγδ). |
À l’avenir, il est probable que l’expression de Sox13 soit utilisée comme une marque d’engagement dans la voie γδ. Disposer ainsi d’un nouveau marqueur moléculaire d’une étape précoce (et essentielle) du développement T pourrait permettre de mieux comprendre comment l’expression d’un FT détermine des choix développementaux distincts à partir de précurseurs communs. Au-delà d’avancées fondamentales, il est également permis d’espérer des retombées pratiques, en ce qui concerne notamment la reconstitution clinique des fonctions immunitaires.