| |
| Med Sci (Paris). 2007 August; 23(8-9): 707–709. Published online 2007 August 15. doi: 10.1051/medsci/20072389707.Un nouveau mécanisme de détection des infections par le système immunitaire inné des animaux Dominique Ferrandon,*1 Marie Gottar,2 and Vanessa Gobert3 1Équipe labellisée, Fondation Recherche Médicale, UPR 9022 CNRS, 15, rue René Descartes, 67084 Strasbourg, France 2Novartis Institutes for Biomedical Research, Autoimmunity and Transplantation, Postfach, CH-4002 Bâle, Suisse 3UMR 5547 CNRS et Université Paul Sabatier, Bâtiment 4R3b3, 118, route de Narbonne, 31062 Toulouse, France MeSH keywords: Animaux, Drosophila, Bactéries à Gram positif, Infections bactériennes à Gram positif, Humains, Système immunitaire, Infection, Modèles animaux |
La détection des infections est une étape primordiale de la réponse immunitaire. Longtemps considérés comme l’apanage de la réponse adaptative, les phénomènes de reconnaissance du « non-soi potentiellement pathogène » sont apparus, à la lumière des travaux de ces quinze dernières années, comme étant une propriété fondamentale de l’immunité innée [
1]. La reconnaissance des micro-organismes se fait par l’intermédiaire d’une catégorie de récepteurs, les patterns recognitions receptors (PRR), qui ont été sélectionnés au cours de l’évolution en raison de leur capacité à reconnaître des composés d’origine microbienne relativement invariants, car essentiels au mode de vie des microorganismes. Il s’agit par exemple des constituants de leur paroi comme le lipopolysaccharide (LPS) des bactéries à Gram-négatif, les peptidoglycanes bactériens, ou les β-glucanes des champignons. Les plus célèbres PRR des vertébrés appartiennent à la famille des Toll-like receptors (TLR), par exemple TLR4 qui est requis pour l’activation de la réponse immunitaire par le LPS. |
Le système immunitaire inné de la drosophile Comme c’est le cas pour l’immense majorité des êtres vivants, la réponse immunitaire de la mouche du vinaigre Drosophila melanogaster repose exclusivement sur l’immunité innée [
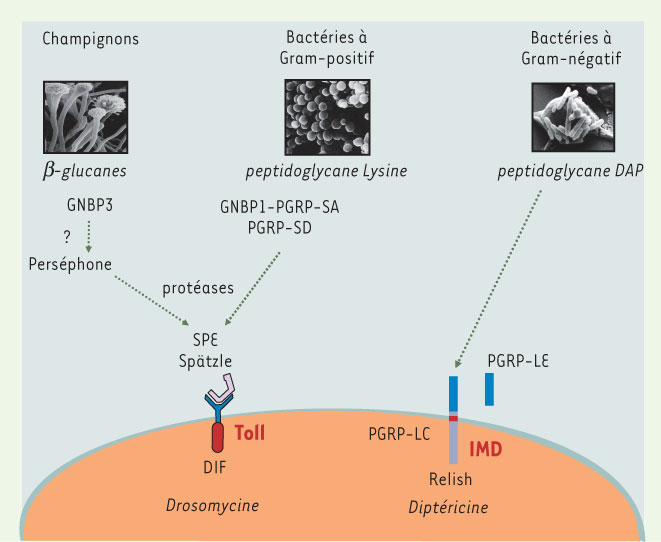
2]. Il est vraisemblable que le dernier ancêtre commun à la drosophile et l’homme vivait déjà, il y a près de 750 millions d’années, dans un milieu dominé par les microbes, et à ce titre devait être capable de se défendre contre les infections. Cette origine ancestrale du système immunitaire inné se retrouve dans le rôle essentiel et conservé que jouent dans la réponse immunitaire les voies de transduction intracellulaire de type NF-κB, chez la drosophile comme chez l’homme. Chez l’insecte, les deux voies IMD (immune deficiency) et Toll assurent d’une part la défense humorale contre les bactéries à Gram (−), et d’autre part celle contre les infections fongiques ou contre certains germes à Gram (+). Ces voies agissent essentiellement dans le corps gras, équivalent fonctionnel du foie, et contrôlent l’expression de centaines de gènes. L’activation de l’une ou l’autre de ces voies aboutit ainsi à la production de peptides antimicrobiens sécrétés dans l’hémolymphe (sang) des mouches. Ainsi, la production de la Drosomycine, un puissant peptide antifongique, dépend de l’activation de la voie Toll tandis que celle de la Diptéricine, un peptide antibactérien, est sous le contrôle de la voie IMD. En réponse à une blessure septique, la voie de défense appropriée est activée selon la nature de l’agresseur microbien [2]. Comment la drosophile est-elle capable de discriminer entre les différentes classes de microorganismes ? En ce qui concerne la distinction entre bactéries à Gram (+) et Gram (−), il s’est avéré que des protéines de la famille des PGRP (peptidoglycan recognition proteins) jouent un rôle fondamental de PRR dans l’activation de la réponse immunitaire systémique. Tandis que PGRP-LC et PGRP-LE reconnaissent préférentiellement un type de peptidoglycane contenant l’acide diaminopimélique, présent dans les bactéries à Gram (−) et certaines souches à Gram (+), PGRP-SA et, dans une moindre mesure, PGRP-SD sont requis pour la détection du peptidoglycane de type lysine, présent chez de nombreuses bactéries pathogènes à Gram (+) [
3–
6] (Figure 1).  | Figure 1.
Reconnaissance des infections microbiennes par les récepteurs de type PRR. Le peptidoglycane est un composé de la paroi des bactéries qui se décline en de nombreuses variétés. Il s’agit de chaînes sucrées reliées entre elles par des ponts peptidiques. L’identité du troisième acide aminé de ces ponts, généralement une lysine ou l’acide diaminopimélique (DAP) est un déterminant structural reconnu par les récepteurs PGRP chez les invertébrés, et les récepteurs intracellulaires de la famille NOD chez les mammifères. La reconnaissance du peptidoglycane des bactéries à Gram-négatif (et de certaines bactéries à Gram-positif contenant le même type de peptidoglycane) se fait essentiellement par l’intermédiaire du récepteur membranaire PGRP-LC au niveau de la cellule du corps gras, la protéine sécrétée PGRP-LE augmentant l’affinité pour des petits fragments de peptidoglycane. L’activation de ce récepteur déclenche la signalisation intracellulaire IMD qui aboutit à la translocation nucléaire de Relish, un facteur de transcription de la famille NF-κB. L’activation de Spätzle, ligand du récepteur Toll, se fait par l’intermédiaire de cascades protéolytiques suite à la reconnaissance de glucanes des champignons ou de peptidoglycane de type lysine. Le mutant Perséphone est sensible aux infections par des champignons entomopathogènes et résistant vis-à-vis des infections bactériennes alors que les mutants GNBP1 ou PGRP-SA présentent un phénotype complémentaire de susceptibilité à certaines infections bactériennes à Gram (+) et de résistance aux infections fongiques. La spätzle processing enzyme (SPE) est le point de convergence de ces cascades protéolytiques. La localisation nucléaire du facteur de transcription DIF est régulée par la voie Toll et aboutit à l’expression de la Drosomycine et de nombreux autres gènes. |
Alors que PGRP-LC est le récepteur membranaire de la voie IMD, Toll est le récepteur membranaire de la voie qui porte son nom et à l’origine de la dénomination TLR pour les vertébrés. Toll lui-même n’est cependant pas un PRR, mais un récepteur activé par une cytokine de la famille du NGF (nerve growth factor), Spätzle. La cytokine proSpätzle ne devient un ligand actif de Toll qu’à la suite d’une étape protéolytique de maturation qui est l’aboutissement de l’activation de cascades de protéases, dont l’une est activée par un complexe PGRP-SA/GNBP1/peptidoglycane de type lysine circulant dans l’hémolymphe de l’insecte [
7]. La reconnaissance de ces bactéries s’effectue donc en amont du récepteur Toll qui est activé de manière indirecte. GNBP1 est un membre divergent d’une autre famille de PRR, les Gram negative binding proteins/ßGlucan recognition proteins, caractérisée par la présence de deux domaines d’interaction avec les β(1,3)glucanes. GNBP1 permettrait de présenter le peptidoglycane à PGRP-SA et aussi d’activer la cascade de protéases. |
Réponses de la drosophile aux entomopathogènes L’activation de la voie Toll par un champignon entomopathogène, Beauveria bassiana
1, requiert une cascade protéolytique distincte dont la protéase Perséphone est l’un des éléments [
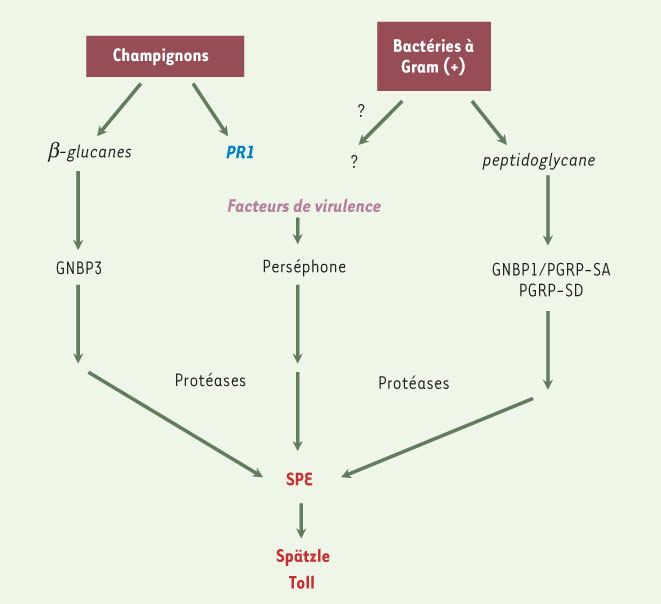
8]. Nous avons tenté de déterminer l’identité du PRR activant cette cascade Perséphone. Parce qu’il est le membre de la famille le mieux conservé chez les insectes, GNBP3 était un bon candidat pour un PRR des champignons. Effectivement, une fois une mutation du gène correspondant obtenue, nous avons observé que le mutant GNBP3 succombait aux infections par une levure pathogène des humains, Candida albicans et que la voie Toll n’était pas activée par cette levure (absence d’induction de la Drosomycine) [
9]. Nous avons alors établi que la protéine GNBP3 recombinante était capable de se lier directement aux levures et aux β(1,3) glucanes. La surexpression du gène entraînait l’activation de la voie Toll en l’absence d’infection et nécessitait Spätzle. Ces expériences indiquaient que GNBP3 est effectivement un PRR des champignons. Si Perséphone fonctionne en aval de GNBP3, nous nous attendions à ce que ces deux mutants partagent le même phénotype. À notre grande surprise, nous avons trouvé que Perséphone n’intervient pas dans la défense contre C. albicans et n’est pas nécessaire à l’activation de la voie Toll par le pathogène. De plus, contrairement à Perséphone, GNBP3 n’est pas requis pour l’activation de la voie Toll par B. bassiana. Notre analyse phénotypique suggérait donc l’existence de deux voies complémentaires d’activation de la voie Toll par les champignons (Figure 2). Nous avons déterminé que GNBP3 est requis pour la reconnaissance des composés de la paroi des champignons tandis que l’activation de Perséphone nécessite des champignons vivants. Ce dernier résultat nous a amené à nous intéresser aux facteurs de virulence des champignons entomopathogènes.  | Figure 2
Reconnaissance des infections microbiennes par un système basal de PRR et de détection de l’activité de facteurs de virulence. Le système de récepteurs de type PRR constitue un système de détection basal capable de détecter la majorité des infections microbiennes. Cependant, certains pathogènes semblent capables de contourner ce système de détection, mais sont néanmoins reconnus par l’intermédiaire des facteurs de virulence qu’ils emploient pour pénétrer dans l’hôte (cas de la protéase PR1 des champignons entomopathogènes) ou pour neutraliser la réponse immunitaire basale de l’hôte (cas des plantes). À ce stade, une reconnaissance des facteurs de virulence ou protéases émis par les bactéries, par l’intermédiaire de la voie Perséphone ou par d’autres canaux, reste hypothétique. |
|
Un autre mode de détection des infections Alors que l’introduction de C. albicans dans la mouche nécessite une blessure expérimentale, la contamination par B. bassiana requiert simplement de saupoudrer les mouches de spores. Celles-ci germent à la surface de la cuticule, différencient une structure spécialisée, l’appressorium, qui sécrète des facteurs de virulence, chitinases et protéases, dont la protéase PR1, qui vont digérer la cuticule. Le champignon passe alors par le trou microscopique (1/10 de la taille de la spore) ainsi formé dans la carapace de l’insecte. Nous avons utilisé un transgène, généré au laboratoire par le Pr J.M. Reichhart, qui permet d’exprimer chez la drosophile la protéase PR1. Cette expression ectopique active la voie Toll en l’absence d’infection et fait intervenir Perséphone et non GNBP3. La conversion du zymogène de Perséphone en protéase active nécessite le clivage de son prodomaine. Nous avons déterminé que le clivage de Perséphone immunoprécipité de l’hémolymphe de mouches non infectées est assuré directement par la protéase PR1 purifiée, démontrant ainsi qu’une cascade de protéases permettant l’activation de la voie Toll peut-être directement activée par un facteur de virulence microbien, Perséphone remplissant alors le rôle d’appât pour les protéases fongiques [9]. Il est vraisemblable que ce système double de reconnaissance des infections fongiques a été sélectionné par l’hôte en réponse à la capacité de certains champignons, tels B. bassiana, à éviter la détection par le système basé sur les PRR, en l’occurrence GNBP3. Ce phénomène présente des ressemblances frappantes avec le mode de détection des infections chez les plantes où coexistent un système basal de reconnaissance des microorganismes par les PRR et un système de détection de l’activité des facteurs de virulence ciblant ce système basal de PRR. Des recherches futures permettront de déterminer si un tel système de détection de l’activité des facteurs de virulence existe aussi chez les vertébrés. L’activation de la voie NF-κB par une protéase de Serratia marcescens via le récepteur PAR2 (protease activated receptor) est un phénomène en faveur d’une telle hypothèse [
10]. |
Footnotes |
1. Medzhitov R, Janeway CA Jr. Decoding the patterns of self and nonself by the innate immune system. Science 2002; 296 : 298–300. 2. Lemaitre B, Hoffmann J. The host defense of Drosophila melanogaster. Annu Rev Immunol 2007 (sous presse). 3. Michel T, Reichhart J, Hoffmann JA, Royet J. Drosophila Toll is activated by Gram-positive bacteria through a circulating peptidoglycan recognition protein. Nature 2001; 414 : 756–9. 4. Gottar M, Gobert V, Michel T, et al. The Drosophila immune response against Gram-negative bacteria is mediated by a peptidoglycan recognition protein. Nature 2002; 41 6 : 640–4. 5. Bischoff V, Vignal C, Boneca IG, et al. Function of the drosophila pattern-recognition receptor PGRP-SD in the detection of Gram-positive bacteria. Nat Immunol 2004; 5 : 1175–80. 6. Kaneko T, Yano T, Aggarwal K, et al. PGRP-LC and PGRP-LE have essential yet distinct functions in the drosophila immune response to monomeric DAP-type peptidoglycan. Nat Immunol 2006; 7 : 715–23. 7. Gobert V, Gottar M, Matskevich A, et al. Dual activation of the Drosophila Toll pathway by two pattern recognition receptors. Science 2003; 302 : 2126–30. 8. Ligoxygakis P, Pelte N, Hoffmann JA, Reichhart JM. Activation of Drosophila Toll during fungal infection by a blood serine protease. Science 2002; 297 : 114–6. 9. Gottar M, Gobert V, Matskevich AA, et al. Dual detection of fungal infections in Drosophila via recognition of glucans and sensing of virulence factors. Cell 2006; 127 : 1425–37. 10. Kida Y, Inoue H, Shimizu T, Kuwano K. Serratia marcescens serralysin induces inflammatory responses through protease-activated receptor 2. Infect Immun 2007; 75 : 164–74. |