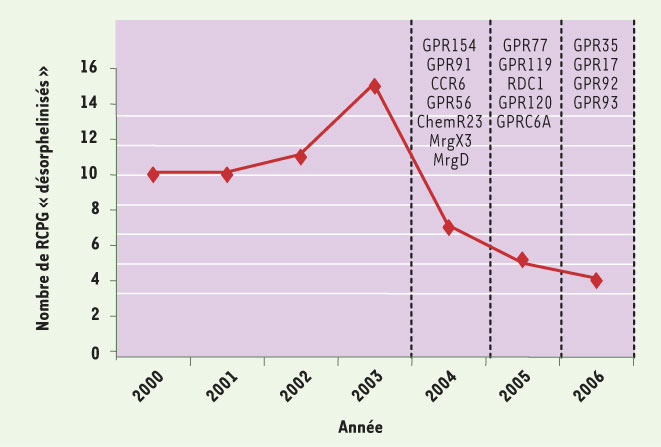
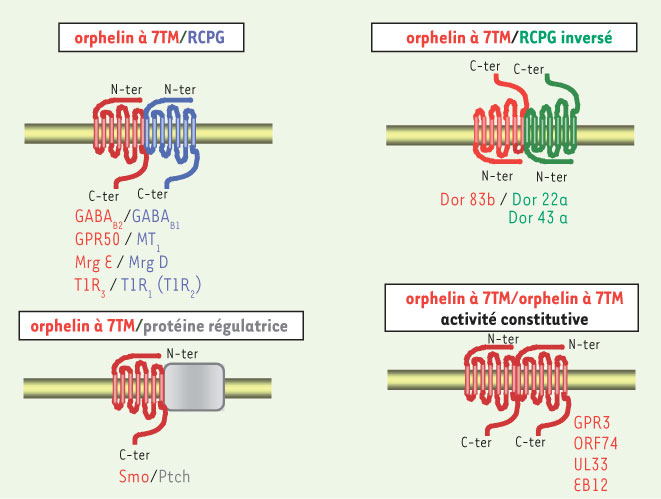
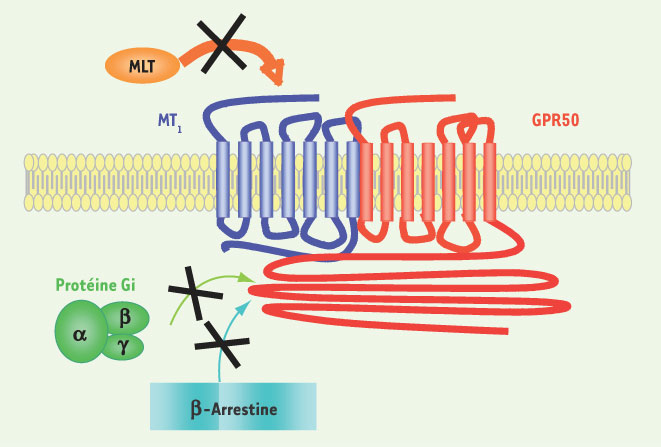
1.
Fredriksson R, Schioth HB. The repertoire of G-protein-coupled receptors in fully sequenced genomes. Mol Pharmacol 2005; 67 : 1414–25.
2.
Fredriksson R, Lagerstrom MC, Lundin LG, Schioth HB. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol 2003; 63 : 1256–72.
3.
Drews J. Drug discovery: a historical perspective. Science 2000; 287 : 1960–4.
4.
Maggio R, Novi F, Scarselli M, Corsini GU. The impact of G-protein-coupled receptor hetero-oligomerization on function and pharmacology. FEBS J 2005; 272 : 2939–46.
5.
Prinster SC, Hague C, Hall RA. Heterodimerization of g protein-coupled receptors: specificity and functional significance. Pharmacol Rev 2005; 57 : 289–98.
6.
Terrillon S, Bouvier M. Roles of G-protein-coupled receptor dimerization. EMBO Rep 2004; 5 : 30–4.
7.
Bulenger S, Marullo S, Bouvier M. Emerging role of homo- and heterodimerization in G-protein-coupled receptor biosynthesis and maturation. Trends Pharmacol Sci 2005; 26 : 131–7.
8.
Cheng ZJ, Harikumar KG, Holicky EL, Miller LJ. Heterodimerization of type A and B cholecystokinin receptors enhance signaling and promote cell growth. J Biol Chem 2003; 278 : 52972–9.
9.
Levoye A, Dam J, Ayoub MA, Guillaume JL, et al. The orphan GPR50 receptor specifically inhibits MT1 melatonin receptor function through heterodimerization. EMBO J 2006; 25 : 3012–23.
10.
Mangelsdorf DJ, Evans RM. The RXR heterodimers and orphan receptors. Cell 1995; 83 : 841–50.
11.
Horard B, Castet A, Bardet PL, et al. Dimerization is required for transactivation by estrogen-receptor-related (ERR) orphan receptors: evidence from amphioxus ERR. J Mol Endocrinol 2004; 33 : 493–509.
12.
Mangelsdorf DJ, Thummel C, Beato M, et al. The nuclear receptor superfamily: the second decade. Cell 1995; 83 : 835–9.
13.
Vassilatis DK, Hohmann JG, Zeng H, et al. The G protein-coupled receptor repertoires of human and mouse. Proc Natl Acad Sci USA 2003; 100 : 4903–8.
14.
O’Dowd BF, Nguyen T, Lynch KR, et al. A novel gene codes for a putative G protein-coupled receptor with an abundant expression in brain. FEBS Lett 1996; 394 : 325–9.
15.
O’Dowd BF, Nguyen T, Jung BP, et al. Cloning and chromosomal mapping of four putative novel human G-protein-coupled receptor genes. Gene 1997; 187 : 75–81.
16.
Sawzdargo M, Nguyen T, Lee DK, et al. Identification and cloning of three novel human G protein-coupled receptor genes GPR52, PsiGPR53 and GPR55: GPR55 is extensively expressed in human brain. Brain Res Mol Brain Res 1999; 64 : 193–8.
17.
Fargin A, Raymond JR, Lohse MJ, et al. The genomic clone G-21 which resembles a beta-adrenergic receptor sequence encodes the 5-HT1A receptor. Nature 1988; 335 : 358–60.
18.
Bunzow JR, Van Tol HH, Grandy DK, et al. Cloning and expression of a rat D2 dopamine receptor cDNA. Nature 1988; 336 : 783–7.
19.
Civelli O. GPCR deorphanizations: the novel, the known and the unexpected transmitters. Trends Pharmacol Sci 2005; 26 : 15–9.
20.
Oh da Y, Kim K, Kwon HB, Seong JY. Cellular and molecular biology of orphan G protein-coupled receptors. Int Rev Cytol 2006; 252 : 163–218.
21.
Metpally RP, Sowdhamini R. Cross genome phylogenetic analysis of human and Drosophila G protein-coupled receptors: application to functional annotation of orphan receptors. BMC Genomics 2005; 6 : 106.
22.
Metpally RP, Sowdhamini R. Genome wide survey of G protein-coupled receptors in Tetraodon nigroviridis. BMC Evol Biol 2005; 5 : 41.
23.
Jones KA, Borowsky B, Tamm JA, Gerald C. GABAb receptors function as a heterotrimeric assembly of the subunits GABAbR1 and GAGbR2. Nature 1998; 396 : 674–9.
24.
Kaupmann K, Malitschek B, Schuler V, et al. GABA(B)-receptor subtypes assemble into functional heteromeric complexes. Nature 1998; 396 : 683–7.
25.
White JH, Wise A, Main MJ, et al. Heterodimerization is required for the formation of a functional GABA(B) receptor. Nature 1998; 396 : 679–82.
26.
Couve A, Filippov AK, Connolly CN, et al. Intracellular retention of recombinant GABAB receptors. J Biol Chem 1998; 273 : 26361–7.
27.
Margeta-Mitrovic M, Jan YN, Jan LY. A trafficking checkpoint controls GABA(B) receptor heterodimerization. Neuron 2000; 27 : 97–106.
28.
Kniazeff J, Galvez T, Labesse G, Pin JP. No ligand binding in the GB2 subunit of the GABA(B) receptor is required for activation and allosteric interaction between the subunits. J Neurosci 2002; 22 : 7352–61.
29.
Mezler M, Muller T, Raming K. Cloning and functional expression of GABA(B) receptors from Drosophila. Eur J Neurosci 2001; 13 : 477–86.
30.
Nelson G, Hoon MA, Chandrashekar J, et al. Mammalian sweet taste receptors. Cell 2001; 106 : 381–90.
31.
Xu H, Staszewski L, Tang H, et al. Different functional roles of T1R subunits in the heteromeric taste receptors. Proc Natl Acad Sci USA 2004; 101 : 14258–63.
32.
Nelson G, Chandrashekar J, Hoon MA, et al. An amino-acid taste receptor. Nature 2002; 416 : 199–202.
33.
Benton R, Sachse S, Michnick SW, Vosshall LB. Atypical membrane topology and heteromeric function of Drosophila odorant receptors in vivo. PLoS Biol 2006; 4 : e20.
34.
Neuhaus EM, Gisselmann G, Zhang W, et al. Odorant receptor heterodimerization in the olfactory system of Drosophila melanogaster. Nat Neurosci 2005; 8 : 15–7.
35.
Riobo NA, Lu K, Emerson CP, Jr. Hedgehog signal transduction: signal integration and cross talk in development and cancer. Cell Cycle 2006; 5 : 1612–5.
36.
Schoneberg T, Schulz A, Biebermann H, et al. Mutant G-protein-coupled receptors as a cause of human diseases. Pharmacol Ther 2004; 104 : 173–206.
37.
Reppert SM, Weaver DR, Ebisawa T, Mahle CD, Kolakowski LF, Jr. Cloning of a melatonin-related receptor from human pituitary. FEBS Lett 1996; 386 : 219–24.
38.
Uz T, Arslan AD, Kurtuncu M, et al. The regional and cellular expression profile of the melatonin receptor MT1 in the central dopaminergic system. Brain Res Mol Brain Res 2005; 136 : 45–53.
39.
Poirel VJ, Masson PM, Pevet P, Gauer F. MT1 melatonin receptor mRNA expression exhibits a circadian variation in the rat suprachiasmatic nuclei. Brain Research 2002; 946 : 64–71.
40.
Danilova N, Krupnik VE, Sugden D, Zhdanova IV. Melatonin stimulates cell proliferation in zebrafish embryo and accelerates its development. Faseb J 2004; 18 : 751–3.
41.
Barrett P, Ivanova E, Graham ES, et al. Photoperiodic regulation of cellular retinoic acid-binding protein 1, GPR50 and nestin in tanycytes of the third ventricle ependymal layer of the Siberian hamster. J Endocrinol 2006; 191 : 687–98.
42.
John B, Enright AJ, Aravin A, Tuschl T, Sander C, Marks DS. Human MicroRNA targets. PLoS Biol 2004; 2 : e363.
43.
Sempere LF, Freemantle S, Pitha-Rowe I, et al. Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation. Genome Biol 2004; 5 : R13.
44.
Milasta S, Pediani J, Appelbe S, et al. Interactions between the Mas-related receptors MrgD and MrgE alter signalling and trafficking of MrgD. Mol Pharmacol 2006; 69 : 479–91.
45.
Levoye A, Dam J, Ayoub MA, Guillaume JL, Jockers R. Do orphan G-protein-coupled receptors have ligand-independent functions ? New insights from receptor heterodimers. EMBO Rep 2006; 7 : 1094–8.