| |
| Med Sci (Paris). 2007 August; 23(8-9): 756–760. Published online 2007 August 15. doi: 10.1051/medsci/20072389756.Régime méditerranéen et ostéoporose Caroline Puel, Véronique Coxam,* and Marie-Jeanne Davicco Unité de Nutrition humaine, UMR 1019, INRA Theix,63122 Saint Genès-Champanelle, France |
L’ostéoporose et, en conséquence, le nombre de fractures ostéoporotiques, devraient connaître une augmentation considérable du fait du vieillissement de la population. Ainsi, en France, on estime que le nombre de fractures du col du fémur triplera entre 1990 et 2025 [
1]. |
L’ostéoporose, un problème physiopathologique lié au vieillissement L’ostéoporose, affection diffuse du squelette, se caractérise par une masse osseuse réduite associée à des altérations microarchitecturales, conduisant à une augmentation de la fragilité et à un risque accru de fracture (Figure 1). Depuis les travaux de Riggs et Melton [
2], on distingue 2 types d’ostéoporoses primaires.
-
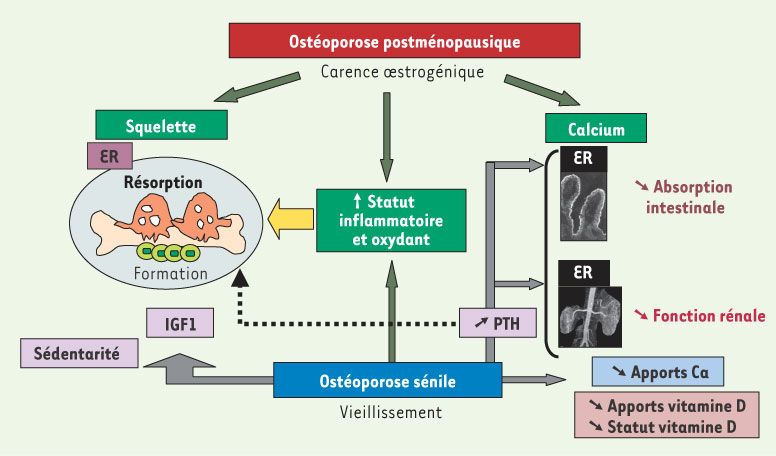
L’ostéoporose post-ménopausique, chez la femme, résulte de l’accélération de la carence œstrogénique engendrée par la ménopause qui se traduit par une forte accélération du remodelage osseux, et par conséquent, par l’apparition de nombreux foyers de résorption ostéoclastique.
-
L’ostéoporose sénile, qui se caractérise par la fracture du col du fémur, survient essentiellement chez les hommes et les femmes après 70 ans et est certes liée à la carence hormonale, mais surtout aux processus du vieillissement. En effet, un déclin de nombreuses fonctions physiologiques caractérise la période de sénescence.
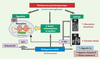 | Figure 1.
Étiologie des deux types d’ostéoporose. ER : récepteur œstrogénique ; PTH : parathormone ; IGF1 : insulin growth factor 1. |
En fait, à la ménopause, le déficit hormonal consécutif à l’arrêt de la fonction ovarienne va se traduire au niveau systémique par une élévation des taux circulants de cytokines inflammatoires (interleukine-1 : IL-1 ; interleukine-6 : IL-6 ; TNF : tumor necrosis factor…), reflétant l’apparition d’une inflammation chronique et d’un stress oxydant (production de monoxyde d’azote). Cet état métabolique sera exacerbé par le processus du vieillissement du fait de la perturbation des systèmes de production des cytokines et d’une baisse intrinsèque des défenses anti-oxydantes (résultant également d’un apport limité en nutriments anti-oxydants et d’une réduction des enzymes anti-oxydantes : glutathion S transférase, glutathion peroxydase, superoxyde dismutase). Or, il est admis qu’au niveau cellulaire, la résorption ostéoclastique résulte d’une surproduction de prostaglandines (PGE2), médiatrices essentielles d’un certain nombre de cytokines inflammatoires. De même, les radicaux libres stimulent le catabolisme osseux et inhibent l’activité ostéoblastique. Par ailleurs, avec l’âge, apparaissent des perturbations du métabolisme phosphocalcique (une balance calcique négative) qui jouent un rôle important dans l’accélération du remodelage osseux. Malgré de très appréciables progrès dans la compréhension des mécanismes physiopathologiques impliqués, la prévention de l’ostéoporose reste problématique. Il est donc urgent de développer des stratégies alternatives efficaces. Une telle prise en charge aura pour double objectif d’optimiser l’acquisition de la masse osseuse en période de croissance et de ralentir l’ostéopénie au cours du vieillissement. En fait, les recherches conduites dans le domaine de la nutrition ont permis de prendre conscience de l’importance de l’alimentation dans la prévention de cette pathologie du 3e âge. Outre leur couverture des besoins métaboliques, les aliments pourraient effectivement contribuer au maintien d’une santé optimale, en modulant des fonctions spécifiques de l’organisme. Des recommandations nutritionnelles devraient donc être intégrées dans les stratégies de promotion de santé. |
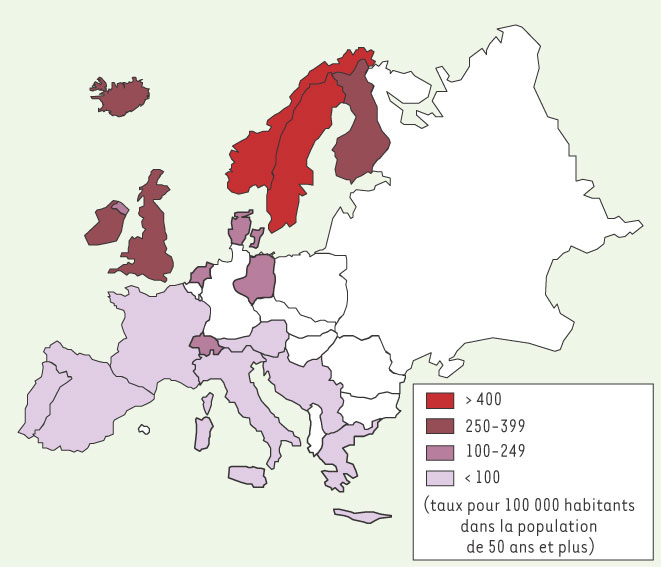
Prévention nutritionnelle de l’ostéoporose par le régime méditerranéen L’incidence moindre de l’ostéoporose dans les pays du pourtour méditerranéen [
3] (Figure 2), pourrait s’expliquer par les caractéristiques du régime méditerranéen, qui associe un apport conséquent en huile d’olive (jusqu’à 40 % de l’apport énergétique total pour la Grèce), une abondance de produits végétaux très variés (fruits et légumes sous différentes formes, légumes secs, blé, raisins et leurs produits dérivés) (Figure 3), même si de nombreux facteurs confondants doivent être pris en considération. 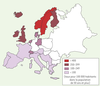 | Figure 2
Disparité de l’incidence de l’ostéoporose en Europe [ 3]. |
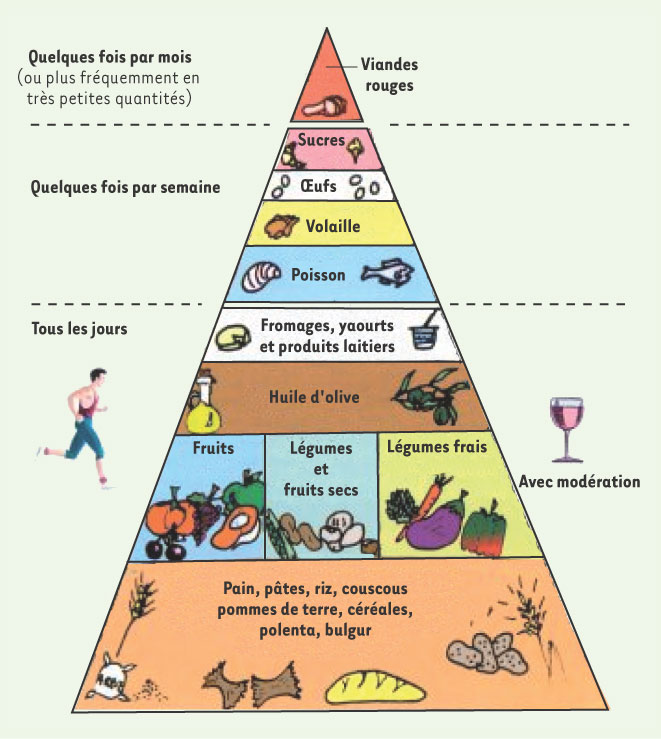
 | Figure 3
Pyramide du régime méditerranéen [
30]. |
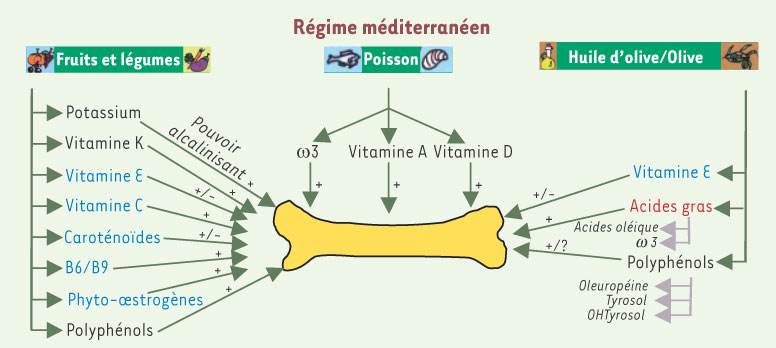
Bénéfices potentiels sur le capital osseux Cas des fruits et légumes Un nombre croissant d’études réalisées chez l’homme décrit un effet ostéoprotecteur des fruits et légumes à tout âge [
4], confirmé récemment par une étude d’intervention DASH ( dietary approaches to stop hypertension) qui montrait une diminution significative des marqueurs du remodelage osseux [
5]. Bien que l’action des fruits et légumes sur le métabolisme osseux soit évidente, le rôle des micronutriments n’est pas encore identifié (Figure 4).
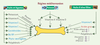 | Figure 4.
Hypothèses d’action des différents constituants du régime méditerranéen sur le tissu osseux. Propriété anti-inflammatoire en rouge et capacité anti-oxydante en bleu. |
La forte teneur en sels organiques de potassium des fruits et légumes leur confère un pouvoir alcalinisant intrinsèque qui permet d’éviter l’hypercalciurie et le relargage de citrate et de carbonate par le squelette, effets induits par certains états naturels (vieillissement, privation…) ou pathologiques (en particulier, l’acidose liée au diabète). Le squelette contenant 80 % du carbonate, 80 % du citrate et 99 % du calcium de l’organisme, il est effectivement doté d’un pouvoir tampon qui contribue au maintien du pH corporel et à la défense contre de tels désordres acido-basiques. Ainsi, l’implication du potassium dans l’épargne du calcium squelettique, via une réduction de l’excrétion urinaire calcique, a été démontrée [
6]. De même, l’étude d’intervention de Appel et al. [
7] décrit une réduction de la fuite de calcium au niveau rénal lorsque la portion quotidiennement ingérée de fruits et légumes passe de 3,6 à 9,5. À terme, cela pourrait se traduire par la préservation du capital osseux comme l’indiquent les études épidémiologiques de New et al. et de Tucker et al. [
8,
9]. Toutefois, les études épidémiologiques en nutrition présentent un certain nombre de limites qui ne doivent pas être négligées. En effet, les quelques questionnaires de consommation réalisés ne permettent pas de connaître l’alimentation exacte des personnes pendant toute la période expérimentale, il peut y avoir des variations dans le statut nutritionnel des volontaires qui ne sont pas toujours évidentes à maîtriser. De plus, il ne faut pas négliger les éventuels facteurs confondants. L’effet protecteur des phyto-œstrogènes (présents dans les légumineuses et notamment le soja) sur le tissu osseux a également été envisagé car des études écologiques recensaient une moindre incidence des fractures ostéoporotiques chez les populations asiatiques, fortes consommatrices de soja. Les investigations chez l’homme témoignent d’une association positive entre niveau de consommation et capital osseux chez la femme ménopausée asiatique [
10], protection non retrouvée chez les occidentales qui consomment généralement très peu de légumes secs. De plus, alors que les études cliniques d’intervention à court terme (1 à 3 mois) indiquent que la prise de phyto-œstrogènes est dépourvue d’effet bénéfique, les investigations conduites sur une plus longue durée révèlent un potentiel intéressant sur la densité minérale osseuse de la femme ménopausée [
11], qui doit encore être validé. L’implication de la vitamine K (essentiellement dans les légumes verts à feuilles) au niveau osseux a été mise en évidence à la suite des observations de malformations fœtales engendrées par la prise maternelle d’anti-vitamines K. Ces observations furent étayées par la démonstration de la présence de vitamine K et de protéines dépendantes au niveau squelettique (ostéocalcine…). Plusieurs études épidémiologiques suggèrent effectivement un lien entre les marqueurs biologiques du statut en vitamine K, la densité minérale osseuse [
12] et le risque fracturaire [
13]. Une telle association a été confirmée par des études d’intervention. En effet, chez des femmes ostéoporotiques, l’addition de vitamine K à l’alimentation améliore les paramètres du métabolisme osseux [
14]. En ce qui concerne la masse osseuse, Braam et al. [
15] ont montré le bénéfice, chez des femmes ménopausées, d’un apport en vitamine K1 (1 mg/j), associé à une supplémentation minérale (calcium, magnésium et zinc) et vitaminique D. Les bienfaits d’une alimentation riche en fruits et légumes sont aussi attribués, en partie, à la richesse en anti-oxydants de ces aliments, dont les bénéfices ont été démontrés pour diverses cibles biologiques (cancers, maladies cardiovasculaires, et autres maladies dégénératives). L’étiologie multifactorielle de l’ostéoporose inclut effectivement une composante inflammatoire [
16] et oxydative [
17]. Parmi les molécules aux propriétés anti-oxydantes et anti-inflammatoires, on retrouve la vitamine E (50 à 70 % apportés par les huiles végétales et dans une moindre mesure, 12 %-18 %, par les végétaux) dont la capacité ostéoprotectrice a été décrite en particulier en situation d’apesanteur. La vitamine C (dans les fruits et légumes frais) est un facteur de différenciation ostéoblastique in vitro. Les données chez l’homme concernant la corrélation entre le niveau de consommation de ces nutriments et la masse osseuse sont divergentes, toutefois, une amélioration de la masse osseuse après supplémentation a été montrée [
18]. Parmi les caroténoïdes (carotte crue : 7 975 µg de β-carotène/100 g de portion ; cresson : 5 919 µg de β-carotène et 10 713 µg de lutéine/zéaxanthine/100 g de portion), la consommation en β-carotène est associée positivement à la densité minérale vertébrale chez la femme ménopausée [
19]. Toutefois, des apports élevés en rétinol (vitamine A, supplémentation systématique) peuvent s’avérer délétères en termes de densité minérale et risque de fracture [
20]. Concernant les polyphénols (sous forme de dérivés glucidiques dans de nombreux fruits et légumes), les premiers travaux ayant montré un effet ostéoprotecteur ont été réalisés sur un modèle animal d’ostéoporose post-ménopausique [
21]. Si des études cliniques d’intervention font encore défaut, une association entre la masse osseuse et la consommation régulière de thé (riche en catéchine) a été démontrée [
22]. Les végétaux contiennent également des vitamines du groupe B (en particulier B6 et B9). En cas de carence en vitamine B6, l’activité des enzymes impliquées dans le métabolisme protéique est réduite et peut conduire à une altération des protéoglycanes et un défaut de maturation du collagène. Un découplage entre la formation et la résorption est également observé [
23]. Par ailleurs, alors que le potentiel de minéralisation d’ostéoblastes en culture ne semble pas affecté, une déplétion en vitamine B6 ralentit la guérison des fractures chez le rat. La vitamine B9 (acide folique) est essentiellement présente dans les aliments sous forme de polyglutamates communément dénommés folates. Grâce à sa fonction de donneur d’unités monocarbonées, l’acide folique participe simultanément au métabolisme des acides aminés et des acides nucléiques. Des carences engendrent des perturbations du capital osseux [
24]. Poisson Une consommation de poissons gras est associée à un apport élevé de graisses polyinsaturées de la série omega-3 (acide eicosapentaénoïque, EPA, et acide docosahexaénoïque, DHA). Il ne faut pas oublier que ces acides gras sont des précurseurs de la synthèse des prostaglandines et qu’ils peuvent moduler le statut oxydant. Ainsi, même si les lipides entrent dans la composition du tissu osseux, l’essentiel de leur contribution est à ce niveau. Dans un modèle animal, il a été constaté qu’une carence induit une ostéoporose sévère couplée à une augmentation de la calcification rénale et artérielle, alors qu’un régime riche en ω3 et CLA (acide linoléique conjugué) permet d’accélérer la formation osseuse, voire d’améliorer les propriétés de résistance. De même, un déséquilibre du rapport ω6/ω3 (<10), se traduit par une masse osseuse réduite, comme l’indique l’étude Rancho Bernado [
25]. À l’inverse, une supplémentation en ω3 est susceptible d’améliorer la densité minérale osseuse [
26]. Le poisson est aussi une source importante de vitamines A et D. En ce qui concerne les effets de la vitamine A sur le squelette, ils ont déjà été évoqués dans la partie fruits et légumes. La vitamine D intervient principalement dans le mécanisme de transport actif du calcium (contrôle l’expression du gène codant pour la CaBP, protéine impliquée dans le transport du calcium à travers la barrière entérocytaire). Divers travaux ont mis en évidence une répercussion favorable d’une amélioration du statut vitaminique sur le capital osseux. Ainsi, l’équipe de P. Meunier [
27] a mis en évidence l’efficacité d’une dose vitaminique journalière (additionnée de calcium) sur la normalisation de la parathormonémie, ainsi que sur le risque fracturaire des personnes âgées vivant en institutions. Huile d’olive Le bénéfice de la consommation d’huile d’olive pour le capital osseux a été démontré dans le cadre de l’expérimentation animale [
28]. Il s’explique par la richesse de cette huile en vitamine E, acide oléique et divers polyphénols. Les propriétés anti-inflammatoires de l’acide oléique ont été décrites pour la prévention de l’arthrite rhumatoïde. Par ailleurs, Priante et al. [
29] ont montré in vitro le potentiel inhibiteur de l’acide oléique sur l’expression des ARN messagers de cytokines (impliquées dans le remodelage osseux) induite par l’acide arachidonique. Les capacités anti-oxydantes et anti-inflammatoires des polyphénols de l’huile d’olive (oleuropéine, hydroxytyrosol et tyrosol) ont largement été explorées. Le pouvoir anti-oxydant des composés phénoliques présents dans l’huile d’olive a très souvent été montré, avec une plus grande efficacité par rapport à d’autres anti-oxydants majeurs présents dans l’alimentation. De plus, ces composés phénoliques exercent une nette action anti-inflammatoire. Au niveau osseux, seul le pouvoir ostéoprotecteur de l’oleuropéine a été démontré in vivo [28]. |
Le vieillissement est un phénomène complexe qui associe une immunité cellulaire défaillante, un état inflammatoire permanent et une augmentation des atteintes radicalaires. Ces altérations contribuent à la complexité de l’étiologie de l’ostéoporose et impliquent une prise en charge nutritionnelle qui ne soit plus exclusivement centrée sur le calcium. Ainsi, un régime équilibré apportant des fruits, légumes et céréales dans des proportions suffisantes permettrait de limiter l’impact délétère des phénomènes de dégénérescence observés au cours de la sénescence sur lesquels les prises en charge classiques restent inefficaces. Le régime méditerranéen, en raison de sa diversité et de sa richesse en micronutriments, offre donc un potentiel intéressant, déjà reconnu d’ailleurs pour d’autres cibles biologiques. |
1. Baudouin C, Fardellone P, Thelot, et al. Hip fractures in France: the magnitude and perspective of the problem. Osteoporos Int 1996; 6 (suppl 3) : 1–10. 2. Riggs BL, Melton LJ 3rd. Evidence for two distinct syndromes of involutional osteoporosis. Am J Med 1983; 75 : 899–901. 3. Johnell O, Gulberg B, Allander E, Kanis JA. The apparent incidence of hip fracture in Europe: a study of national register sources. Osteoporos Int 1998; 2 : 298–302. 4. Prynne CJ, Mishra GD, O’Connell MA, et al. Fruit and vegetable intakes and bone minearl status: a cross sectional study in five age and sex cohorts. Am J Clin Nutr 2006; 83 : 1420–8. 5. Doyle L, Cashman KD. The DASH diet may have beneficial effects on bone health. Nutr Rev 2004; 62 : 215–20. 6. New S, Smith R, Brown J, Reid D. Positive associations between fruit and vegetable consumption and bone mineral density in late postmenopausal and elderly women. Osteoporos Int 2002; 13 : S77. 7. Appel LJ, Moore TJ, Obarzanek E, et al. A clinical trial of the effects of dietary patterns on blood pressure. DASH Collaborative Research Group. N Engl J Med 1997; 336 : 1117–24. 8. New SA, Robins SP, Campbell MK, et al. Dietary influences on bone mass and bone metabolism: further evidence of a positive link between fruit and vegetable consumption and bone health ? Am J Clin Nutr 2000; 71 : 142–51. 9. Tucker KL, Hannan MT, Kiel DP. The acid-base hypothesis: diet and bone in the Framingham Osteoporosis Study. Eur J Nutr 2001; 40 : 231–7. 10. Coxam V, Gerber M. Effets des phyto-œstrogènes sur l’ostéoporose. Rapport AFSSA, 2005 : 221–49. 11. Morabito N, Crisafulli A, Vergara C, et al. Effects of genistein and hormone-replacement therapy on bone loss in early postmenopausal women: a randomized double-blind placebo-controlled study. J Bone Miner Res 2002; 17 : 1904–12. 12. Kanai T, Takagi T, Masuhiro K, et al. Serum vitamin K level and bone mineral density in post-menopausal women. Int J Gynecol Obstet 1997; 56 : 25–30. 13. Vergnaud P, Garnero P, Meunier PJ, et al. Undercarboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: the EPIDOS Study. J Clin Endocrinol Metab 1997; 82 : 719–24. 14. Knapen MH, Jie KS, Hamulyak K, Vermeer C. Vitamin K-induced changes in markers for osteoblast activity and urinary calcium loss. Calcif Tissue Int 1993; 53 : 81–5. 15. Braam LA, Knapen MH, Geusens P, et al. Vitamin K1 supplementation retards bone loss in postmenopausal women between 50 and 60 years of age. Calcif Tissue Int 2003; 73 : 21–6. 16. Koh JM, Khang YH, Jung CH, et al. Higher circulating hsCRP levels are associated with lower bone mineral density in healthy pre- and postmenopausal women: evidence for a link between systemic inflammation and osteoporosis. Osteoporos Int 2005; 16 : 1263–71. 17. Basu S, Michaelsson K, Olofsson H, et al. Association between oxidative stress and bone mineral density. Biochem Biophys Res Commun 2001; 288 : 275–9. 18. Morton DJ, Barrett-Connor EL, Schneider DL. Vitamin C supplement use and bone mineral density in postmenopausal women. J Bone Miner Res 2001; 16 : 135–40. 19. Wattanapenpaiboon N, Lukito W, Wahlqvist ML, Strauss BJ. Dietary carotenoid intake as a predictor of bone mineral density. Asia Pac J Clin Nutr 2003; 12 : 467–73. 20. Melhus H, Michaelsson K, Kindmark A, et al. Excessive dietary intake of vitamin A is associated with reduced bone mineral density and increased risk for hip fracture. Ann Intern Med 1998; 129 : 770–8. 21. Horcajada-Molteni MN, Crespy V, Coxam V, et al. Rutin inhibits ovariectomy-induced osteopenia in rats. J Bone Miner Res 2000; 15 : 2251–8. 22. Wu CH, Yang YC, Yao WJ, et al. Epidemiological evidence of increased bone mineral density in habitual tea drinkers. Arch Intern Med 2002; 162 : 1001–6. 23. Masse PG, Rimnac CM, Yamauchi M, et al. Pyridoxine deficiency affects biomechanical properties of chick tibial bone. Bone 1996; 18 : 567–74. 24. Abrahamsen B, Madsen JS, Tofteng CL, et al. A common methylenetetrahydrofolate reductase (C677T) polymorphism is associated with low bone mineral density and increased fracture incidence after menopause: longitudinal data from the Danish Osteoporosis Prevention Study. J Bone Miner Res 2003; 18 : 723–9. 25. Weiss LA, Barrett-Connor E, von Muhlen D. Ratio of n-6 to n-3 fatty acids and bone mineral density in older adults: the Rancho Bernardo Study. Am J Clin Nutr 2005; 81 : 934–8. 26. Terano T. Effect of omega 3 polyunsaturated fatty acid ingestion on bone metabolism and osteoporosis. World Rev Nutr Diet 2001; 88 : 141–7. 27. Meunier PJ, Chapuy MC, Arlot ME, et al. Can we stop bone loss and prevent hip fractures in the elderly ? Osteoporos Int 1994; 4 : 571–6. 28. Puel C, Quintin A, Agalias A et al. Olive oil and its main phenolic micronutrient (oleuropein) prevent inflammation-induced bone loss in the ovariectomized rat. Br J Nutr 2004; 92 : 119–27. 29. Priante G, Bordin L, Musacchio E, et al. Fatty acids and cytokine mRNA expression in human osteoblastic cells: a specific effect of arachidonic acid. Clin Sci (London) 2002; 102 : 403–9. 30. Willet WC, Sacks F, Trichopoulou A, et al. Mediterranean diet pyramid: a cultural model for healthy eating. Am J Clin Nutr 1995; 61 : S1402–6. |