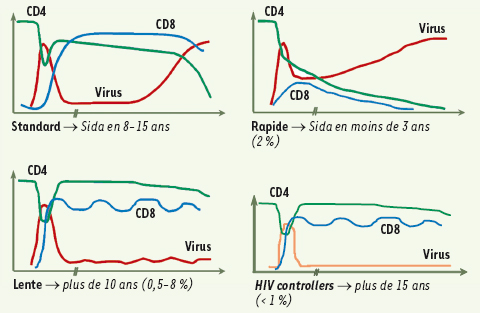
Néanmoins, depuis les années 1991-3, les études de cohortes avaient déjà pu mettre en évidence qu’une faible proportion des patients (0,5 à 8 %) [4, 5] infectés par le VIH maintenait pendant plus de 10 ans un taux de lymphocytes T CD4 supérieur à 500/mm3, sans traitement antirétroviral et sans signe clinique de Sida [5]. Ces patients avaient été désignés comme survivants à long terme, asymptomatiques à long terme (ALT), ou non progresseurs à long terme (LTNP). Aucun critère virologique n’avait été utilisé pour définir ces patients car la mesure de la réplication virale n’était pas encore réalisée en routine à cette date. Il a pu être montré depuis que leur réplication virale est spontanément faible et partiellement contrôlée [
7,
8], ce qui les rapproche de la nouvelle classe de patients HIV controllers. Ces derniers représentent moins de 1 % de l’ensemble des patients infectés par le VIH et sont définis par un contrôle spontané et total de la réplication virale avec un virus indétectable dans le plasma (jusqu’à moins de 50 copies/ml d’ARN viral) [6].
Trois hypothèses non exclusives ont été discutées pour expliquer ce phénotype de contrôle spontané de la réplication virale ou de non progression : (1) le contrôle peut être lié à l’agent pathogène lui-même, ou à l’hôte, via (2) des caractéristiques génétiques ou (3) la qualité de la réponse immune.
Les premières données mécanistiques ont été obtenues par l’exploration des patients ALT/LTNP montrant que le virus n’est pas défectueux chez ces sujets [7, 8]. Ces patients présentent des traits génétiques regroupant des mutations dans les gènes des co-récepteurs d’entrée du virus, telles qu’une délétion de 32 paires de base dans le gène CCR5, et une fréquence accrue de certains gènes HLA gouvernant l’immunité cellulaire antivirale médiée par les lymphocytes T CD8, tels que HLA-B57 et HLA-B27 [
9]. Il s’y associe en outre de puissantes réponses immunes au VIH médiées par les lymphocytes T CD8 [
10] et CD4 [
11,
12]. En revanche, les anticorps neutralisants ne semblent pas impliqués dans ce contrôle. De même, il n’existe aucun argument pour une prédominance ethnique dans la progression lente de l’infection [5].
Les données récentes obtenues chez les HIV controllers ont également montré que les virus VIH isolés chez ces sujets maintenaient une capacité réplicative sans délétion du génome viral [
13,
14] et un nombre très faible de cellules hébergeant l’ADN proviral [6,
15]. Comme chez les ALT/LTNP, avec lesquels ils partagent des caractéristiques génétiques (notamment HLA-B57 et B27), de fortes réponses immunitaires ont été observées chez les HIV controllers dotées en particulier d’activité cytotoxique et surtout antivirale [6,
16]. Ainsi, il a pu être montré dans la cohorte française des HIV controllers, que les lymphocytes T CD8 anti-VIH inhibent complètement la réplication du VIH dans les lymphocytes T CD4 par un mécanisme encore inconnu, sans inhiber leur infection [16]. D’autres auteurs ont montré qu’une maturation complète et une activation réduite des cellules T CD8 anti-VIH [
17] sont associées au contrôle virologique [
18]. De même, dans le sous-groupe de patients HIV controllers HLA-B*57, le contrôle de la réplication virale apparaît être le reflet de réponses T cytotoxiques dirigées contre des épitopes diversifiés, sans épuisement concomitant des cellules T spécifiques du virus permettant ainsi de maintenir le système immunitaire dans un état quiescent [
19]. Cette préservation de fortes capacités fonctionnelles des cellules T CD8 pourrait être due, comme chez les ALT/LTNP, aux fréquences très élevées de cellules T CD4 anti-VIH polyspécifiques, capables de produire simultanément interféron-γ et interleukine-2 et faiblement activées [18]. Enfin des titres élevés d’anticorps neutralisants ne sont pas nécessaires au maintien du contrôle virologique comme chez les patients ALT/LTNP [
20]. Au total, il a été proposé que près de la moitié des HIV controllers aient des réponses immunes spécifiques du VIH très intenses, un tiers à un quart aient une immunité innée anti-VIH (chimiokines et lymphocytes natural killer) importante alors qu’aucune autre explication immunologique au contrôle virologique qu’une absence d’hyperactivation immune n’a été proposée pour un tiers à la moitié d’entre eux (S. Deeks, communication personnelle).
Des observations similaires de macaques Rhésus SIV controllers chez lesquels certains haplotypes du complexe majeur d’histocompatibilité (Mamu-B*08) et des puissantes réponses CD8 immunodominantes anti-SIV sont mises en évidence. Ces macaques elite controllers différent des singes verts et des sooty mangabeys infectés par le SIV (Simian immunodeficiency virus), asymptomatiques et qui ne présentent pas de déplétion T CD4 malgré une réplication virale élevée au cours du temps.
En conclusion, les HIV controllers représentent un sous-groupe homogène de patients caractérisés par une « indétectabilité » persistante du virus et antérieurement classés comme « progresseurs lents ». Le contrôle virologique apparaît lié à un polymorphisme particulier des gènes de l’hôte ainsi qu’à de fortes réponses cellulaires T CD4 et CD8 au virus. Ces patients exceptionnels servent de modèles pour une meilleure compréhension des mécanismes physiopathologiques permettant de contrôler durablement cette infection virale chronique et pour la définition de stratégies thérapeutiques et vaccinales. Certaines questions restent cependant entières : « Cet état de réplication virale spontanément contrôlée est-il la conséquence de fortes réponses immunes ou permet-il la préservation de fortes fonctions immunes grâce à une moindre activation et un moindre épuisement du système immun ? » Dans cette dernière hypothèse, il resterait à définir la cause primitive du contrôle virologique.
Conférer ce statut à l’ensemble des patients infectés par le VIH est un défi pour le futur.