| |
| Med Sci (Paris). 2008 January; 24(1): 37–40. Published online 2008 January 15. doi: 10.1051/medsci/200824137.Hsp70, l’ange gardien de GATA-1 lors de la différenciation des globules rouges Julie Vandekerckhove,1 Jean-Antoine Ribeil,1 Yaël Zermati,2 Carmen Garrido,3 Geneviève Courtois,1 Eric Solary,3 and Olivier Hermine1* 1CNRS UMR 8147 et Département d’Hématologie, Faculté de Médecine et Université René Descartes Paris V, Hôpital Necker, 75743 Paris Cedex 15, France 2Département d’hématologie, Institut Cochin, Paris, France 3Inserm, UMR 517, 21079 Dijon, France MeSH keywords: Animaux, Différenciation cellulaire, Cytoplasme, Érythroblastes, Érythrocytes, Facteur de transcription GATA-1, Protéines du choc thermique HSP70, Humains |
L’érythropoïèse est le processus permettant la production des globules rouges matures à partir de cellules souches hématopoïétiques, et il est finement régulé par l’effet combiné du microenvironnement médullaire -au sein de structures appelées îlots érythroblastiques- et par des facteurs de croissance. Ce programme de différenciation est en grande partie sous le contrôle du facteur de transcription GATA-1. Celui-ci active la transcription de gènes érythroïdes, comme ceux qui codent pour la glycophorine, les chaînes de l’hémoglobine et le récepteur de l’érythropoïétine (EpoR) ainsi que le gène de survie BclXL
. Les progéniteurs érythroïdes les plus précoces appelés BFU-E (burst forming unit-erythroid, ainsi nommés parce que in vitro en milieu semi-solide, ces progéniteurs produisent des colonies éclatées en multiples agrégats), requièrent la présence de stem cell factor (SCF) et d’érythropoïétine (Epo) [
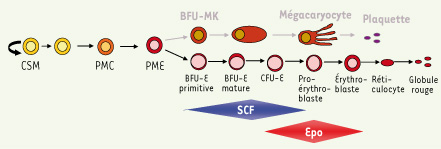
1] ; ils donnent naissance aux progéniteurs CFU-E (colony-forming unit-erythroid) qui eux, sous le contrôle strict de l’Epo, vont se différencier en cellules morphologiquement identifiables de la lignée érythroblastique, les proérythroblastes. Ces proérythroblastes vont ensuite se différencier successivement en érythroblastes basophiles, polychromatophiles et acidophiles. L’énucléation de l’érythroblaste acidophile donne naissance aux réticulocytes qui maturent finalement en globules rouges (Figure 1).  | Figure 1.
L’érythropoïèse est le processus permettant la différenciation des cellules souches hématopoïétiques en globules rouges matures. La dépendance en érythropoïétine débute au stade BFU-E et s’arrête au stade proérythroblaste, le SCF débute son action en amont. L’expression des marqueurs de surface utilisés pour caractériser les différents précurseurs érythroïdes est indiquée. CSH : cellule souche hématopoïétique ; PMC : progéniteur myéloïde commun ; PME : progéniteur commun mégacaryocyte-érythrocyte ; CFU-E : colony-forming unit-erythroid ; BFU-E : burst-forming unit-erythroid. |
 | Figure 2.
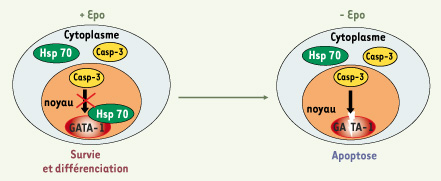
Modèle de la protection de GATA-1 du clivage par la caspase-3 par Hsp70 au cours de la différenciation érythroblastique. L’Epo permet le maintien de la localisation nucléaire d’Hsp70, ce qui protège GATA-1 du clivage par la caspase-3. En l’absence d’Epo, Hsp70 est délocalisée vers le cytoplasme et la caspase-3 peut alors cliver GATA-1, ce qui entraîne l’arrêt de différenciation et l’apoptose des progéniteurs érythroblastiques. |
Le SCF et l’Epo sont les deux cytokines principales nécessaires à la production des globules rouges. La production d’Epo est régulée par l’oxygénation rénale, permettant ainsi le contrôle de la production de globules rouges. La baisse du taux d’Epo va diminuer les signaux de prolifération et surtout induire l’apoptose des érythroblastes et ainsi diminuer la production des globules rouges. Par ailleurs il a été montré que les érythroblastes immatures expriment à leur surface le récepteur de mort Fas, alors que les plus matures expriment Fas-L [
2]. Ainsi au sein de l’îlot érythroblastique, les érythroblastes les plus matures interagissent avec les plus immatures et induisent l’activation de Fas, ce qui a pour conséquence l’activation des caspases. |
Implication de la caspase 3 dans l’apoptose des érythroblastes et le contrôle de l’érythropoïèse L’apoptose des érythroblastes est dépendante des caspases, et, de ce fait, les caspases et en particulier la caspase-3, enzyme principale effectrice de l’apoptose, jouent un rôle majeur dans la régulation de l’érythropoïèse. En effet, l’absence d’activation de la voie Jak2/STAT5 normalement induite par le récepteur de l’Epo conduit à une diminution de l’expression de BclXL, diminution responsable de la dépolarisation de la mitochondrie et de l’activation de la caspase 9 au sein de l’apoptosome, qui elle-même va activer la caspase 3. Au cours de ce processus apoptotique, la caspase-3, en clivant GATA-1, entraîne une amplification de la diminution d’expression de BclXL (en diminuant l’effet transactivateur de GATA-1 sur le gène codant BclXL) et également un arrêt de maturation (en diminuant l’effet transactivateur de GATA-1 sur les gènes codant les gènes de la différenciation érythroïde). L’activation de Fas va induire l’activation de la caspase 8, qui elle va cliver la protéine bid en tbid, qui induit une dépolarisation de la mitochondrie. À ce niveau, l’Epo, en augmentant les taux de BclXL permet de contrôler l’apoptose et le clivage de GATA-1. Ainsi, en fonction des taux relatifs de Fas-L et d’Epo, les érythroblastes vont survivre et se différencier (Epo > Fas-L), vont survivre mais être bloqués dans leur maturation (Fas-L = Epo), ou vont entrer en apoptose et arrêter leur maturation (Fas-L > Epo). La similitude de certains changements morphologiques s’opérant au cours de la différenciation érythroïde terminale et de l’apoptose (condensation nucléaire, condensation de la chromatine, condensation cytoplasmique, perte d’organites) nous a conduit à faire l’hypothèse que les caspases pourraient être également impliquées dans le processus de différenciation érythroblastique. Nous avons ainsi montré que la caspase-3 est activée par la caspase 9, probablement en raison d’une expression constitutive de Bax dans les érythroblastes (J. Vandekerckhove et G. Courtois, données non publiées), et que cette activation est nécessaire à la maturation terminale des érythroblastes [
3]. Elle clive, comme au cours de l’apoptose, la lamine B et acinus (une protéine activée par clivage), entraînant respectivement la condensation du noyau et de la chromatine des érythroblastes. Cependant, contrairement à ce qui se produit au cours de l’apoptose, le facteur de transcription GATA-1 n’est pas clivé par la caspase-3 au cours de la différenciation érythroïde terminale. Ainsi, la régulation de l’érythropoïèse est non seulement liée au niveau d’activation des caspases mais aussi, en aval de cette activation, à l’accessibilité de leurs cibles. |
Hsp 70 protège GATA-1 de la dégradation Pour expliquer les mécanismes régulant le choix entre apoptose et différenciation, nous avons fait l’hypothèse que la protéine de choc thermique Hsp70 pourrait être impliquée dans la régulation de l’accessibilité des caspases à leurs cibles. Les érythroblastes expriment de façon constitutive la protéine de choc thermique Hsp70. Cette protéine agit habituellement en chaperonnant les protéines dénaturées par la chaleur pour leur permettre de reprendre leur conformation native. Au cours de la différenciation érythroblastique, Hsp70 est exprimée de façon constitutive et se localise dans le noyau où elle interagit avec GATA-1. À ce niveau, elle protège ce facteur du clivage par la caspase-3 [
4]. En accord avec le rôle d’Hsp70 comme protéine protectrice de GATA-1, le sevrage en Epo, qui induit l’apoptose, s’accompagne de la sortie nucléaire d’Hsp70, ce qui permet alors à la caspase 3 de cliver GATA-1 et d’induire une augmentation de l’activation des caspases et l’apoptose. Ainsi, l’Epo protège les cellules érythroïdes en cours de différenciation du clivage de GATA-1 par la caspase-3 en assurant le maintien de la localisation nucléaire de Hsp70. Il reste à élucider les mécanismes par lesquels l’Epo induit la rétention d’Hsp70 dans le noyau, et pourquoi l’ADN n’est pas clivé au cours de la différenciation érythroïde. Dans le modèle que nous proposons, les caspases seraient activées au cours de la différenciation érythroïde et sont indispensables à la maturation terminale. Le devenir de l’érythroblaste, entre différenciation et apoptose, ne serait plus uniquement sous le contrôle du niveau d’activation des caspases, mais aussi sous le contrôle de l’expression et de la localisation nucléaire d’Hsp70. L’expression d’Hsp70 pourrait être sous le contrôle de GATA-1, mais aussi de l’hypoxie, ce qui constituerait un niveau supplémentaire de contrôle des globules rouges au niveau médullaire [
5]. Ce système à la fois complexe mais rapide permettrait de réguler de façon fine et coordonnée le taux de fabrication des globules rouges simplement en contrôlant le passage nucléo-cytoplasmique d’Hsp70. |
Un rôle plus large pour Hsp70 dans le processus tumoral ? Ce modèle pourrait s’appliquer à d’autres types cellulaires nécessitant l’activation des caspases pour leur différenciation terminale comme les kératinocytes, les cellules du cristallin, les cellules musculaires, les mégacaryocytes lors de la formation des proplaquettes ou encore les monocytes lors de leur différenciation en macrophages [5,
6,
7–
10]. La compréhension des mécanismes d’expression constitutive d’Hsp70 au cours de l’érythropoïèse, et des processus de signalisation par lesquels le récepteur de l’Epo induit la localisation nucléaire d’Hsp70, pourrait apporter des éclaircissements sur les mécanismes de diverses pathologies érythroïdes, telles que certaines polyglobulies ou à l’inverse certaines myélodysplasies. En effet, dans les polyglobulies qui ne sont pas associées à des mutations de la kinase Jak2 [
11], une activation constitutive de la voie de signalisation responsable du maintien d’Hsp70 pourrait conduire à une polyglobulie sans doute d’intensité atténuée par rapport au phénotype observé dans la maladie de Vaquez. Dans les myélodysplasies, une sortie anormale d’Hsp70 du noyau pourrait expliquer le tableau biologique des formes de bas grade caractérisées par un arrêt prématuré de la différenciation et une augmentation de l’apoptose alors que la prolifération est conservée. Par ailleurs, nos résultats pourraient également s’appliquer à d’autres hémopathies malignes et cancers qui ne touchent pas seulement l’érythropoïèse. Par exemple, il a été montré que les blastes de patients atteints de LMC (leucémie myéloïde chronique) résistant au traitement par l’imatinib (Glivec®) (un inhibiteur de tyrosine kinase bloquant l’activité catalytique de bcr-abl) surexpriment Hsp70 [
12] par un mécanisme restant à élucider. L’inhibition de l’expression et/ou de la localisation nucléaire d’Hsp70 pourrait, dans cette hypothèse, rétablir la sensibilité au Glivec®. De même l’hyper-expression d’Hsp70 explique la résistance aux drogues de certains cancers notamment du sein [
13]. |
1. Emerson SG, Sieff CA, Wang EA, et al. Purification of fetal hematopoietic progenitors and demonstration of recombinant multipotential colony-stimulating activity. J Clin Invest 1985; 76 : 1286–90. 2. De Maria R, Zeuner A, Eramo A, et al. Negative regulation of erythropoiesis by caspase-mediated cleavage of GATA-1. Nature 1999; 401 : 489–93. 3. Zermati Y, Garrido C, Amsellem S, et al. Caspase activation is required for terminal erythroid differentiation. J Exp Med 2001; 193 : 247–54. 4. Ribeil JA, Zermati Y, Vandekerckhove J, et al. Hsp70 regulates erythropoiesis by preventing caspase-3-mediated cleavage of GATA-1. Nature 2007; 445 : 102–5. 5. Wang X, Xu C, Wang X, et al. Heat shock response and mammal adaptation to high elevation (hypoxia). Sci China C Life Sci 2006; 49 : 500–12. 6. Zandy AJ, Lakhani S, Zheng T, et al. Role of the executioner caspases during lens development. J Biol Chem 2005; 280 : 30263–72. 7. Ikeda R, Yoshida K, Ushiyama M, et al. The small heat shock protein alphaB-crystallin inhibits differentiation-induced caspase 3 activation and myogenic differentiation. Biol Pharm Bull 2006; 29 : 1815–9. 8. De Botton S, Sabri S, Daugas E, et al. Platelet formation is the consequence of caspase activation within megakaryocytes. Blood 2002; 100 : 1310–7. 9. Sordet O, Rebe C, Plenchette S, et al. Specific involvement of caspases in the differentiation of monocytes into macrophages. Blood 2002; 100 : 4446–53. 10. Cathelin S, Rebe C, Haddaoui L, et al. Identification of proteins cleaved downstream of caspase activation in monocytes undergoing macrophage differentiation. J Biol Chem 2006; 281 : 17779–88. 11. Ugo V, James C, Vainchenker W. Une mutation unique de la protéine kinase JAK2 dans la polyglobulie de Vaquez et les syndromes myéloprolifératifs non-LMC. Med Sci (Paris) 2005; 21 : 669–70. 12. Pocaly M, Lagarde V, Etienne G, et al. Overexpression of the heat-shock protein 70 is associated to imatinib resistance in chronic myeloid leukemia. Leukemia 2007; 21 : 93–101. 13. Ciocca DR, Calderwood SK. Heat shock proteins in cancer : diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperones 2005; 10 : 86–103. |