| |
| Med Sci (Paris). 2008 January; 24(1): 102–104. Published online 2008 January 15. doi: 10.1051/medsci/2008241102.Cellules iPS humaines : Déjà ! Laure Coulombel* Médecine/Sciences et Inserm U602, Hôpital Paul Brousse, 94817 Villejuif Cedex, France MeSH keywords: Animaux, Différenciation cellulaire, Division cellulaire, Humains, Souris, Modèles biologiques, Cellule souche pluripotente, Transplantation de cellules souches |
L’année 2007 a consacré, par le prix Nobel de Médecine, Martin Evans, pionnier de la dérivation des cellules ES murines, et ses collègues Mario Capecchi et Oliver Smithies [
1] (→). (→) m/s 2007, n° 12, p. 1159
Elle s’est achevée sur une promesse scientifique tout aussi importante, celle des cellules iPS (induced pluripotent stem cells), confirmation chez l’homme de la reprogrammation de cellules somatiques adultes en cellules « pluripotentes » par la simple expression dans ces cellules de 4 protéines responsables dans les cellules ES du maintien de l’état pluripotent. Nous avions discuté en détail dans ces colonnes les observations fascinantes faites chez la souris en juin 2006 par une équipe japonaise [
2,
3] (→), rapidement confirmés par d’autres équipes [
4–
6]. Il n’aura donc fallu que quelques mois à l’équipe japonaise pionnière [
7], et à une équipe américaine [
8], pour confirmer ces données chez l’homme, et ouvrir tout un champ de possibles dans le domaine cognitif et thérapeutique, que 2008 verra sans doute germer. (→) m/s 2007, n° 6-7, p. 667
|
Autorenouvellement des cellules pluripotentes : un processus très conservé La stratégie expérimentale utilisée par les Japonais du groupe de Yamanaka pour « reprogrammer » les cellules humaines est calquée sur celle que ces auteurs avaient utilisée pour reprogrammer les cellules murines [3] : transduction, via un vecteur rétroviral, des séquences ADNc codant pour 4 facteurs de transcription, OCT3/4, SOX2, Klf4 et c-Myc. L’équipe américaine du pionnier des cellules souches embryonnaires humaines, J. Thomson, quant à elle, a fait sa propre sélection parmi les multiples gènes les plus exprimés dans les cellules ES, en choisissant ceux qui entraînaient la réactivation du promoteur OCT3/4 dans une lignée de cellules ES différenciées en cellules myéloïdes. La meilleure combinaison retenue associe OCT3/4, SOX2, NANOG et LIN 28 (c-myc est absent) [8]. A. Pollesskaya avait récemment fait état du rôle de Lin 28 dans la régulation musculaire dans ces colonnes [
9]. Dans les deux approches, les facteurs clés sont OCT3/4 et SOX2, tandis que c-Myc, Klf4, Nanog et Lin 28 ne servent que d’amplificateurs du processus. De plus, SOX2, Klf4 et c-Myc, mais pas OCT3/4, peuvent être partiellement substitués par d’autres membres de ces familles protéiques. L’expression de c-MYC exogène ne semble pas indispensable, puisqu’il ne fait pas partie de la combinaison utilisée par l’équipe de J Thomson ; c-myc est de plus responsable de l’émergence de tumeurs dans près de 20 % des souris chimériques issues des cellules iPS, et les collaborateurs de Yamanaka ont également obtenu des cellules iPS après transduction de OCT3/4, SOX2, et kLF4 uniquement, quoiqu’avec une efficacité 10 fois moindre [
10]. Le gène c-myc endogène étant activé, il est possible qu’un certain taux de la protéine soit requis [10]. Dans les expériences actuelles, chacune des séquences de ces facteurs de transcription est introduite dans les cellules humaines adultes via un rétrovirus murin (équipe japonaise) ou un lentivirus (équipe américaine). Seuls des fibroblastes humains ont été utilisés jusqu’à présent : lignées établies de fibroblastes fœtaux (IMR90) ou de nouveau-né dans le cas de l’étude américaine, lignées de fibroblastes de nouveau-né (BJ), ou fibroblastes adultes primaires issus du derme de la face, ou fibroblast-like synoviocytes dans le cas de l’étude japonaise. Ces auteurs se sont d’ailleurs heurtés à la difficulté de transduire efficacement des fibroblastes primaires, obligeant à des acrobaties techniques dont l’expression ectopique du récepteur des rétrovirus murins écotropes dans les fibroblastes humains [7]. Il est évident, si une perspective thérapeutique est envisagée, qu’il faudra s’affranchir de ces vecteurs viraux et trouver un moyen d’expression transitoire (ce qui suffit) de ces protéines. Il convient également maintenant d’identifier leurs cibles, certaines histone déméthylases pourraient être de bonnes candidates [
11], et de trouver comment les activer directement, par voie pharmacologique. |
Caractérisation des cellules iPS humaines Il y a parfois du Prévert dans la biologie. Une fois les cellules transduites, elles sont transférées dans le milieu de culture habituel des lignées de cellules ES de primate ou humaines (en présence de bFGF), et puis il faut attendre… « sans rien dire, sans bouger… Parfois l’oiseau arrive vite… » : Dans un délai de 12 à 30 jours (selon la combinaison de gènes utilisée), des colonies ayant les caractéristiques morphologiques si particulières des colonies de cellules ES s’organisent et sont détectables dans les boîtes de culture. Ces colonies sélectionnées « à l’œil » sont prélevées, amplifiées, et caractérisées. Les auteurs japonais signalent l’émergence d’une autre catégorie de colonies, « granuleuses », plus abondantes mais dont la signification est inconnue. La fréquence de ces colonies iPS est d’environ 1/5-10 000 fibroblastes, ce qui n’est pas négligeable, et permet l’obtention d’un grand nombre de colonies, compte tenu de l’abondance des cellules de départ [7, 8]. Comme les cellules iPS murines, les cellules iPS humaines expriment les antigènes de surface caractéristiques des cellules ES pluripotentes (SSEA3, SSEA4, Tra160, Tra1-80, phosphatase alcaline), forment des tératomes après leur injection à des souris immunodéficientes, et des corps embryonnaires in vitro lorsqu’elles sont sevrées de cellules nourricières et de bFGF, témoignant de l’engagement dans un processus de différenciation dans les trois feuillets embryonnaires. L’analyse du potentiel de différenciation de ces iPS humaines est encore très incomplète, et limitée à l’expression de marqueurs moléculaires associés aux trois feuillets embryonnaires ou à l’observation de phénotypes évidents comme la présence d’îlots de cellules « battantes » indiquant un certain degré de différenciation cardiomyocytaire [7]. Cette différenciation s’accompagne généralement d’une extinction de l’expression des gènes OCT4 et NANOG exogènes et endogènes ; mais certains clones établis à partir de fibroblastes de la peau de nouveau-nés (mais pas des IMR 90) se comportent différemment, avec persistance d’une expression élevée d’OCT4 et de NANOG, peut-être en relation avec un site particulier d’insertion du rétrovirus. Une différenciation de moindre efficacité à partir de fibroblastes d’individus âgés est aussi suggérée dans l’étude japonaise. L’analyse par microarray du profil d’expression génique des cellules iPS confirme qu’il est plus proche de celui de cellules ES que de celui des fibroblastes de départ, malgré quelques différences. Comme c’était le cas pour les cellules iPS de souris, l’expression des transgènes utilisés pour enclencher le processus s’éteint, mais elle est compensée par celle, très élevée, des gènes OCT3/4, NANOG, SOX2 endogènes. Tout se passe comme si, une fois enclenché, le processus se pérennisait de façon autonome, peut-être comme dans les cellules ES, via la boucle d’autorégulation de ces gènes de pluripotence [
12]. L’analyse épigénétique n’a pas été faite de façon détaillée dans les iPS humaines mais il y a fort à parier qu’elle dupliquera ce qui a été observé dans les iPS de souris [4–6] : les japonais mentionnent la méthylation des dinucléotides CpG des promoteurs OCT4 et NANOG endogènes, une déméthylation de la lysine K27 de l’histone H3 dans ces régions, et la présence de marques bivalentes caractéristiques des cellules ES, associant notamment une méthylation activatrice de la lysine K4 et répressive de la lysine K27 dans les régions des promoteurs Gata6, Msx2, Pax6 et Hand1 [
13]. |
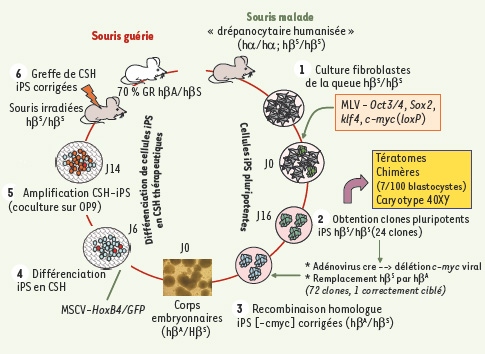
Première preuve de concept d’une utilité thérapeutique des iPS R. Jaenish pouvait difficilement être absent de cette compétition américano-japonaise, et il vient de publier dans Science la preuve de concept d’une utilisation thérapeutique possible de ces cellules iPS chez la souris [
14] (Figure 1). Cet article est presque le miroir de celui que son équipe avait publié dans Cell en 2002 [
15] dans lequel il établissait la preuve de concept d’une réparation génétique de lignées de cellules ES Rag2-KO obtenues après… transfert nucléaire de noyaux de fibroblastes dans des ovocytes. Aujourd’hui, ils dérivent (via la transduction des ADNc OCT3/4, SOX2, klf4, et cmyc-lox) des cellules iPS à partir de fibroblastes de souris « drépanocytaires humanisées ». Dans ces souris, les gènes de globine α et β ont été remplacés par les gènes humains hα/hα et hAγ et hβ
S
(s = sickle) respectivement, permettant d’obtenir (après le switch de l’hémoglobine) des souris adultes homozygotes hβS/hβS, anémiques et atteintes d’anomalies tubulaires rénales. La correction d’un allèle hβ
S
par le gène hβ
A
sauvage a été effectuée par recombinaison homologue dans l’un des 24 clones iPS hβS/hβS, clone utilisé ensuite pour reconstituer les lignées hématopoïétiques de souris receveuses hβS/hβS irradiées (Figure 1). L’induction de la différenciation hématopoïétique a été induite dans ce clone iPS via la formation de corps embryonnaires, et stimulée par la transduction de HoxB4, qui amplifie efficacement les cellules souches hématopoïétiques à partir des cellules ES murines. Ces cellules souches hématopoïétiques issues de cellules « iPS-HoxB4-hβA », injectées à des souris hβS/βS syngéniques irradiées, ont efficacement reconstitué un système hématopoïétique comme en témoignent : (1) le retour, au moins pendant douze semaines, des paramètres hématologiques au niveau de ceux d’hétérozygotes hβA/hβS (correction de l’anémie, diminution des réticulocytes, diminution de l’anisocytose et de la poïkilocytose, correction de la macrocytose…), (2) la présence de 65 % d’HbA, et (3) la correction des anomalies rénales. Cerise sur le gâteau, le transgène c-myc a été éliminé par un adénovirus cre avant l’utilisation « thérapeutique » du clone iPS.  | Figure 1.
Première preuve de concept d’une utilité thérapeutique des iPS murines. Des clones iPS (colonies vertes) sont obtenus à partir de fibroblastes (cellules grises) de la queue de souris « drépanocytaires » après l’expression de 4 ADNc codant pour OCT3/4, SOX2, Klf4, c-Myc (avec une séquence lox permettant d’exciser le transgène), insérés dans le génome via un oncorétrovirus murin (MLV : murine leukemia virus). Ces clones iPS dont le caryotype est normal ont toutes les caractéristiques décrites [ 3] et génèrent des chimères viables après leur transfert dans un blastocyste réimplanté dans l’utérus d’une femelle gravide [ 14] (rectangle jaune). Un des clones est traité par un adénovirus portant cre pour exciser l’oncogène exogène c-myc-lox, puis les cellules sont corrigées par une recombinaison homologue (hβ S → hβ A) (cellules bleues) et la différenciation est induite dans les corps embryonnaires.L’engagement vers la lignée hématopoïétique est stimulé par la transduction de l’ADNc HoxB4 via un oncorétrovirus murin MSCV ( murine stem cell virus). Ces cellules souches hématopoïétiques (CSH, points rouges) issues des iPS corrigées (hβ S/hβ A) sont ensuite amplifiées sur la lignée stromale OP-9, puis injectées à des souris hβ S/hβ S irradiées (souris grises). Le système hématopoïétique de ces souris est reconstitué (70%) et, en particulier, les globules rouges (GR) expriment l’hémoglobine adulte normale, et l’anémie est corrigée (souris blanche) [ 14]. |
Cet article a fait la « une » de la grande presse. Cet honneur aurait plutôt dû revenir à l’article initial de Takahashi, passé presque inaperçu en 2006, ce qui était fort injuste car c’est à cette équipe que revient le mérite de la découverte originale que les autres équipes exploitent pour leur propre démarche. L’étude de R. Jaenish est certes une prouesse technique efficace, et le modèle pathologique, dont la correction est rapidement visible par voie systémique, se prête à cette preuve de concept, mais c’est un peu frustrant et rapide… On aurait aimé, entre autres, en savoir un peu plus sur la différenciation hématopoïétique spontanée de ces cellules iPS en l’absence de HoxB4… Mais nous sommes dans une compétition, et gare à l’avalanche en 2008 de guérisons de souris ! |
S’il se confirme que l’on peut obtenir « simplement » à partir de fibroblastes adultes (et peut-être d’autres types cellulaires) des lignées de cellules pluripotentes iPS, ouvrant ainsi la voie à l’obtention de cellules thérapeutiques « à la carte et compatibles » pour chaque patient, nul doute qu’un obstacle immense sera franchi, qui bouleversera notre approche de thérapie cellulaire, une fois maîtrisés les risques inhérents à cette stratégie. Les cellules iPS se substitueront, du moins pour l’application thérapeutique, aux lignées ES obtenues par transfert de noyaux somatiques dans des ovocytes. Outre les problèmes posés par la source d’ovocytes, cette technique n’a pas, à ce jour, démontré son efficacité chez l’homme, puisque aucune lignée ES humaine n’a été dérivée par cette stratégie (qui est relativement efficace chez la souris ou d’autres mammifères), et il est irréaliste d’anticiper son application à large échelle dans un but de créer des lignées thérapeutiques à façon. Peut-être les embryologistes, comme J.B. Gurdon, n’ont-ils pas été surpris : en 1962, J.B. Gurdon publiait les résultats d’expériences pionnières sur le transfert de noyau somatique dans des œufs de xénope, et l’obtention de grenouilles normales. Dans une revue autobiographique publiée en 2006 [
16], un mois avant la publication de Takahashi, il anticipait « it may become possible to convert cells of an adult to an embryonic state without needing to use eggs. Overexpression of a DNA demethylase and other reprogramming molecules may be sufficient to generate ES-like cells »1. Nous y sommes !

|
Footnotes |
1. Cohen-Tannoudji M. Prix Nobel de médecine 2007. Des souris mutantes à façon. Med Sci (Paris) 2007; 23 : 1159–61. 2. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006; 126 : 663–76. 3. Coulombel L. Reprogrammation nucléaire d’une cellule différenciée : on efface tout et on recommence. Med Sci (Paris) 2007; 23 : 667–70. 4. Wernig M, Meissner A, Foreman R, et al.
In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 2007; 448 : 318–24. 5. Okita K, Ichisaka T, Yamanaka S. Generation of germline-competent induced pluripotent stem cells. Nature 2007; 448 : 313–7. 6. Maherali N, Sridharan R, Xie W, et al. Directly reprogrammed fibroblasts show global epiegnetic remodeling and wides spread tissue scontribution. Cell Stem Cell 2007; 1 : 55–70. 7. Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007; 131 : 861–72. 8. Yu J, Vodyanik MA, Smuga-Otto K, et al. Induced pluripotent stem cell lines derived from human somatic cells. Science 2007; 318 : 1917–20. 9. Polesskaya A, Harel-Bellan A. A novel role for an embryonic regulatory protein Lin-28 in adult skeletal muscle differentiation. Med Sci (Paris) 2007; 23 : 796–7 10. Nakagawa M, Koyanagi M, Tanabe K, et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nat Biotechnol 2007; 30 novembre online. 11. Niwa H. Open conformation chromatin and pluripotency. Genes Dev 2007; 21 : 2671–6. 12. Loh YH, Wu Q, Chew JL, et al. The OCT4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells. Nat Genet 2006; 38 : 431–40. 13. Szutorisz H, Dillon N, Tora L. Le protéasome limite la transcription dans les cellules souches embryonnaires. Med Sci (Paris) 2007; 23 : 351–3. 14. Hanna J, Wernig M, Markoulaki S, et al. Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin. Science 2007; 318 : 1920–3. 15. Rideout WM 3rd, Hochedlinger K, Kyba M, Daley GQ, Jaenisch R. Correction of a genetic defect by nuclear transplantation and combined cell and gene therapy. Cell 2002; 109 : 17–27. 16. Gurdon JB. From nuclear transfer to nuclear reprogramming : the reversal of cell differentiation. Ann Rev Cell Dev Biol 2006; 22 : 1–22. 17. Park IH, Zhao R, West JA, et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature 2007; 23 décembre online. |