La formation des voies axonales précoces est une étape essentielle du câblage cérébral [ 1] ; elle requiert des interactions entre les cônes de croissance et l’environnement et plusieurs facteurs guident les axones dans leur progression, comme des molécules extracellulaires, des cellules jalons [ 2], ou des interactions de fibre à fibre [ 3]. Un des carrefours les plus importants, étudié depuis des décennies, est la capsule interne (CI) qui relie le cortex aux autres structures cérébrales, et par laquelle cheminent les fibres originaires du thalamus et destinées au cortex, et les efférences qui quittent le cortex pour gagner diverses cibles sous-corticales dont le thalamus, le tectum, le pont, le bulbe et la moelle.
La CI et plusieurs autres grandes voies sont absentes chez les souris mutantes Celsr3 (Cadherin, EGF-like, LAG-like seven pass receptor) [ 4]. Comme Celsr1 et Celsr2, Celsr3 est une cadhérine à sept segments transmembranaires, exprimée durant le développement du cerveau par les neurones post-mitotiques. Pour mieux comprendre le rôle de Celsr3 dans le développement de la CI, nous avons développé un allèle conditionnel qui nous a permis d’inactiver le gène spécifiquement dans différents territoires du cerveau, par croisement avec des souris qui expriment la recombinase Cre dans le cerveau antérieur (Cre sous le contrôle de foxg1) [ 5], dans le cortex (Emx1) [ 6] et dans divers secteurs du télencéphale ventral sous l’action des éléments de régulation de Nkx2.1, Gsh2 [ 7], et Dlx5/6 [ 8].
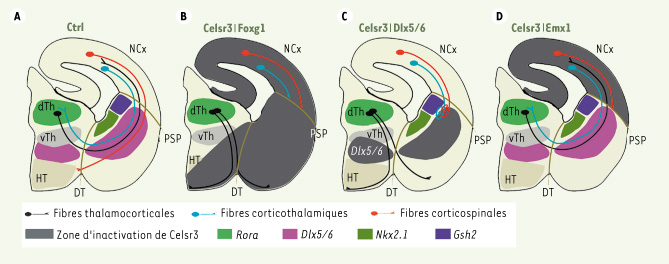
Chez les souris Celsr3|Foxg1, Celsr3 est inactivé dans le télencéphale mais pas dans le thalamus dorsal. Pourtant, toutes les composantes de la CI sont entièrement défectueuses (Figure 1B) indiquant que l’expression de Celsr3 dans les neurones du thalamus dorsal ne suffit pas au guidage de leurs axones vers le cortex. Le rôle de Celsr3 dans le télencéphale ventral a été étudié chez des souris Celsr3|Dlx5/6-Cre, où Cre est exprimée dans tout le cerveau antérieur ventral. La CI est aussi complètement absente chez ces animaux (Figure 1C). Lorsque Celsr3 est inactivé dans le cortex, les fibres corticothalamiques et thalamocorticales se développent normalement, indiquant que les axones corticothalamiques sont aidés dans leur progression par des mécanismes indépendants de Celsr3, par exemple une interaction avec les afférences thalamiques [ 9]. Les fibres corticothalamiques et thalamocorticales franchissent les limites entre pallium et sous-pallium, et entre diencéphale et télencéphale, respectivement. Cependant, ces fibres sont incapables de s’engager dans le « corridor » [ 10]. Cette expérience démontre l’importance de Celsr3 dans les cellules jalons du télencéphale et du diencéphale ventraux. Pour mieux définir l’identité de ces cellules jalons, nous avons produit des souris Celsr3|Gsh2-et Nkx2.1 qui expriment Cre dans des secteurs des éminences ganglionnaires. Chez ces souris, toutes les composantes de la CI sont normales, suggérant que ces cellules sont engendrées à partir de précurseurs qui n’expriment pas Gsh2 ou Nkx2.1.
| Figure 1.
Rôle de Celsr3 dans le développement de la CI. A. La CI est composée de fibres cortico-sous-corticales comme les fibres corticothalamiques (bleu) et corticospinales (rouges) ainsi que les fibres thalamocorticales (noir). B. L’inactivation de Celsr3 dans le cortex, le télencéphale ventral et le diencéphale ventral sous l’action de Foxg1-Cre (gris) empêche le développement de toutes les composantes de la CI. C. Lorsque Celsr3 est inactivé dans des secteurs du télencéphale ventral et du diencéphale ventral sous l’action de Dlx5/6-Cre (gris), les fibres corticofuges et thalamocorticales traversent les frontières entre le pallium et le sous-pallium et entre le diencéphale et le télencéphale respectivement mais ne peuvent pas s’engager dans le corridor. D. L’inactivation de Celsr3 dans le cortex cérébral par croisement avec des souris Emx1-Cre n’affecte pas les connexions thalamocorticales mais empêche le développement du faisceau corticospinal. Ctrl : contrôle ; DT : frontière entre le diencéphale et le télencéphale ; dTh : thalamus dorsal ; HT : hypothalamus ; NCx : néocortex ; PSP : frontière entre le pallium et le sous-pallium ; vTh : thalamus ventral. |
L’inactivation de Celsr3 dans le cortex a été réalisée chez des souris Celsr3|Emx1 (Figure 1D). Chez ces mutants, la voie corticospinale est défectueuse. Par contre, les connexions thalamocorticales réciproques sont normales. Les axones thalamiques atteignent leur destination dans le cortex somatosensoriel et y induisent la formation des barils1,, caractéristiques des aires somatosensitives primaires. Ces résultats montrent que Celsr3 est nécessaire au développement de la voie corticospinale, mais facultatif pour le guidage des axones des neurones de la couche 6 qui projettent vers le thalamus dorsal. En l’absence de Celsr3, ces axones utiliseraient des mécanismes alternatifs. Une possibilité serait que, chez les souris Celsr3|Emx1, la présence de Celsr3 dans le thalamus dorsal et le télencéphale basal permet une progression normale des axones thalamiques qui pourraient rencontrer leurs homologues en provenance du cortex et les aider dans leur progression vers le thalamus, comme proposé par l’hypothèse dite du « handshake » [2]. Il serait très utile de procéder à l’expérience réciproque, c’est-à-dire d’inactiver Celsr3 dans le thalamus. Si l’hypothèse du handshake est correcte, cette inactivation ne devrait pas affecter les projections thalamocorticales réciproques ; en revanche, l’inactivation de Celsr3 à la fois dans le cortex et dans le thalamus devrait empêcher le développement de ces projections. Malheureusement, il n’existe pas de lignée Cre qui permet de recombiner suffisamment tôt dans tout le thalamus dorsal. Une autre possibilité serait que les axones corticothalamiques interagissent non pas avec les fibres thalamiques, mais plutôt avec les cellules jalons tout au long de leur parcours du cortex vers le thalamus. Dans les deux cas, cette interaction doit impliquer d’autres molécules que Celsr3. Un bon candidat est la protéine Celsr2 qui est exprimée de manière redondante avec Celsr3 dans les neurones de la couche 6 du cortex. L’utilisation des doubles mutants Celsr2/Celsr3 permettrait de tester cette hypothèse.