| |
| Med Sci (Paris). 2008 December; 24(12): 1071–1076. Published online 2008 December 15. doi: 10.1051/medsci/200824121071.Étude de la réaction immunitaire humorale aux cancers par des approches protéomiques Caroline Desmetz,* Alain Mangé, and Jérôme Solassol* CHU de Montpellier, Hôpital Arnaud de Villeneuve, Laboratoire de biologie cellulaire et hormonale, Hôpital Arnaud de Villeneuve, 191, avenue du Doyen Giraud, 34295 Montpellier Cedex 5, France Bâtiment de Recherche CRLC, Val d’Aurelle, Parc Euromédecine, 208, rue des Apothicaires, 34298 Montpellier Cedex 5, France Laboratoire d’Oncoprotéomique Clinique, 208, rue des apothicaires, 34298 Montpellier Cedex 5, France Université Montpellier I, Faculté de médecine, Montpellier, France |
La découverte de nouveaux marqueurs sériques offrant une sensibilité et une spécificité supérieures à celles des marqueurs actuels est un axe de recherche essentiel en cancérologie. À l’exception de l’hormone chorionique gonadotrope (hCG) chez l’homme, il n’existe pas de marqueur spécifique d’une tumeur, mais plutôt des molécules dont la présence à forte concentration est associée au cancer. La plupart des marqueurs biologiques utilisés à l’heure actuelle, bien que présentant une certaine spécificité « histologique », ne sont pas spécifiques d’un organe particulier. Ils présentent de plus une sensibilité insuffisante en termes de diagnostic, leurs valeurs biologiques s’élevant, pour la plupart d’entre eux, exclusivement dans les formes avancées de la maladie. C’est pourquoi l’intérêt clinique des marqueurs tumoraux sériques actuels réside essentiellement dans leur aide pour la surveillance de l’efficacité thérapeutique dans les formes avancées (et notamment métastatiques) de cancers. Une des voies très prometteuses dans ce domaine est l’étude de la réponse immunitaire aux cancers et l’identification des anticorps et des antigènes associés aux tumeurs (AAT). Dans les années 1960, Robert W. Baldwin a été un pionnier dans ce domaine, en démontrant que le système immunitaire pouvait réagir au développement d’une tumeur [
1–
3]. Cette réponse immunitaire engage à la fois une réponse cellulaire (activation des lymphocytes T) et une réponse humorale (synthèse d’anticorps) [
4,
5]. Bien que les origines de cette dernière soient peu connues, il est maintenant bien établi que des patients atteints de cancer produisent des autoanticorps dirigés contre des protéines tumorales mutées, tronquées, mal conformées, surexprimées ou encore exprimées de façon ectopique. L’identification des protéines antigéniques et de leurs anticorps associés apparaît désormais comme une stratégie de choix dans la recherche de nouveaux marqueurs tumoraux circulants. L’outil protéomique et ses développements récents ont permis l’identification d’un grand nombre de ces protéines et de leurs anticorps associés [
40,
41]. L’objectif de cette revue est de présenter les différentes approches protéomiques développées dans ce domaine, et de les illustrer par des exemples de nouveaux marqueurs (antigènes et/ou anticorps) ainsi isolés. |
Analyse sérologique des banques d’expression d’ADNc Le SEREX (serological identification of antigens by recombinant expression cloning) est la première technique développée pour l’analyse de la réponse humorale aux cancers. Mise au point dans les années 1990 [
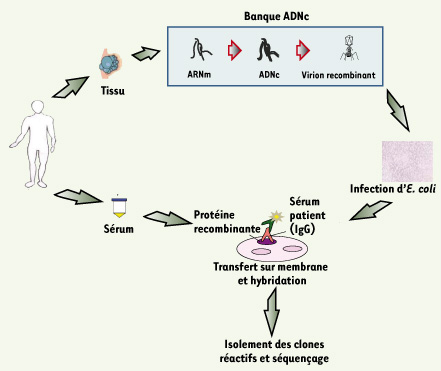
6], cette approche consiste à analyser les antigènes provenant de l’expression d’une banque d’ADNc obtenue à partir des ARNm extraits d’une tumeur (Figure 1). Le succès de cette approche pour l’identification des AAT est très probablement attribuable au choix de la source d’ARNm provenant de la tumeur autologue, ce qui facilite l’identification des antigènes réagissant avec les auto-anticorps présents dans le sérum autologue. 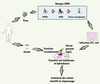 | Figure 1.
Principe de l’approche SEREX. Cette approche consiste à extraire les ARNm à partir d’une tumeur. Les ADNc double brin correspondants sont ensuite synthétisés et insérés dans le génome du bactériophage λ. Après amplification, les virions recombinants sont introduits dans des bactéries E. coli. Les protéines recombinantes exprimées durant la phase lytique de l’infection des phages sont transférées sur une membrane de nitrocellulose, laquelle est ensuite incubée avec le sérum du même patient que celui dont a été extraite la tumeur (sérum autologue). Les clones réactifs sont ensuite isolés et l’ADNc correspondant est séquencé. |
Cette technique, très puissante, a permis d’isoler plusieurs autoanticorps et d’identifier leurs antigènes associés. La protéine NY-ESO-1 est l’un des premiers auto-antigènes à avoir été mis en évidence ; elle a été étudiée initialement dans le carcinome squameux de l’œsophage [
7]. Les anticorps anti-NY-ESO-1 ont été ensuite détectés avec une fréquence variant entre 20 et 50 % dans d’autres cancers comme le cancer bronchique non à petites cellules [
8], le cancer de la prostate [
9], le cancer médullaire de la thyroïde [
10] et le mélanome [
11]. Par la suite, d’autres AAT ont été étudiés, comme la protéine CAGE-1 (cancer/testis antigen gene) dans le cancer du poumon [
12], NY-BR-1, ING1 et hMena dans le cancer du sein [
13,
14], GLEA1 (glioma expressed antigen 1), GLEA2 et PHF3 (PHD finger protein 3) dans le glioblastome [
15]. Il est intéressant de mentionner que certains de ces autoanticorps présentent un intérêt comme marqueurs diagnostiques précoces ou marqueurs prédictifs d’une réponse thérapeutique. C’est le cas des anticorps anti-NY-ESO-1, présents dès les formes précoces de cancer du poumon [8], ou pour les anticorps anti-GLEA2 et anti-PHF3, associés à un pronostic favorable chez les patients atteints d’un glioblastome [15]. Malgré ces résultats très prometteurs, le SEREX présente plusieurs inconvénients, inhérents pour la plupart à la technique. À l’origine, cette approche a été développée afin d’étudier la réponse humorale anticancéreuse à partir de prélèvements (tissu tumoral et sérum) issus d’un seul et même patient. Il en découle d’une part, une lourdeur dans sa mise en œuvre, avec la constitution d’une banque d’expression pour chaque sérum autologue analysé et, d’autre part, une détection de nombreux faux positifs, due à l’analyse d’une réponse humorale spécifique au patient et non obligatoirement liée au processus tumoral. De plus, le choix d’un système procaryote pour l’expression des protéines recombinantes ne permet pas la détection des protéines immunogènes ayant subi des modifications post-traductionnelles ou conformationnelles, alors que ces modifications sont souvent retrouvées chez les eucaryotes dans les réactions auto-immunes ou les cancers. Afin de pallier ces écueils, plusieurs modifications de la technique originelle ont été proposées, notamment l’utilisation de systèmes d’expression protéique dans des modèles eucaryotes (baculovirus ou levure) permettant d’analyser les modifications post-traductionnelles comme les glycosylations. Le SEREX reste, grâce à ces améliorations, une technique de référence pour l’étude de la réponse immunitaire humorale à la présence de cellules tumorales. Elle a permis l’identification d’un très grand nombre d’antigènes tumoraux dont l’intérêt clinique, pour beaucoup d’entre eux, reste encore à évaluer. L’ensemble des AAT identifiés par SEREX est régulièrement mis à jour dans une base de données disponible sur le site internet http://www.2.licr.org/CancerImmunomeDB/. |
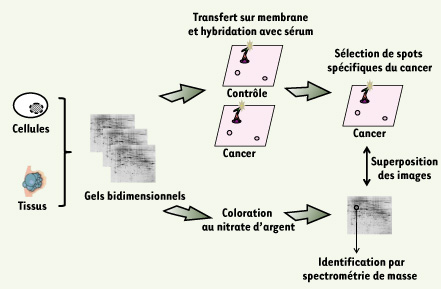
Analyse sérologique à partir des techniques de protéomique conventionnelle Depuis plusieurs décennies, l’électrophorèse bidimensionnelle (2-DE) est l’un des outils de choix dans l’analyse du protéome. Cette technique permet de séparer un mélange complexe de protéines, extraites de tumeurs ou de cultures cellulaires, en fonction de leur point isoélectrique (pI) (première dimension) et en fonction de leur masse (deuxième dimension). L’équipe de S. Hanash a été l’une des premières à combiner l’électrophorèse bidimensionnelle et la technique de western blot (Figure 2) pour identifier les antigènes associés à la réponse humorale dans les neuroblastomes [
16] et le cancer du poumon [
17]. Dans cette dernière étude, les annexines I et II ont été identifiées comme des antigènes tumoraux induisant une réponse humorale chez plus de 60 % des patients atteints d’adénocarcinome. Cette approche, qui a été nommée par la suite SERPA (serological proteome analysis) [
18], Proteomex [
19,
20] ou SPEAR (serological and proteomic evaluation of antibody response) [
21], a été utilisée avec succès pour identifier des AAT dans plusieurs autres types de cancers. Sans vouloir être exhaustif, on peut citer, par exemple, la protéine peroxirédoxine 6 dans le carcinome squameux de l’œsophage [
22,
23], les protéines triosephosphate isomérase (Tim) et superoxyde dismutase (MnSOD) dans le carcinome squameux du poumon [22, 23], la calréticuline dans les cancers hépatique [
24] et du pancréas [
25] et RS/DJ1 dans le cancer du sein [
26]. 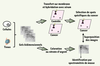 | Figure 2.
Principe de l’approche SERPA. Cette approche consiste à séparer en parallèle des quantités équivalentes de protéines issues de cultures cellulaires ou de tumeurs sur trois gels 2-DE. Les deux premiers gels sont transférés sur des membranes (nitrocellulose ou PVDF, polyvinylidene fluoride) avant d’être hybridés avec des sérums provenant de patients atteints de cancer ou d’individus contrôles. Le troisième gel est quant à lui coloré au nitrate d’argent ou au bleu de Coomassie afin d’établir la cartographie des protéines de la tumeur. La stratégie consiste dans un premier temps à comparer les images obtenues par Western blot à partir des deux échantillons de sérums (cancer et contrôle) afin de repérer les protéines immunogènes spécifiques de la réaction humorale tumorale. Dans un deuxième temps, les images issues des Western blots sont superposées au gel coloré au nitrate d’argent afin d’isoler et identifier les protéines d’intérêt. Pour cela, les protéines sont extraites du gel, digérées à la trypsine et identifiées par spectrométrie de masse (cartographie peptidique ou séquençage). |
Comparé au SEREX, le SERPA présente plusieurs avantages. Il s’agit d’une technique rapide à mettre en œuvre, notamment pour la préparation des extraits protéiques et l’analyse de plusieurs sérums. Elle permet également l’identification d’éventuelles modifications post-traductionnelles et la mise en évidence des différentes isoformes d’une protéine. Les inconvénients de cette technique, quant à eux, sont pour la plupart associés aux limites du 2-DE. Ainsi, les protéines membranaires, en raison de leur nature hydrophobe et insoluble, sont difficilement détectables. Il en est de même pour les protéines de faible poids moléculaire (inférieur à 10 000 Da) ou pour les protéines ayant un point isoélectrique extrême. Enfin, l’identification des protéines de faible abondance est limitée par la sensibilité des méthodes de coloration. Il est néanmoins possible d’enrichir spécifiquement les antigènes tumoraux faiblement exprimés par des approches d’immunoprécipitation [
27] et d’utiliser des molécules fluorescentes plus sensibles que les méthodes de coloration standard [
28]. Cette combinaison a été utilisée récemment avec succès pour identifier des AAT dans le cancer de l’ovaire [
29]. Le SERPA demeure donc une méthode très robuste pour la mise en évidence d’une réponse immune de type humoral dans les cancers, d’autant que de nombreuses améliorations technologiques ont été introduites ces dernières années, notamment dans la robotisation des techniques de 2-DE ou l’amélioration de la sensibilité des spectromètres de masse permettant l’identification des antigènes. |
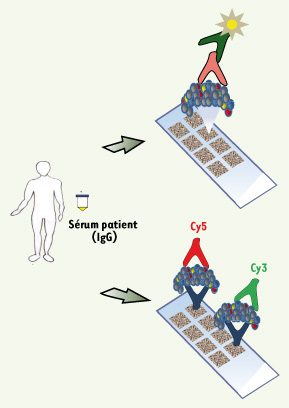
Analyse sérologique par puces à protéines Le succès rencontré par les approches de type puces à ADN pour l’analyse du génome a très rapidement inspiré ces dernières années les groupes de recherche qui étudient la réponse humorale en cancérologie ou dans d’autres pathologies. Ces nouvelles approches de type puces à protéines permettent, contrairement au SEREX ou au SERPA, l’analyse d’un très grand nombre de cibles en une seule étape. L’équipe de Liu a été la première à développer cette approche pour l’étude de la réponse humorale associée aux maladies auto-immunes [
30]. Le principe de cette approche consiste à immobiliser des antigènes ou des anticorps sur un support (lame) et à faire l’analyse différentielle des interactions auto-antigène-auto-anticorps qui se forment (Figure 3). Des puces à protéines permettant de tester plus de 8 000 antigènes recombinants ont ainsi été développées et sont désormais commercialisées (puces ProtoArray®, Invitrogen) [
31]. Des puces à anticorps, fondées sur un système de capture inverse, ont également été mises au point [
32]. Dans une étude récente, les antigènes issus de lignées cellulaires de cancer de la prostate ont ainsi été capturés par 500 anticorps monoclonaux immobilisés sur une même lame. Les sérums de patients atteints de cancer de la prostate ou d’hyperplasies bénignes (contrôles) ont été marqués au préalable par deux fluorochromes (Cy3 et Cy5) puis hybridés sur les puces, permettant ainsi l’identification de 48 AAT [
33].  | Figure 3.
Principe de base des puces à protéines. Les puces à protéines se fondent sur l’immobilisation d’anticorps ou d’antigènes (protéines recombinantes, peptides, etc.) sur un support solide. Ces lames sont ensuite hybridées avec les sérums de patients et révélées par chimioluminescence ou fluorescence. Il est ainsi possible de détecter de manière différentielle les protéines de deux populations de sérums sur une même lame en marquant chacun des échantillons par la cyanine 3 (Cy3, fluorescence verte), ou la cyanine 5 (Cy5, fluorescence rouge). Ces lames sont ensuite scannées avec les deux longueurs d’ondes des fluorochromes afin d’être comparées et quantifiées. |
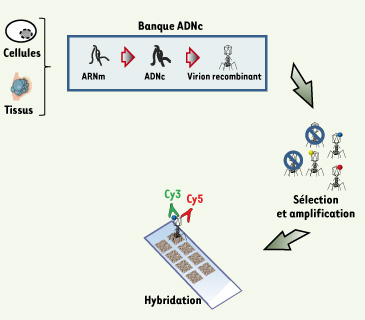
Bien que ces deux approches soient très puissantes, elles présentent néanmoins une limitation importante qui est celle de la disponibilité des anticorps et des protéines recombinantes commercialisés. Pour éviter ces écueils, des méthodes plus exhaustives ont été mises au point. La première, décrite par l’équipe de Chinnaiyan, propose d’isoler des antigènes associés à la réponse humorale dans le cancer de la prostate à partir de banques de phages exprimant des ADNc provenant des ARNm d’une tumeur (Figure 4) [
34]. L’étude, réalisée sur une série de 119 patients atteints de cancer de la prostate et 138 individus contrôles, a permis de sélectionner un panel de 22 peptides distinguant les deux groupes. De plus, ce test présente une sensibilité et une spécificité supérieures à celles du dosage de l’antigène spécifique de la prostate (marqueur diagnostique de référence dans le cancer de la prostate). Bien que très supérieure au SEREX en ce qui concerne la sélection des phages et le débit d’analyse, cette approche n’en présente pas moins un inconvénient principal, puisqu’il est en effet impossible de prendre en compte la réponse humorale dirigée contre des modifications post-traductionnelles ou conformationnelles des protéines tumorales. Afin de remédier à ce problème, l’équipe de S. Hanash a utilisé des techniques de fractionnement multidimensionnel par chromatographie liquide afin d’isoler un mélange de protéines natives issues de lignées cellulaires cancéreuses [
35]. Cette approche originale a permis d’identifier pour la première fois des anticorps dirigés contre l’ubiquitine carboxy-terminal hydrolase L3 dans des sérums de patients atteints de cancer du côlon [
36].  | Figure 4.
Principe des puces à protéines de type « phage ». Ce type de puces repose sur l’immobilisation de protéines exprimées à partir d’une banque d’ADNc. Comme pour le SEREX, les ADNc sont synthétisés à partir des ARNm issus de tumeurs ou de cultures cellulaires. Une fois insérée dans le génome des bactériophages λ, cette banque d’expression est enrichie en phages réagissant spécifiquement contre des sérums de patients atteints de cancer par des cycles répétés de purification. Ces phages réactifs sont alors amplifiés et déposés sur des lames. Ces lames sont ensuite hybridées avec des sérums de patients atteints de cancer et marqués par la cyanine 5 (Cy5) et l’intensité de marquage est normalisée à l’aide d’un anticorps marqué par la cyanine 3 et dirigé contre une protéine de la capside du phage. Après avoir scanné la lame, il est possible d’isoler les phages positifs et d’en extraire l’ADN afin d’identifier l’antigène correspondant. |
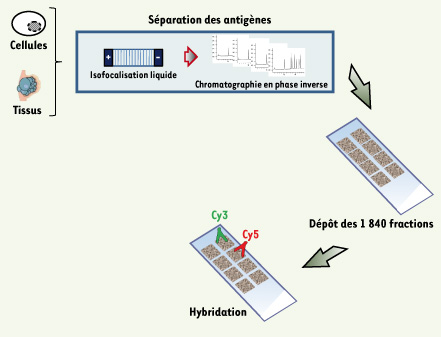
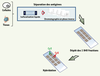 | Figure 5.
Principe des puces à protéines exhaustives. La source protéique pour la fabrication de ces puces provient de tumeurs ou de cultures cellulaires. Les protéines sont fractionnées dans un premier temps par isofocalisation électrique liquide (20 fractions). Chacune des fractions est ensuite séparée en 92 autres fractions sur une colonne de chromatographie liquide en phase inverse. Au final, les 1 840 fractions sont déposées sur un support solide avant d’être hybridées, comme précédemment, avec des sérums issus de patients atteints de cancer et d’individus contrôles. Il est alors possible de revenir à la fraction d’origine afin de valider la réactivité d’un antigène par western blot et de l’identifier par spectrométrie de masse. |
En résumé, ces approches novatrices par puces à protéines présentent de très nombreux avantages dans la recherche de marqueurs tumoraux associés à la réponse humorale, notamment en raison de leurs capacités d’analyse à haut débit. |
Les développements technologiques présentés dans cette revue illustrent l’intérêt de l’étude de la réponse immune humorale pour l’identification de nouveaux marqueurs en cancérologie. Ces technologies, en constante évolution, permettent d’identifier des anticorps et des AAT. L’impact clinique de ces marqueurs potentiels ne pourra s’évaluer sans la réalisation d’analyses complémentaires. En effet, les résultats de la littérature montrent que la plupart des anticorps identifiés jusqu’à présent ont non seulement des fréquences d’apparition relativement faibles (20-30 % des patients), mais sont également peu ou pas corrélés aux paramètres cliniques habituels (type histologique, stade de la tumeur, survie…). De ce fait, beaucoup de ces études nécessiteront des étapes de validation clinique dans des populations plus larges et indépendantes afin de déterminer la robustesse de marqueurs potentiels nouvellement identifiés en termes de sensibilité, de spécificité et de valeur prédictive. Les récents travaux publiés à partir des approches basées sur les puces à protéines annoncent certainement un avenir prometteur pour la mise en place de tests d’une sensibilité et d’une spécificité satisfaisantes. En effet, il apparaît que l’utilisation combinée de plusieurs anticorps ou antigènes permet de détecter les tumeurs avec une efficacité supérieure à celle de chaque marqueur pris isolément [34,
37–
39]. L’établissement de telles signatures moléculaires, associées aux données cliniques et anatomopathologiques, est l’un des défis technologiques qu’il faudra relever dans les prochaines années pour assurer des développements importants pour le diagnostic et le pronostic des cancers, fondés sur l’étude de la réponse humorale antitumorale. |
1. Baldwin RW. Tumour-specific immunity against spontaneous rat tumours. Int J Cancer 1966; 1 : 257–64. 2. Baldwin RW. An immunological approach to cancer. Lav Ist Anat Istol Patol Univ Studi Perugia 1968; 28 : 65–85. 3. Baldwin RW. Tumour-associated antigens and tumour-host interactions. Proc R Soc Med 1971; 64 : 1039–42. 4. Machour N, Gilbert D, Vittecoq O, et al. Protéomique et autoanticorps. Med Sci (Paris) 2005; 21 : 759–64. 5. Anderson KS, LaBaer J. The sentinel within: exploiting the immune system for cancer biomarkers. J Proteome Res 2005; 4 : 1123–33. 6. Sahin U, Tureci O, Schmitt H, et al. Human neoplasms elicit multiple specific immune responses in the autologous host. Proc Nal Acad Sci USA 1995; 92 : 11810–3. 7. Chen YT, Scanlan MJ, Sahin U, et al. A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening. Proc Natl Acad Sci USA 1997; 94 : 1914–8. 8. Tureci O, Mack U, Luxemburger U, et al. Humoral immune responses of lung cancer patients against tumor antigen NY-ESO-1. Cancer Lett 2006; 236 : 64–71. 9. Fossa A, Berner A, Fossa SD, et al. NY-ESO-1 protein expression and humoral immune responses in prostate cancer. Prostate 2004; 59 : 440–7. 10. Maio M, Coral S, Sigalotti L, et al. Analysis of cancer/testis antigens in sporadic medullary thyroid carcinoma: expression and humoral response to NY-ESO-1. J Clin Endocrinol Metab 2003; 88 : 748–54. 11. Stockert E, Jager E, Chen YT, et al. A survey of the humoral immune response of cancer patients to a panel of human tumor antigens. J Exp Med 1998; 187 : 1349–54. 12. Park S, Lim Y, Lee D, et al. Identification and characterization of a novel cancer/testis antigen gene CAGE-1. Biochim Biophys Acta 2003; 1625 : 173–82. 13. Jager D, Stockert E, Gure AO, et al. Identification of a tissue-specific putative transcription factor in breast tissue by serological screening of a breast cancer library. Cancer Res 2001; 61 : 2055–61. 14. Di Modugno F, Bronzi G, Scanlan MJ, et al., Human Mena protein, a serex-defined antigen overexpressed in breast cancer eliciting both humoral and CD8+ T-cell immune response. Int J Cancer 2004; 109 : 909–18. 15. Pallasch CP, Struss AK, Munnia A, et al., Autoantibodies against GLEA2 and PHF3 in glioblastoma: tumor-associated autoantibodies correlated with prolonged survival. Int J Cancer 2005; 117 : 456–9. 16. Prasannan L, Misek DE, Hinderer R, et al., Identification of beta-tubulin isoforms as tumor antigens in neuroblastoma. Clin Cancer Res 2000; 6 : 3949–56. 17. Brichory FM, Misek DE, Yim AM, et al. An immune response manifested by the common occurrence of annexins I and II autoantibodies and high circulating levels of IL-6 in lung cancer. Proc Natl Acad Sci USA 2001; 98 : 9824–9. 18. Klade CS, Voss T, Krystek E, et al. Identification of tumor antigens in renal cell carcinoma by serological proteome analysis. Proteomics 2001; 1 : 890–8. 19. Lichtenfels R, Kellner R, Atkins D, et al., Identification of metabolic enzymes in renal cell carcinoma utilizing PROTEOMEX analyses. Biochim Biophys Acta 2003; 1646 : 21–31. 20. Lichtenfels R, Kellner R, Bukur J, et al. Heat shock protein expression and anti-heat shock protein reactivity in renal cell carcinoma. Proteomics 2002; 2 : 561–70. 21. Unwin RD, Harnden P, Pappin D, et al. Serological and proteomic evaluation of antibody responses in the identification of tumor antigens in renal cell carcinoma. Proteomics 2003; 3 : 45–55. 22. Fujita Y, Nakanishi T, Hiramatsu M, et al. Proteomics-based approach identifying autoantibody against peroxiredoxin VI as a novel serum marker in esophageal squamous cell carcinoma. Clin Cancer Res 2006; 12 : 6415–20. 23. Yang F, Xiao ZQ, Zhang XZ, et al., Identification of tumor antigens in human lung squamous carcinoma by serological proteome analysis. J Proteome Res 2007; 6 : 751–8. 24. Le Naour F, Brichory F, Misek DE, et al. A distinct repertoire of autoantibodies in hepatocellular carcinoma identified by proteomic analysis. Mol Cell Proteomics 2002; 1 : 197–203. 25. Hong SH, Misek DE, Wang H, et al. An autoantibody-mediated immune response to calreticulin isoforms in pancreatic cancer. Cancer Res 2004; 64 : 5504–10. 26. Le Naour F, Misek DE, Krause MC, et al. Proteomics-based identification of RS/DJ-1 as a novel circulating tumor antigen in breast cancer. Clin Cancer Res 2001; 7 : 3328–35. 27. Hanash S. Harnessing immunity for cancer marker discovery. Nat Biotechnol 2003; 21 : 37–8. 28. Marouga R, David S, Hawkins E. The development of the DIGE system: 2D fluorescence difference gel analysis technology. Anal Bioanal Chem 2005; 382 : 669–78. 29. Gagnon A, Kim JH, Schorge JO, et al. Use of a combination of approaches to identify and validate relevant tumor-associated antigens and their corresponding autoantibodies in ovarian cancer patients. Clin Cancer Res 2008; 14 : 764–71. 30. Feng Y, Ke X, Ma R, et al. Parallel detection of autoantibodies with microarrays in rheumatoid diseases. Clin Chem 2004; 50 : 416–22. 31. Mattoon D, Michaud G, Merkel J, et al. Biomarker discovery using protein microarray technology platforms: antibody-antigen complex profiling. Expert Rev Proteomics 2005; 2 : 879–89. 32. Ehrlich JR, Qin S, Liu BC. The reverse capture autoantibody microarray: a native antigen-based platform for autoantibody profiling. Nat Protoc 2006; 1 : 452–60. 33. Miller JC, Zhou H, Kwekel J, et al. Antibody microarray profiling of human prostate cancer sera: antibody screening and identification of potential biomarkers. Proteomics 2003; 3 : 56–63. 34. Wang X, Yu J, Sreekumar A, et al. Autoantibody signatures in prostate cancer. N Engl J Med 2005; 353 : 1224–35. 35. Qiu J, Madoz-Gurpide J, Misek DE, et al. Development of natural protein microarrays for diagnosing cancer based on an antibody response to tumor antigens. J Proteome Res 2004; 3 : 261–7. 36. Nam MJ, Madoz-Gurpide J, Wang H, et al. Molecular profiling of the immune response in colon cancer using protein microarrays: occurrence of autoantibodies to ubiquitin C-terminal hydrolase L3. Proteomics 2003; 3 : 2108–15. 37. Chapman C, Murray A, Chakrabarti J, et al. Autoantibodies in breast cancer: their use as an aid to early diagnosis. Ann Oncol 2007; 18 : 868–73. 38. Koziol JA, Zhang JY, Casiano CA, et al. Recursive partitioning as an approach to selection of immune markers for tumor diagnosis. Clin Cancer Res 2003; 9 : 5120–6. 39. Zhong L, Peng X, Hidalgo GE, et al. Identification of circulating antibodies to tumor-associated proteins for combined use as markers of non-small cell lung cancer. Proteomics 2004; 4 : 1216–25. 40. Lucchi G, Hendra JB, Pecqueur D, Ducoroy P. Vers une standardisation des outils pour les études de protéomique clinique. Med Sci (Paris) 2007; 23 (suppl 1) : 19–22. 41. Solary E. Protéomique clinique en oncologie. Med Sci (Paris) 2007; 23 (suppl 1) : 3–4. |