| |
| Med Sci (Paris). 2008 February; 24(2): 124–126. Published online 2008 February 15. doi: 10.1051/medsci/2008242124.Les cellules gliales Pas d’un si grand support pour les motoneurones Séverine Boillée* and Christian S. Lobsiger Ludwig Institute and Department of Medicine and Neuroscience, University of California at San Diego, La Jolla, CA 92093, États-Unis MeSH keywords: Animaux, Astrocytes, Communication cellulaire, Mort cellulaire, Humains, Modèles neurologiques, Motoneurones, Névroglie |
La sclérose latérale amyotrophique (SLA) est la plus fréquente des affections des motoneurones, chez l’adulte. Elle se caractérise par une dégénérescence progressive des motoneurones entraînant une atrophie musculaire aboutissant à la mort des patients en moyenne 1 à 5 ans après le diagnostic. La plupart des cas de SLA sont sporadiques et 10 % sont des formes familiales. Les mutations les plus fréquemment rencontrées dans ces dernières sont dans le gène codant pour la superoxyde dismutase-1 (SOD1), une enzyme responsable de convertir en eau et en eau oxygénée les ions superoxyde nocifs. Cependant, la toxicité de la SOD1 mutée n’est pas liée à une perte de la fonction dismutase de l’enzyme, mais au gain d’une fonction toxique encore inconnue causant la dégénérescence neuronale. De nombreuses hypothèses ont été avancées pour expliquer la mort des motoneurones parmi lesquelles : la formation d’agrégats protéiques, un dysfonctionnement mitochondrial, une excitotoxicité et un mauvais fonctionnement du transport axonal [
1] (Figure 1). En focalisant les recherches sur les seuls motoneurones, cependant, une grande partie des mécanismes pouvant entraîner la mort neuronale a été omise. En effet, l’utilisation de souris chimériques a permis de reconnaître la participation d’autres cellules dans ce processus neurodégénératif [
2] et récemment, un effet direct des cellules gliales, et en particulier des astrocytes, sur les motoneurones en culture, a été montré par trois groupes [
3–
6].
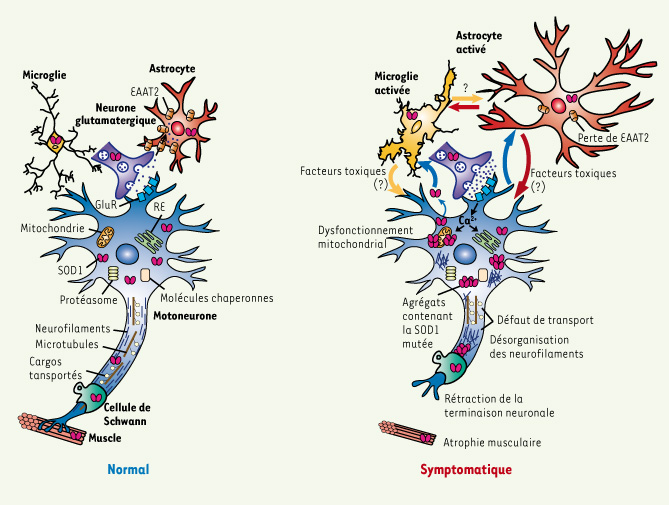
 | Figure 1.
Perturbations des fonctions du motoneurone et participation des cellules gliales au cours de la dégénérescence motoneuronale dans les modèles de SLA, causes potentielles de la mort neuronale. A. Motoneurone et son environnement dans les conditions physiologiques. EAAT2 : transporteur astrocytaire au glutamate ; GluR : récepteur au glutamate ; RE : réticulum endoplasmique. B. Dégénérescence motoneuronale entraînant une rétraction de la terminaison neuronale, une atrophie musculaire, et accompagnée d’une activation gliale. Les différentes hypothèses pour expliquer les mécanismes de mort neuronale sont : (1) la formation d’agrégats contenant la SOD1 mutée qui pourraient bloquer les fonctions du protéasome, des molécules chaperonnes, des mitochondries, du réticulum endoplasmique et du transport axonal ; (2) un dysfonctionnement mitochondrial ; (3) un défaut du transport axonal ; (4) une excitotoxicité due à une perte des transporteurs astrocytaires au glutamate. Ces atteintes neuronales pourraient être accentuées par une activation gliale entraînant la libération de facteurs toxiques par les astrocytes ou cellules microgliales. |
|
Le rôle néfaste des astrocytes Les astrocytes sont pourtant connus pour leurs fonctions de soutien aux neurones, mais, lorsque des motoneurones embryonnaires ou dérivés de cellules souches embryonnaires sont cultivés en présence d’astrocytes exprimant la SOD1 mutée, leur survie est compromise [3–6]. De plus, le milieu conditionné de ces astrocytes est suffisant pour entraîner la mort de ces motoneurones, montrant qu’un ou plusieurs facteurs libérés par les astrocytes mutés sont toxiques pour les motoneurones ou, peut-être, que la SOD1 mutée empêche la production et/ou la sécrétion de facteurs trophiques. Le fait que la toxicité de ces astrocytes cible sélectivement les motoneurones - ces mêmes cellules gliales ne sont pas toxiques pour les neurones GABAergiques de la moelle épinière ou les neurones des ganglions de la racine dorsale - pourrait même expliquer la plus grande vulnérabilité des motoneurones face aux mutations de SOD1 [3]. Ces résultats ne signifient pas, cependant, que les astrocytes sont nécessaires pour entraîner la mort des motoneurones. En effet, les pionniers dans le domaine des cultures de motoneurones ont, quelques années auparavant, montré que les motoneurones exprimant la SOD1 mutée étaient plus susceptibles de mourir que des motoneurones contrôles et qu’ils pouvaient auto-entraîner leur mort [
7,
8]. |
La question que chacun se pose en lisant ces articles récents est la suivante : quels sont les facteurs astrocytaires capables de rendre ces motoneurones plus susceptibles de mourir ? Cette question reste ouverte et la « chasse » à la molécule a assurément commencé. Le groupe de Przedborski donne un aperçu de leur avancée en nous révélant ce que cette molécule n’est pas : ce n’est pas le ligand de Fas ni le nerve growth factor et la mort neuronale n’est pas bloquée par l’inhibiteur de caspases zVAD. Cependant, aucune mention n’est faite concernant la SOD1 mutée elle-même. En effet, des travaux récents ont montré que la SOD1 mutée pouvait être sécrétée et entraîner la mort des motoneurones [
9]. Cette découverte a même permis de valider l’utilisation d’une stratégie de vaccination avec la SOD1 mutée chez les souris SLA [
10]. Il reste cependant à déterminer si les astrocytes en culture libèrent la SOD1 mutée et, plus important, si tel est le cas in vivo. Ce résultat serait cependant un peu décevant pour les 90 % de formes sporadiques de SLA, l’espoir étant bien sûr de trouver, grâce aux modèles disponibles, le plus petit nombre de voies communes pour résoudre le plus grand nombre de cas. C’est sans doute la raison pour laquelle l’hypothèse de l’excitotoxicité est si attrayante. Les astrocytes ont le pouvoir de nettoyer l’environnement synaptique du surplus de glutamate auquel les motoneurones sont particulièrement sensibles [
11]. Le fait qu’une perte des transporteurs astrocytaires au glutamate est observée dans les modèles de rats et de souris ainsi que chez les patients atteints de SLA [
12,
13] renforce cette hypothèse, également confortée par le fait que le seul traitement actuellement disponible (Riluzol, aux effets modestes) pour les patients atteints de SLA agit sur les voies glutamatergiques. Un autre dénominateur commun qui fait l’objet d’une attention particulière est la présence d’une réaction inflammatoire représentée dans la moelle épinière par une activation majeure des cellules microgliales (les macrophages du système nerveux central). Il a été établi qu’une diminution de l’activation microgliale ou de leur production de cytokines proinflammatoires ou radicaux oxygénés [
14–
17], de même que le remplacement des cellules microgliales/macrophages exprimant la SOD1 mutée par des cellules contrôles [
18,
19], entraînent une augmentation notable de la survie des souris SLA. |
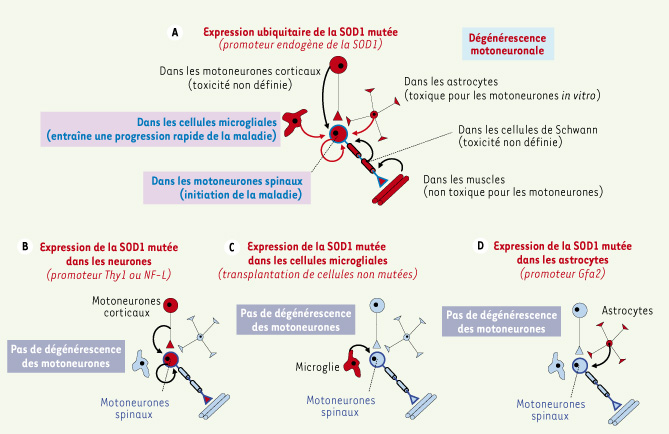
Néanmoins il est important d’insister sur le fait que lorsque les astrocytes ou les cellules microgliales sont les seules à exprimer la SOD1 mutée [19,
20] (Figure 2), les motoneurones ne dégénèrent pas, montrant que, quelle que soit l’importance des cellules gliales, une toxicité interne aux motoneurones est très certainement nécessaire pour entraîner la SLA. L’implication des cellules gliales représenterait ainsi une atteinte supplémentaire provoquant ou accélérant la mort des motoneurones. Ces observations ne retirent cependant rien à l’importance des cellules gliales dans la toxicité motoneuronale et le fait que leur prise en compte pourrait permettre l’identification de voies neurotoxiques ou neurotrophiques sur lesquelles il serait possible d’agir pour retarder et peut-être bloquer la mort motoneuronale [
21].  | Figure 2.
Bases cellulaires de la toxicité de la SOD1 mutée. La toxicité de la SOD1 mutée qui entraîne la SLA n’est pas liée à une perte de la fonction dismutase de l’enzyme puisqu’une grande partie des 114 mutations actuellement répertoriées dans l’ensemble du gène de la SOD1 humaine n’affecte pas son activité enzymatique. De plus, les souris invalidées pour leur propre SOD1 ne présentent aucun symptôme de SLA alors que des lignées transgéniques de souris ou de rats exprimant différentes formes de SOD1 mutée de manière ubiquitaire (A) présentent une dégénérescence progressive des motoneurones et, qu’une surexpression de SOD1 humaine non mutée n’entraîne aucun symptôme. (B) L’expression de la SOD1 mutée dans les neurones uniquement n’entraîne pas de dégénérescence des motoneurones sans doute en raison de la faible expression du transgène. L’expression de la SOD1 mutée spécifiquement dans les cellules microgliales (C) ou dans les astrocytes (D) n’entraîne pas de mort motoneuronale alors qu’une diminution d’expression du transgène dans les cellules microgliales dans les modèles ubiquitaires (comme en A) entraîne une survie accrue des souris et qu’en culture, les astrocytes exprimant la SOD1 mutée sont toxiques pour les motoneurones [ 3–
5]. |
|
1. Boillee S, Vande Velde C, Cleveland DW. ALS : a disease of motor neurons and their nonneuronal neighbors. Neuron 2006; 52 : 39–59. 2. Clement AM, Nguyen MD, Roberts EA, et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice. Science 2003; 302 : 113–7. 3. Nagai M, Re DB, Nagata T, et al. Astrocytes expressing ALS-linked mutated SOD1 release factors selectively toxic to motor neurons. Nat Neurosci 2007; 10 : 615–22. 4. Di Giorgio FP, Carrasco MA, Siao MC, et al. Non-cell autonomous effect of glia on motor neurons in an embryonic stem cell-based ALS model. Nat Neurosci 2007; 10 : 608–14. 5. Van Damme P, Bogaert E, Dewil M, et al. Astrocytes regulate GluR2 expression in motor neurons and their vulnerability to excitotoxicity. Proc Natl Acad Sci USA 2007; 104 : 14825–30. 6. Pettmann B, Raoul C, Haase G. Mort des motoneurones dans la SLA : suicide ou meurtre ? Med Sci (Paris) 2006; 22 : 923–5. 7. Raoul C, Estevez AG, Nishimune H, et al. Motoneuron death triggered by a specific pathway downstream of Fas. Potentiation by ALS-linked SOD1 mutations. Neuron 2002; 35 : 1067–83. 8. Raoul C, Buhler E, Sadeghi C, et al. Chronic activation in presymptomatic amyotrophic lateral sclerosis (ALS) mice of a feedback loop involving Fas, Daxx, and FasL. Proc Natl Acad Sci USA 2006; 103 : 6007–12. 9. Urushitani M, Sik A, Sakurai T, et al. Chromogranin-mediated secretion of mutant superoxide dismutase proteins linked to amyotrophic lateral sclerosis. Nat Neurosci 2006; 9 : 108–18. 10. Urushitani M, Ezzi SA, Julien JP. Therapeutic effects of immunization with mutant superoxide dismutase in mice models of amyotrophic lateral sclerosis. Proc Natl Acad Sci USA 2007; 104 : 2495–500. 11. Van Den Bosch L, Van Damme P, Bogaert E, Robberecht W. The role of excitotoxicity in the pathogenesis of amyotrophic lateral sclerosis. Biochim Biophys Acta 2006; 1762 : 1068–82. 12. Howland DS, Liu J, She Y, et al. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci USA 2002; 99 : 1604–9. 13. Rothstein JD, Van Kammen M, Levey AI, et al. Selective loss of glial glutamate transporter GLT-1 in amyotrophic lateral sclerosis. Ann Neurol 1995; 38 : 73–84. 14. Kriz J, Nguyen MD, Julien JP. Minocycline slows disease progression in a mouse model of amyotrophic lateral sclerosis.Neurobiol Dis 2002; 10 : 268–78. 15. Drachman DB, Frank K, Dykes-Hoberg M, et al. Cyclooxygenase 2 inhibition protects motor neurons and prolongs survival in a transgenic mouse model of ALS. Ann Neurol 2002; 52 : 771–8. 16. Wu DC, Re DB, Nagai M, et al. The inflammatory NADPH oxidase enzyme modulates motor neuron degeneration in amyotrophic lateral sclerosis mice. Proc Natl Acad Sci USA 2006; 103 : 12132–7. 17. Marden JJ, Harraz MM, Williams AJ, et al. Redox modifier genes in amyotrophic lateral sclerosis in mice. J Clin Invest 2007; 117 : 2913–9. 18. Boillee S, Yamanaka K, Lobsiger CS, et al. Onset and progression in inherited ALS determined by motor neurons and microglia. Science 2006; 312 : 1389–92. 19. Beers DR, Henkel JS, Xiao Q, et al. Wild-type microglia extend survival in PU.1 knockout mice with familial amyotrophic lateral sclerosis. Proc Natl Acad Sci USA 2006; 103 : 16021–6. 20. Gong YH, Parsadanian AS, Andreeva A, et al. Restricted expression of G86R Cu/Zn superoxide dismutase in astrocytes results in astrocytosis but does not cause motoneuron degeneration. J Neurosci 2000; 20 : 660–5. 21. Liévens JC, Birman S. Les astrocytes dans la chorée de Huntington : Complices ou coupables de la mort neuronale ? Med Sci (Paris) 2007; 23 : 845–9. |