| |
| Med Sci (Paris). 2008 February; 24(2): 135–136. Published online 2008 February 15. doi: 10.1051/medsci/2008242135.miARN Des petites molécules associées à un grand risque Alain Puisieux1,2* and Stéphane Ansieau2 1Université Lyon 1, ISPB, Lyon, F-69003, France. 2Inserm U590, Lyon, F-69008, France. Centre Léon Bérard, Lyon, F-69008, France MeSH keywords: Analyse de profil d'expression de gènes, Thérapie génétique, Humains, MicroARN, Métastase tumorale, Tumeurs |
Profils d’expression génique associés au processus métastatique La dissémination métastatique est un processus complexe qui se développe au travers de différentes étapes successives, incluant l’invasion des tissus adjacents à la tumeur primaire, l’intravasation, c’est-à-dire la pénétration des cellules tumorales dans les vaisseaux sanguins ou lymphatiques, le transport des cellules par la circulation, l’extravasation, et la croissance cellulaire au sein d’un organe secondaire. Du fait de la complexité de ce processus, les mécanismes mis en jeu restent encore relativement mal connus [
1]. Au-delà de la simple compréhension mécanistique, l’identification des événements impliqués dans les différentes phases de la dissémination métastatique constitue pourtant un enjeu majeur pour améliorer la prise en charge des patients atteints de cancers. Le développement de métastases est en effet la cause de 90 % des décès par cancer. La mise en évidence de marqueurs permettant d’évaluer de façon fiable le risque de métastase pourrait en effet aider le clinicien à choisir la thérapeutique la plus appropriée pour un patient donné. De plus, le ciblage d’événements cruciaux devrait permettre de proposer, à terme, de nouvelles approches thérapeutiques. Du fait de l’importance de cet enjeu, de très nombreuses études ont été réalisées ces dernières années afin d’identifier les gènes dont l’expression est corrélée au potentiel métastatique des tumeurs. À ce jour, sur la base de profils d’expression génique établis par analyse sur puces à ADN, sept signatures distinctes ont été mises en évidence (pour revue, voir [
2]). Les protéines correspondantes semblent intervenir aux différents stades de la progression tumorale et ont été classifiées en trois groupes distincts dits d’initiation métastatique, incluant des protéines impliquées dans la mobilité cellulaire, l’invasion et l’angiogenèse ; de progression métastatique, associé à des protéines impliquées plus spécifiquement dans la dissémination des cellules tumorales ; et de virulence métastatique, incluant des protéines spécifiquement impliquées dans la croissance de la tumeur secondaire [2]. |
L’avènement des microARN « oncomirs » Au cours de ces dernières années, une nouvelle classe de molécules a été impliquée dans les processus de cancérogenèse et de progression tumorale : les microARN (miARN)[
3]. Les miARN sont des ARN non codants transcrits par l’ARN polymérase II, dont l’expression est régulée au niveau cellulaire et tissulaire. Ils sont transcrits sous forme de précurseurs (pré-miARN), avant de subir une maturation conduisant à des miARN matures d’une taille comprise entre 20 et 24 nucléotides [
4]. Leur fonction est de réguler l’expression génique. Dans le contexte d’un complexe protéique, ils vont se lier à des ARNm cibles et provoquer leur dégradation ou inhiber leur traduction. Les miARN ont été impliqués dans le contrôle de nombreux processus fondamentaux, comme le développement, la différenciation cellulaire, la prolifération, l’apoptose et le maintien des cellules souches. Du fait de ces fonctions majeures, il n’est pas surprenant de constater qu’un certain nombre de miARN peut se comporter comme des oncogènes ou des gènes suppresseurs de tumeur. Ces miARN, appelés oncomirs [
5] sont exprimés de façon anormale dans les cancers et sont généralement localisés dans des régions chromosomiques altérées dans les cellules cancéreuses. |
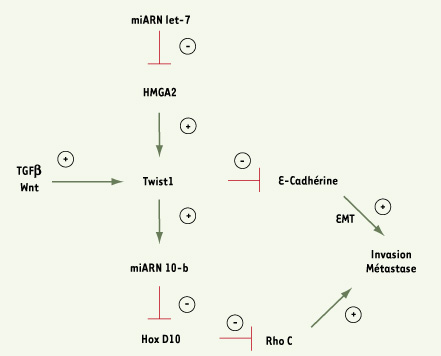
MiARN10, bras armé de Twist1 dans la dissémination métastatique ? Une étude récente publiée dans la revue Nature a permis pour la première fois d’impliquer la dérégulation d’un miARN dans le processus de dissémination métastatique [
6]. Dans un premier temps, l’équipe de Robert Weinberg a mis en évidence une corrélation entre la surexpression du miARN-10b et le potentiel métastatique de certaines lignées de cancer du sein. Par des approches de surexpression et d’inhibition par des oligonucléotides anti-sens, les auteurs ont ensuite montré que ce miARN favorisait, in vitro et in vivo, les propriétés invasives et métastatiques des cellules cancéreuses. La recherche des régulateurs de l’expression du miARN10-b et de ses gènes cibles a enfin permis d’établir un lien fonctionnel avec plusieurs protéines connues pour moduler les capacités métastatiques des cellules tumorales (Figure 1). Ainsi, de façon remarquable, le miARN-10b est régulé par la protéine Twist1. Twist1 est un facteur de transcription de type bHLH (basic helix loop helix), qui joue un rôle majeur au cours du développement embryonnaire. Il est indispensable à la formation du mésoderme au cours du développement, et contrôle les principaux processus de migration cellulaire, tels que la migration des cellules de la crête neurale, en induisant un processus de transdifférenciation apppelé transition épithélio-mésenchymateuse (EMT). Au cours de ces trois dernières années, de nombreuses études, dont celles de notre groupe, ont permis de mettre en évidence une surexpression fréquente du gène Twist1 dans les cancers humains, incluant une grande variété de carcinomes, mais aussi les gliomes, les mélanomes, les neuroblastomes et certains sarcomes [
7]. Dans les cancers du sein, l’équipe de Robert Weinberg a démontré que Twist1 favorisait l’invasion et la métastase en provoquant le processus d’EMT [
8]. L’identification du miARN-10b comme l’une des cibles directes de Twist1 renforce donc l’idée selon laquelle il constitue un régulateur important de l’activité métastatique. Enfin, les auteurs démontrent que le miARN-10b est capable de moduler l’expression du gène HoxD10. HoxD10 est un gène de la famille des Homeobox. La protéine codée par ce gène inhibe l’angiogenèse in vivo, et régule de façon négative l’expression de gènes impliqués dans le remodelage de la matrice extracellulaire et la migration cellulaire comme l’intégrine α3, la métalloprotéase 14 (MMP14) et la GTPase RhoC [
9–
11]. L’inhibition de RhoC par ARN interférence est suffisante pour prévenir la mobilité et l’acquisition des propriétés invasives induites par l’expression du miARN-10b, démontrant l’importance de cette GTPase dans le programme régulé par le miARN.
 | Figure 1.
Voie de signalisation dépendante des miARN impliquée dans l’acquisition de propriétés métastatiques par les cellules cancéreuses. EMT : transition épithélio-mésenchymateuse. |
|
L’ensemble des observations rapportées dans cette étude établit ainsi un lien fonctionnel entre trois protéines, Twist1, HoxD10 et RhoC, fortement impliquées dans les processus d’invasion et de métastase. Ce lien est validé par une analyse élégante d’inhibitions croisées. Pour autant, les données présentées restent limitées à quelques lignées cellulaires et à un seul type de cancer. La corrélation établie entre l’expression du miARN-10b et l’activité métastatique n’est de plus établie que sur un échantillon restreint de tumeurs. Aussi, seule une étude plus approfondie, élargie à un nombre et à une variété de cancers plus importants, permettra d’évaluer de façon précise le rôle réel joué par le miARN-10b au cours de la dissémination des cellules cancéreuses. Le travail présenté par l’équipe de Robert Weinberg constitue néanmoins une avancée significative dans la compréhension de l’interrelation entre différentes oncoprotéines associées à l’activité métastatique et suggère de nouvelles fonctions associées aux miARN. Enfin, il donne un nouvel exemple de l’importance de la dérégulation de certains mécanismes de régulation post-transcriptionnelle au cours de la progression tumorale. |
1. Mehlen P, Puisieux A. Metastasis : a question of life or death. Nat Rev Cancer 2006; 6 : 449–58. 2. Nguyen DX, Massague J. Genetic determinants of cancer metastasis. Nat Rev Genet 2007; 8 : 341–52. 3. Kahn A. L’impérialisme des micro-ARN s’étend maintenant au cancer Med Sci (Paris) 2005; 21 : 687–9. 4. Hartmann C, Corre-Menguy F, Boualem A, et al. Les microARN : une nouvelle classe de régulateurs de l’expression génique. Med Sci (Paris) 2004; 20 : 894–8. 5. Esquela-Kerscher A, Slack FJ. Oncomirs — microRNAs with a role in cancer. Nat Rev Cancer 2006; 6 : 259–69. 6. Ma L, Teruya-Feldstein J, Weinberg RA. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer. Nature 2007; 449 : 682–8. 7. Puisieux A, Valsesia-Wittmann S, Ansieau S. A twist for survival and cancer progression. Br J Cancer 2006; 94 : 13–7. 8. Yang J, Mani SA, Donaher JL, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis. Cell 2004; 117 : 927–39. 9. Myers C, Charboneau A, CheungI, et al. Sustained expression of homeobox D10 inhibits angiogenesis. Am J Pathol 2002; 161 : 2099–109. 10. Clark EA, GolubTR, Lander ES, Hynes RO. Genomic analysis of metastasis reveals an essential role for RhoC. Nature 2000; 406 : 532–5. 11. Hakem A, Sanchez-Sweatman O, You-Ten A, et al. RhoC is dispensable for embryogenesis and tumor initiation but essential for metastasis. Genes Dev 2005; 19 : 1974–9. |