| |
| Med Sci (Paris). 2008 February; 24(2): 139–141. Published online 2008 February 15. doi: 10.1051/medsci/2008242139.GDF15 coupable de l’hypersidérémie des patients thalassémiques par extinction de l’hepcidine Sophie Vaulont* and Dominique Labie* Institut Cochin, Université Paris Descartes, CNRS (UMR 8104), Paris, France. Inserm, U567, Paris, France. Département de génétique, développement et pathologie moléculaire, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Peptides antimicrobiens cationiques, Cytokines, Érythroblastes, Facteur-15 de croissance et de différenciation, - traduction non trouvée, Humains, Syndrome, Thalassémie, Facteur de croissance transformant bêta |
Érythropoïèse inefficace et surcharge en fer dans les thalassémies Les thalassémies sont sans doute les maladies génétiques les plus fréquentes au monde. Leur caractère commun est le déficit partiel ou total de synthèse d’une chaîne de l’hémoglobine conduisant à une anémie de type hémolytique. Malgré une variabilité génétique considérable - on en connaît plusieurs centaines - elles présentent des caractères physiopathologiques communs dus à ce déficit et à l’excès de la chaîne globine non appariée. La constatation d’une érythropoïèse inefficace de compensation remonte aux années 1950. Étudiant la cinétique du fer radioactif, on avait alors montré qu’environ 75 % des précurseurs des globules rouges (GR) mourraient prématurément dans la moelle osseuse [
1]. La durée de vie écourtée des GR expliquait la splénomégalie et les déformations osseuses par expansion de la moelle. La mise en évidence d’une précipitation dans les GR des chaînes α-globine non appariées remonte à 1963 [
2]. Une surcharge en fer par augmentation de l’absorption intestinale a aussi été constatée de longue date et attribuée aux besoins massifs des précurseurs érythroïdes [
3]. L’hémosidérose était naturellement amplifiée par le régime transfusionnel habituel des β-thalassémies et corrigée par un traitement chélateur [
4]. Ces divers désordres ont fait l’objet d’études ultérieures. L’érythropoïèse inefficace, démontrée par l’analyse de la cinétique du fer, s’accompagne d’une apoptose des précurseurs érythroïdes [
5]. Cette apoptose accélérée est spécifique des précurseurs érythroïdes et n’est pas observée pour les précurseurs myéloïdes du même prélèvement médullaire [
6]. L’ensemble des troubles est aussi aggravé par l’anémie et l’hypoxie tissulaire qu’entraîne cette apoptose. Pourquoi une synthèse asymétrique de l’hémoglobine et le dépôt de chaînes de globine non appariées se traduisent-ils par un programme d’apoptose ? L’hypothèse la plus probable est que le dépôt de chaînes α-globine en particulier entraîne la production d’espèces réactives d’oxygène (ROS) dont le stress oxydant pourrait s’exercer au niveau de la membrane des précurseurs ou au niveau des mitochondries. À l’appui de cette dernière hypothèse, on a pu montrer chez les thalassémiques que l’apoptose est en rapport avec une activation caractéristique du système FAS/FAS ligand exprimé par les précurseurs érythroïdes apoptotiques [
7]. Il existe par ailleurs un paradoxe entre les observations concernant le métabolisme du fer chez les thalassémiques et la régulation homéostatique extrêmement élaborée qui fonctionne dans les conditions normales [
18]. Comment se fait-il que la surcharge martiale des thalassémies continue à s’accompagner d’une absorption intestinale accrue ? Quelle est la cause du dérèglement du circuit homéostatique du fer ? Enfin, l’existence d’une surcharge en fer est presque toujours retrouvée au cours de thalassémies intermédiaires chez des sujets non transfusés. |
Hepcidine et syndromes thalassémiques C’est en 2005 que l’hypothèse de l’implication de l’hepcidine dans les altérations du métabolisme du fer des syndromes thalassémiques a été avancée et, depuis, plusieurs équipes ont en effet rapporté la diminution des taux circulants d’hepcidine chez les patients thalassémiques [
8,
9]. L’hepcidine est un petit peptide hormonal circulant, produit par le foie, qui constitue le régulateur majeur de l’équilibre du fer dans l’organisme. Ce peptide contrôle l’absorption intestinale du fer alimentaire et le recyclage du fer de l’hémoglobine par le système réticulo-endothélial en réglant l’export du fer des entérocytes et des macrophages (pour revue, voir [
10]). Pour cela, l’hepcidine se lie à la protéine exportant le fer et présente à la membrane de ces cellules, la ferroportine, en induisant sa dégradation et donc en favorisant la rétention cellulaire du fer [
11]. Comme attendu d’une hormone dont le rôle est de limiter la quantité de fer dans l’organisme, la production d’hepcidine est augmentée par le fer et diminuée dans toutes les situations d’érythropoïèse accrue (déficit en fer, anémie, hypoxie…) pour faire face à la demande accrue du métal [
12]. Ainsi, chez les patients thalassémiques, la très forte activité érythropoïétique provoque-t-elle une diminution importante de l’hepcidine avec, pour conséquence, une hyperabsorption intestinale du fer et la déplétion du fer macrophagique conduisant à la surcharge en fer des patients thalassémiques avant même les transfusions. Si ce mécanisme d’action est séduisant et peut en effet expliquer les surcharges en fer secondaires des thalassémiques, aucun mécanisme moléculaire mis en jeu dans l’inhibition de l’hepcidine n’avait alors été proposé. |
Implication d’un membre de la famille TGFβ dans la diminution de l’hepcidine chez les patients thalassémiques Dans un travail récent paru dans Nature Medicine, Tanno et al. ont émis l’hypothèse selon laquelle l’expansion du compartiment érythroïde chez les patients pourrait être à l’origine de la régulation de l’hepcidine via la sécrétion de membres de la famille des facteurs de croissance TGFβ qui sont naturellement sécrétés au cours de l’erythropoïèse [
13]. Les auteurs ont alors exploré, chez 15 sujets bien-portants non thalassémiques, le transcriptome d’érythroblastes issus de progéniteurs CD34+ cultivés in vitro à deux étapes (7 et 14 jours) de leur maturation en précurseurs érythroïdes, et constaté une synthèse active et une sécrétion de GDF15 (growth differentiation factor 15), un membre de la famille TGFβ, au cours de la maturation normale des érythroblastes et de l’accumulation d’hémoglobine. Étant donné l’expansion massive des précurseurs chez les thalassémiques, l’hypothèse d’une production excessive de GDF15 a été avancée. La mesure de GDF15 dans le sang a donc été réalisée, par ELISA et immunoblot, chez des volontaires sains (450±50 pg/ml), et chez des thalassémiques. Chez les porteurs d’un trait α- ou β-thalassémique non anémiques, on note une élévation modérée des taux de GDF15 (830±100 pg/ml). En revanche, chez les sujets thalassémiques anémiques, les auteurs ont observé une très forte augmentation de la concentration en GDF15, cela chez 20 sujets α-thalassémiques (5 900 ± 1 200 pg/ml, p = 0,0015), et davantage encore chez 40 sujets β-thalassémiques (66 000 ± 9 600 pg/ml, médiane 48 000 pg/ml, p = 0,00010), soit une augmentation supérieure à 100 fois. Pour tester le rôle de GDF15 sur l’inhibition de l’hepcidine, les auteurs ont étudié dans un système d’hépatocytes humains en culture primaire les effets de GDF15 recombinant et ont pu constater, pour des concentrations de GDF15 comparables à celles mesurées chez les patients thalassémiques, une réduction, faible, mais significative des ARNm de l’hepcidine. De même, le traitement de ces hépatocytes par le sérum de patients thalassémiques diminue les niveaux d’hepcidine, effet qui est perdu lorsque le sérum a préalablement été immunodéplété de GDF15. Ainsi, Tanno et al. proposent-ils que l’expansion massive du compartiment érythroïde secondaire à l’érythropoïèse inefficace chez les thalassémiques soit responsable de la production accrue de GDF15 circulant. Ce facteur produit en excès serait alors responsable de l’inhibition de l’hepcidine au niveau du foie et donc des anomalies du métabolisme du fer (Figure 1). L’anémie, résultante de l’érythropoïèse inefficace et de l’hémolyse, conduit à une hypoxie tissulaire qui potentialise l’expansion érythroïde massive. Notons qu’à faible concentration, le GDF15 n’a pas d’effet inhibiteur sur l’hepcidine et que la suppression de l’hepcidine est loin d’être complète, suggérant que GDF15 n’est pas le seul régulateur de l’hepcidine. À ce titre, il est intéressant de noter que Carole Peyssonnaux a récemment démontré que le facteur de transcription HIF (hypoxia inducible factor) était capable de réguler directement l’expression du gène de l’hepcidine [
14,
19] (→).
(→) m/s 2008, n° 2, p. 137
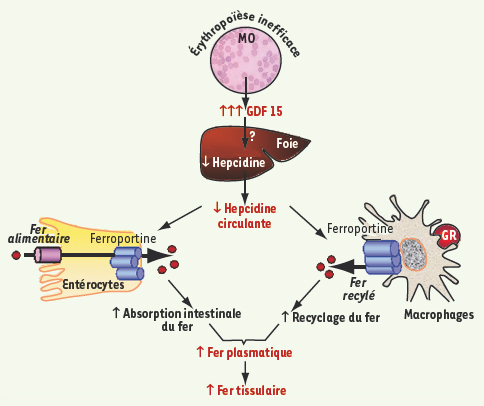
 | Figure 1.
Régulation du métabolisme du fer chez les patients thalassémiques. La sécrétion accrue de GDF15 produit par les érythroblastes de patients thalassémiques entraîne l’inhibition hépatique de l’hepcidine conduisant à la stabilisation de la ferroportine. Au niveau des entérocytes, la stabilisation de l’exporteur du fer conduit à une hyperabsorption intestinale du fer alimentaire et au niveau des macrophages un recyclage accru du fer héminique. L’excès de fer se dépose alors dans les tissus conduisant à la surcharge en fer secondaire caractéristique des patients thalassémiques. |
|
Hypothèses sur le mécanisme d’action de GDF15 Ces taux extrêmement élevés de GDF15 chez les thalassémiques posent bien sur la question du rôle physiopathologique de ce facteur dans d’autres pathologies. Chez la femme enceinte, au cours du troisième mois de grossesse, lorsque la demande en fer du fœtus est élevée, les taux circulants de GDF15 (produit par le placenta) sont également très élevés (30 000 pg/ml). Or, chez l’animal, cette période correspond à une diminution importante de l’hepcidine, ce qui optimise le transfert de fer materno-foetal. Chez les patients drépanocytaires qui ne présentent pas d’érythropoïèse inefficace, et donc pas de surcharge en fer secondaire, les taux de GDF15 semblent normaux. On attend avec impatience le dosage de GDF15 dans les différentes maladies avec érythropoïèse inefficace et surcharges en fer inexpliquées (anémie sidéroblastique, anémie pernicieuse, anémie congénitale dysérythropoiétique…). Que sait-on de l’action de GFF15 ? De façon intéressante, il a été montré que GDF15 était capable d’activer la voie Smad 2/3 dans les cardiomyocytes [
15]. Cette voie est-elle empruntée par les hépatocytes pour l’inhibition de l’hepcidine ? Pourrait-on également envisager une communication entre GDF15, membre de la sous famille des BMP (bone morphogenetic protein), et les membres BMP 2, 4, et 9 qui ont tous été montrés comme de forts transactivateurs de l’hepcidine [
16,
17] ? Pour en savoir plus sur le rôle de ce facteur in vivo, malheureusement la souris ne sera probablement pas d’une grande aide car les auteurs ont montré que le facteur GDF15 humain n’était pas capable d’inhiber l’hepcidine dans des hépatocytes de souris et de fait, les souris dont le gène codant GDF15 est inactivé ne présentent pas d’anomalies de l’érythropoïèse et du métabolisme du fer, laissant supposer un rôle différent de GDF15 chez l’homme et la souris. |
Ce travail de Tanno et al. est intéressant à plusieurs titres. Il permet d’expliquer la surcharge en fer chez les patients thalassémiques et identifie un nouveau mécanisme par lequel les GR et les érythroblastes envoient vers le foie un message responsable de l’altération de l’homéostasie du fer. Outre leur fonction de transporteur d’oxygène, les GR seraient également capables d’avoir des effets endocrines via la sécrétion de facteurs circulants. Ce travail, enfin, identifie une nouvelle cible thérapeutique, GDF15, pour améliorer les anomalies du métabolisme du fer chez les patients thalassémiques, ces anomalies étant actuellement la cause majeure de mortalité. |
1. Finch CA, Sturgeon P. Erythrokinetics in Cooley’s anemia. Blood 1957; 12 : 64–73. 2. Fessas P. Inclusions of hemoglobin erythroblasts and erythrocytes of thalassemia. Blood 1963; 21 : 21–32. 3. Hershko C, Graham G, Bates GW, Rachmilewitz EA. Non-specific serum iron in thalassaemia : an abnormal serum iron fraction of potential toxicity. Br J Haematol 1978; 40 : 255–63. 4. Hershko C, Weatherall DJ. Iron-chelating therapy. Crit Rev Clin Lab Sci 1988; 26 : 303–45. 5. Pootrakul P, Sirankapracha P, Hemsorach S, et al. A correlation of erythrokinetics, ineffective erythropoiesis, and erythroid precursor apoptosis in thai patients with thalassemia. Blood 2000; 96 : 2606–12. 6. Centis F, Tabellini L, Lucarelli G, et al. The importance of erythroid expansion in determining the extent of apoptosis in erythroid precursors in patients with beta-thalassemia major. Blood 2000; 96 : 3624–9. 7. Schrier SL, Centis F, Verneris M, et al. The role of oxidant injury in the pathophysiology of human thalassemias. Redox Rep 2003; 8 : 241–5. 8. Papanikolaou G, Tzilianos M, Christakis JI, et al. Hepcidin in iron overload disorders. Blood 2005; 105 : 4103–5. 9. Origa R, Galanello R, Ganz T, et al. Liver iron concentrations and urinary hepcidin in beta-thalassemia. Haematologica 2007; 92 : 583–8. 10. Ganz T. Defensins and other antimicrobial peptides : a historical perspective and an update. Comb Chem High Throughput Screen 2005; 8 : 209–17. 11. Nicolas G, Vaulont S. Le mécanisme d’action de l’hepcidine déchiffré. Med Sci (Paris) 2005; 21 : 7–9. 12. Fleming RE. Advances in understanding the molecular basis for the regulation of dietary iron absorption. Curr Opin Gastroenterol 2005; 21 : 201–6. 13. Tanno T, Bhanu NV, Oneal PA, et al. High levels of GDF15 in thalassemia suppress expression of the iron regulatory protein hepcidin. Nat Med 2007; 13 : 1096–101. 14. Peyssonnaux C, Zinkernagel AS, Schuepbach RA, et al. Regulation of iron homeostasis by the hypoxia-inducible transcription factors (HIFs). J Clin Invest 2007; 117 : 1926–32. 15. Xu J, Kimball TR, Lorenz JN, et al. GDF15/MIC-1 functions as a protective and antihypertrophic factor released from the myocardium in association with SMAD protein activation. Circ Res 2006; 98 : 342–50. 16. Babitt JL, Huang FW, Xia Y, et al. Modulation of bone morphogenetic protein signaling in vivo regulates systemic iron balance. J Clin Invest 2007; 117 : 1933–9. 17. Truksa J, Peng H, Lee P, Beutler E. Bone morphogenetic proteins 2, 4, and 9 stimulate murine hepcidin 1 expression independently of Hfe, transferrin receptor 2 (Tfr2), and IL-6. Proc Natl Acad Sci USA 2006; 103 : 10289–93. 18. Beaumont C. Mécanismes moléculaires de l’homéostasie du fer. Med Sci (Paris) 2004; 20 : 68–72 19. Peyssonnaux C. Les facteurs de transcription HIF : régulateurs clés du métabolisme du fer ? Med Sci (Paris) 2008; 24 : 137–8. |