| |
| Med Sci (Paris). 2008 February; 24(2): 144–146. Published online 2008 February 15. doi: 10.1051/medsci/2008242144.Interaction entre l’activité neuronale et la signalization par les éphrines pendant le raffinement des connexions neuronales Xavier Nicol1,2 and Patricia Gaspar1* 1Inserm U.839, Institut du Fer à Moulin, 17, rue du Fer à Moulin, 75005 Paris, France 2Spitzer Laboratory, Neurobiology Section, Division of Biological Sciences, University of California at San Diego, La Jolla, CA 92093, États-Unis MeSH keywords: Animaux, Communication cellulaire, AMP cyclique, Électrophysiologie, Éphrine A2, Humains, Neurones, Oscillométrie, Famille des récepteurs Eph, Rétine, Transduction du signal |
Une des particularités du système nerveux central est la précision des connexions entre les neurones qui le composent. Différents mécanismes interviennent séquentiellement pour contrôler la formation de ces réseaux neuronaux. Des molécules de guidage attractives ou répulsives orientent les axones vers leurs territoires cibles et contribuent à l’établissement d’une topographie grossière des terminaisons neuronales qui formeront des synapses avec les cellules cibles. Puis, l’activité nerveuse, spontanée ou évoquée, joue un rôle pour modeler et raffiner ces connexions. Les mécanismes mis en jeu pendant ces étapes de raffinement sont encore mal compris. Des données récentes de notre laboratoire démontrent que l’activité neuronale peut interagir directement avec des signaux de guidage pour moduler le raffinement des cartes topographiques. En étudiant le raffinement de la carte de projection de la rétine vers le colliculus supérieur (CS), modèle classique de carte topographique, nous avons observé que la dépolarisation des cellules ganglionnaires de la rétine (CGR) était requise pour la réponse à l’éphrine A5, une molécule répulsive qui induit la rétraction des axones rétiniens. Ce mécanisme fait intervenir une signalisation par le calcium et l’AMP cyclique (AMPc). L’adénylate cyclase de type 1, une enzyme membranaire activée par le calcium, joue probablement un rôle clef dans cette réponse, en répondant à l’entrée de calcium, induite par la dépolarisation neuronale : elle augmente l’AMPc en phase avec des évènements de dépolarisation. De manière encore plus surprenante, la réponse des axones aux éphrines nécessite des oscillations d’AMPc au niveau du cône de croissance plutôt que des changements prolongés de la concentration de ce messager. |
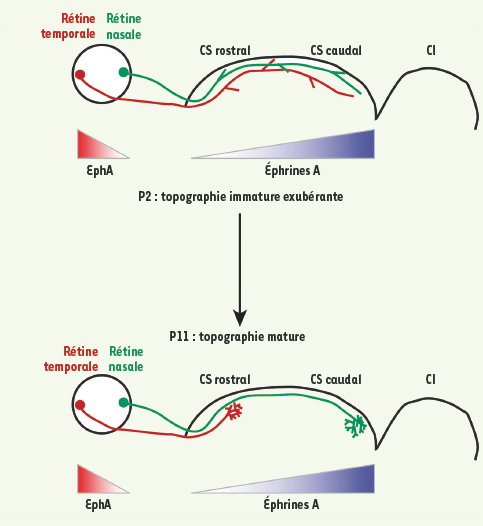
Le système visuel rétinotectal Le système visuel rétinotectal est un système modèle simple et, de ce fait, largement utilisé pour l’étude des mécanismes de développement des cartes topographiques (Figure 1). Les CGR innervent de façon ordonnée le colliculus supérieur. Ainsi, l’axe temporo-nasal de la rétine se projette sur l’axe antéro-postérieur du CS. La signalisation par les éphrines est indispensable à l’établissement de cette topographie [
1]. Les éphrines A2 et A5 sont exprimées en un gradient antéro-postérieur dans le CS et leurs récepteurs sélectifs, les Eph (de la famille des tyrosine kinases), sont exprimés sur les CGR. Malgré la présence très précoce de ces molécules de guidage, la projection rétinienne est initialement imprécise. Dans un premier temps, les axones des CGR envahissent l’ensemble du CS, sans ordre topographique apparent. Quelques jours plus tard, les axones de la rétine temporale se rétractent de la partie postérieure du CS et forment des branches pour contacter les neurones de la partie antérieure du CS. Dans le même temps, les axones de la rétine nasale se stabilisent et commencent à former des arborisations dans la partie postérieure du CS. Pendant cette période de remodelage axonal, une activité électrique spontanée est observée au niveau de la rétine immature. Cette activité est générée par les cellules amacrines cholinergiques et se transmet aux CGR. L’activité spontanée de la rétine, particulièrement bien visible par imagerie calcique, survient en bouffées et traverse la rétine sous forme de vagues lentes qui se propagent de proche en proche [
2]. L’abolition de cette activité ou la modification du patron de décharge des neurones, par exemple chez des mutants déficients pour le récepteur β2 nicotinique, perturbe le raffinement des connexions rétinotectales aboutissant à une projection plus diffuse [
3]. L’hypothèse couramment admise pour expliquer le rôle de l’activité est de considérer qu’elle résulte de mécanismes de stabilisation synaptique, l’activité permettant de consolider les synapses les plus actives et les synapses inactives étant éliminées.  | Figure 1.
Développement des projections retinotectales. La rétine se projette de manière topographique dans le colliculus supérieur (CS). La rétine temporale (rouge) arborise dans la partie antérieure du CS. Les axones de la rétine nasale (vert) se projettent vers la partie postérieure du CS. Des molécules répulsives sont impliquées dans cette topographie. L’éphrine A5 est exprimée en gradient antéro-postérieur dans le CS, et les récepteurs Eph sont exprimés en gradient temporo-nasal dans la rétine. Cependant les axones rétiniens envahissent initialement (de E15 = jour embryonnaire 15, à P2 = jour postnatal 2) l’ensemble du CS, sans topographie nette, les axones semblent indifférents à l’action des éphrines. Le remodelage de cette projection est terminé pendant la 2e semaine de vie postnatale (P11) ; il implique une rétraction des axones exubérants, et un branchement régional sélectif. |
|
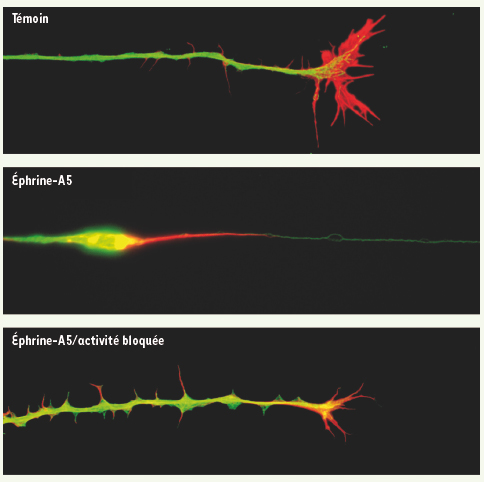
L’activité électrique rétinienne spontanée a un rôle non synaptique pour la rétraction des axones rétiniens temporaux Pour étudier les mécanismes de remodelage des axones rétiniens, nous avons reproduit ces phénomènes développementaux in vitro en confrontant des explants de rétine embryonnaire et de colliculus supérieur post-natal. La rétraction des axones rétiniens de la partie postérieure du colliculus et le branchement sélectif des axones sont reproduits in vitro dans ce système, et une activité électrique en bouffée émerge, à un rythme normal dans l’explant de rétine. Le blocage de l’activité neuronale spontanée par la tétrodotoxine empêche la rétraction des axones rétiniens temporaux de la partie caudale du colliculus, ainsi que le branchement sélectif des axones dans leur cible. En revanche, le blocage de la transmission synaptique, par voie génétique ou pharmacologique, n’a pas ces effets, indiquant qu’il existe une action non-synaptique de l’activité électrique pendant le raffinement des axones rétiniens, bousculant ainsi une hypothèse dominante dans ce domaine. Dans d’autres expériences, nous avons étudié la rétraction (collapse) des axones rétiniens en réponse à l’éphrine A5. Cela nous a permis d’observer le comportement dynamique d’un axone et de son cône de croissance en réponse aux molécules répulsives dans des conditions normales ou après blocage de l’activité électrique (Figure 2). Nous avons observé que la rétraction axonale initiée par l’éphrine A5 était perturbée quand l’activité électrique est bloquée [
4]. Ainsi l’activité électrique constituerait un signal permissif, permettant aux axones rétiniens de répondre à des molécules de guidage répulsives présentes dans la partie postérieure du colliculus supérieur.  | Figure 2.
Le bocage de l’activité empêche le « collapse » des axones induit par l’éphrine A5. Les cônes de croissance des axones rétiniens sont très motiles et comportent de nombreux filopodes et lamellipodes. Trente minutes après application d’éphrine A5 dans le milieu les axones présentent des figures de collapse avec rétraction des lamellipodes et bulbe de rétraction. Le fin filopode restant indique la course de rétraction qui a été effectuée par le cône de croissance. En présence de TTX, une réaction de collapse partiel est observée, les lamellipodes se rétractent, mais on n’observe plus de bulbe, ni de mouvement du cône de croissance. |
|
L’AMP cyclique est nécessaire à la rétraction des axones rétiniens Tout comme l’activité électrique, un second messager cellulaire, l’AMPc, joue un rôle important pendant la formation des cartes rétiniennes. La diminution de sa concentration dans les CGR provoque les mêmes défauts que le blocage de l’activité, c’est-à-dire une absence de rétraction des axones rétiniens après une stimulation par les éphrines A [
5]. La synthèse de ce second messager est assurée par une famille d’enzymes : les adénylates cyclases. Elles sont au nombre de dix. Seule, l’une d’entre elle, l’adénylate cyclase 1 (AC1), est indispensable au développement normal des projections rétiniennes, et son absence n’est pas compensée par les autres adénylate cyclases exprimées dans les CGR [5,
6]. L’AC1 diffère de la plupart des autres adénylates cyclases par le fait qu’elle est capable d’engendrer un signal AMPc en réponse à une activité électrique de la cellule, car elle est stimulée par la dépolarisation de la membrane plasmique et par l’entrée de calcium extracellulaire dans le cytoplasme [
7]. |
L’activité électrique engendre des oscillations d’AMPc dans les cônes de croissance rétiniens Si l’activité électrique est le signal déclenchant pour l’activation de l’AC1 pendant le développement des projections rétiniennes, on pourrait s’attendre à ce que le signal AMPc résultant soit périodique car l’activité spontanée de la rétine est organisée en bouffées avec de courtes périodes actives de décharges neuronales entrecoupées de longues périodes de silence. Cette hypothèse a été confirmée par nos observations : la diminution de la concentration d’AMPc ainsi que son augmentation perturbent la rétraction des axones rétiniens [4]. Ainsi, la modulation temporelle de la concentration d’AMPc semble être le code utilisé par les cônes de croissance pour permettre leur réponse aux éphrines. Dans d’autres systèmes, des oscillations de la concentration d’AMPc ont été mises en évidence dans les neurones. C’est le cas dans les cônes de croissance de neurones spinaux de xénope en culture [
8], ainsi que dans les somas des cellules ganglionnaires rétiniennes [
9]. Ce sont des oscillations semblables qui sont requises pour la réponse des axones rétiniens temporaux aux signaux de guidage répulsifs présents dans la partie caudale du colliculus supérieur. En effet, lorsque l’activité électrique est bloquée, la rétraction des axones rétiniens est restaurée par des augmentations périodiques du niveau d’AMPc dans les cônes. Ainsi, l’activité rétinienne permettrait d’engendrer des oscillations d’AMPc au sein des cônes de croissance rétiniens, constituant un signal permissif pour la réponse à des molécules de guidage. Cela conforte la relation étroite décrite auparavant entre les oscillations d’AMPc et les oscillations des concentrations calciques : l’augmentation de la concentration d’AMPc augmente la fréquence des oscillations calciques, et plusieurs potentiels d’action calciques successifs sont nécessaires à l’initiation des oscillations d’AMPc [8–
10]. Lors du développement du système visuel, l’activité électrique spontanée de la rétine agit donc précocement pendant la phase de rétraction des axones rétiniens, en provoquant des oscillations de la concentration d’AMPc dans les cônes de croissance des cellules ganglionnaires de la rétine. Ces oscillations sont nécessaires à l’effet des molécules de guidage répulsives du colliculus supérieur qui permettent une organisation grossière des axones rétiniens. |
1. Feldheim DA, Kim YI, Bergemann AD, et al. Genetic analysis of ephrin-A2 and ephrin-A5 shows their requirement in multiple aspects of retinocollicular mapping. Neuron 2000; 25 : 563–74. 2. Torborg CL, Feller MB. Spontaneous patterned retinal activity and the refinement of retinal projections. Prog Neurobiol 2005; 76 : 213–35. 3. McLaughlin T, Torborg CL, Feller MB, O’Leary DD. Retinotopic map refinement requires spontaneous retinal waves during a brief critical period of development. Neuron 2003; 40 : 1147–60. 4. Nicol X, Voyatzis S, Muzerelle A, et al. cAMP oscillations and retinal activity are permissive for ephrin signaling during the establishment of the retinotopic map. Nat Neurosci 2007; 28 : 340–5. 5. Nicol X, Bennis M, Ishikawa Y, et al. Role of calcium modulated cyclases in the development of the retinal projections. Eur J Neurosci 2006; 24 : 3401–14. 6. Ravary A, Muzerelle A, Herve D, et al. Adenylate cyclase 1 as a key actor in the refinement of retinal projection maps. J Neurosci 2003; 23 : 2228–38. 7. Fagan KA, Graf RA, Tolman S, et al. Regulation of a Ca2 +-sensitive adenylyl cyclase in an excitable cell. Role of voltage-gated versus capacitative Ca2 + entry. J Biol Chem 2000; 275 : 40187–94. 8. Gorbunova YV, Spitzer NC. Dynamic interactions of cyclic AMP transients and spontaneous Ca2 + spikes. Nature 2002; 418 : 93–6. 9. Dunn TA, Wang CT, Colicos MA, et al. Imaging of cAMP levels and protein kinase a activity reveals that retinal waves drive oscillations in second-messenger cascades. J Neurosci 2006; 26 : 12807–51. 10. Willoughby D, Cooper DM. Ca2 stimulation of adenylyl cyclase generates dynamic oscillations in cyclic AMP. J Cell Sci 2006; 119 : 828–36. |