| |
| Med Sci (Paris). 2008 March; 24(3): 263–269. Published online 2008 March 15. doi: 10.1051/medsci/2008243263.Les embryons d’ascidies De la naissance de l’embryologie expérimentale à l’analyse des réseaux de gènes Clément Lamy2* and Patrick Lemaire1* 1Institut de Biologie du Développement de Marseille-Luminy, UMR 6216 CNRS/Université de la Méditerranée, Campus de Luminy, case 907, F-13288 Marseille Cedex 9, France 2Laboratoire de Biologie Moléculaire du Développement, Département de Biophysique, Université de Kyoto, Kitashirakawa-Oiwake, Sakyo-ku, 606-8304 Kyoto, Japon |
Les premières expériences d’embryologie expérimentale sur un animal ont été conduites en 1887 par Laurent Chabry sur des embryons d’ascidies [
1]. De ces expériences et de celles, 20 ans plus tard, de E.G. Conklin [
2], nait la théorie du développement mosaïque par héritage de déterminants maternels. Les ascidies appartiennent aux tuniciers, les seuls animaux connus pour fabriquer de la cellulose, comme les plantes. Certaines sont consommées par l’homme, dans la région marseillaise par exemple (les violets). Les tuniciers (ou urochordés) sont néanmoins les plus proches cousins évolutifs des vertébrés [
3,
4,
39]. Négligé pendant la plus grande partie du XXe siècle, ce modèle a trouvé un nouvel élan avec le séquençage des génomes des ascidies Ciona intestinalis et Ciona savignyi. Ces génomes non dupliqués contiennent 16 000 à 20 000 gènes, et sont 20 fois plus petits que le génome humain [
5]. Les œufs de Ciona sont micro-injectables et aisément transfectables par électroporation, ce qui en fait un modèle privilégié pour le déchiffrage et l’analyse des réseaux complexes de régulation des gènes du développement [
6]. |
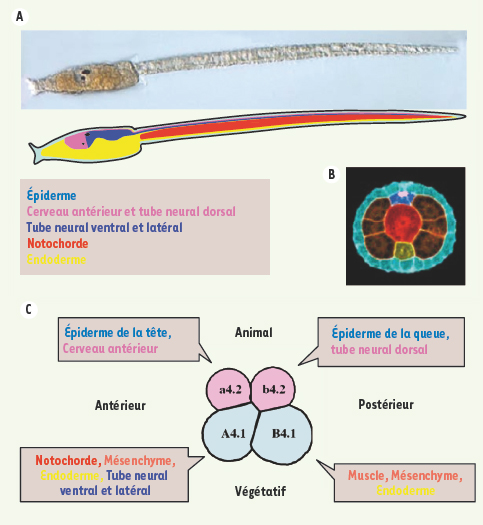
Le têtard d’ascidie est une larve typique de chordé L’œuf fécondé de l’ascidie Ciona intestinalis se développe en moins de 24 heures en un petit têtard (Figure 1A). De moins d’un millimètre de long, ce dernier est constitué de 2 600 cellules seulement. Cette larve, qui ne s’alimente pas, s’attache sur un substrat immergé après un à deux jours de nage et se métamorphose en un adulte filtreur dont le plan d’organisation est très dérivé (Figure 1B). Cet animal hermaphrodite arrive à maturité sexuelle en environ 3 mois.
 | Figure 1.
Les ascidies. A. Arbre phylogénétique des bilatériens, montrant le phylum des chordés en rouge. Un embryon de Ciona intestinalis (environ 2 600 cellules) et un embryon de Xenopus laevis (plusieurs millions de cellules) sont illustrés au stade larvaire. Barre d’échelle : 0,1 mm.B. Adultes d’ascidie Ciona intestinalis fixés sur un rocher (photographie Yann Fontana srb©fontana). Les siphons buccal (inhalant) et atrial (exhalant) de chaque animal sont pigmentés en jaune clair. La barre d’échelle indique environ 1 cm. |
Malgré sa simplicité et sa courte vie, le têtard d’ascidie est, dans son organisation, proche des larves de vertébrés (Figure 2A, B). La tête contient le cerveau, des organes sensoriels, un système digestif immature et les précurseurs non différenciés de la majorité des structures adultes. La tête est prolongée par une queue natatoire dotée d’une nageoire acellulaire médiane, et organisée autour d’une notochorde, tissu de soutien caractéristique du groupe des chordés (tuniciers, vertébrés et céphalochordés). La notochorde est flanquée de muscles latéraux, d’un tube nerveux dorsal et d’un territoire endodermique ventral (Figure 2B). Le nombre de cellules de la majorité des tissus est invariant et remarquablement petit. Ainsi, on ne compte que 5 paires de motoneurones, 36 cellules musculaires et 40 cellules de notochorde ; cependant, des homologies régionales peuvent être établies avec les vertébrés. Ainsi, la région la plus rostrale du tube neural exprime le marqueur des cerveaux antérieurs et moyens, Otx, la partie médiane exprime les gènes Hox1 et Hox3, qui spécifient les rhombomères du cerveau postérieur chez les vertébrés. La rangée ventrale du tube neural postérieur exprime les gènes HNF-3/FoxA et hedgehog qui marquent la région la plus ventrale du tube neural des vertébrés.
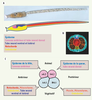 | Figure 2.
Contribution de chacun des lignages fondateurs à la larve d’ascidie. A. Coupe sagittale à travers une larve de Ciona intestinalis, montrant la position des dérivés de chacun des lignages fondateurs. Le muscle et le mésenchyme sont en position latérale et ne peuvent pas être vus sur cette coupe. B. Coupe transversale d’une queue de larve d’ascidie (Boltenia villosa) montrant les cellules de l’épiderme en bleu turquoise, une cellule dorsale du tube nerveux en rose, trois cellules ventro-latérales du tube nerveux postérieur en bleu foncé, une cellule de la notochorde en rouge, le tissu endodermique en jaune et 6 cellules du muscle en orange (d’après [
38]). La nageoire acellulaire médiane n’est pas visible sur cette coupe. C. Schéma d’un embryon au stade 8 cellules (vue latérale). à ce stade, les 4 lignages fondateurs, nommés a, A, b et B, donnent naissance aux principaux tissus indiqués. Les cellules animales sont en rose, les cellules végétatives en bleu-gris. |
|
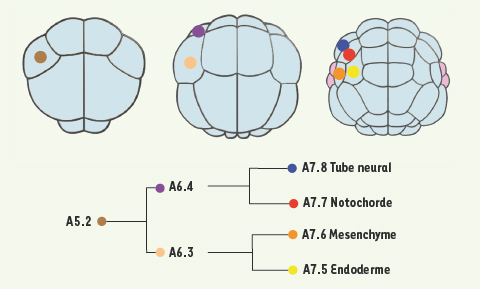
Fécondation et déterminants maternels de la formation des axes embryonnaires Les ovocytes de Ciona intestinalis ont un diamètre de 140 µm environ et sont relâchés dans le milieu marin en même temps que les spermatozoïdes. Le premier cycle cellulaire après fécondation externe dure une heure environ. Les blastomères se divisent ensuite toutes les 30 minutes à 18°C selon des plans de clivage invariants jusqu’en cours de gastrulation. Cette caractéristique permet d’identifier et de nommer chacun des blastomères des stades précoces du développement et de suivre précisément la position et le destin de leurs descendants. Ainsi, les lignages antérieurs sont nommés avec la lettre A (les postérieurs avec B), en majuscule pour les végétatifs et en minuscule pour les animaux (Figure 2C). Un code chiffré ajouté à cette lettre indique le stade et la position spécifique de la cellule. Ainsi, la cellule A5.2 est en position antérieure végétative au stade 32 cellules et donne les cellules filles A6.3 et A6.4 au stade 64 cellules (Figure 3). À partir du stade 16 cellules, les divisions deviennent asynchrones, les blastomères végétatifs se divisant en premier pour former une blastula de 16, 24, 32, 44 et 64 cellules. L’embryon gastrule à partir du stade 110 cellules. Dès ce stade, la plupart des blastomères ne contribuent qu’à un seul type de tissu, mais certains blastomères voient leur destin restreint à un seul tissu dès la blastula (par exemple, voir la Figure 3).
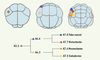 | Figure 3.
Un exemple de clivages invariants : le lignage de la cellule A5.2 entre les stades 16 et 64 cellules.Les cellules végétatives sont représentées en bleu-gris, les cellules animales en rose. Au stade 64 cellules chaque cellule de ce lignage adopte un destin unique. Le lignage des cellules de Ciona, leurs destins et leur morphologie peuvent être explorés de manière interactive sur la base de données Aniseed (http://aniseed-ibdm.univ-mrs.fr). Tous les schémas présentent des vues végétatives des embryons. |
L’axe animal-végétatif est défini au cours de l’ovogenèse par la localisation de composants intracellulaires et d’ARNm. Comme chez les vertébrés, il préfigure la séparation entre l’endoderme, au pôle végétatif, le mésoderme, dans la région équatoriale, et l’ectoderme, au pôle animal. Les déterminants maternels localisés impliqués ne sont pas encore identifiés, mais, comme chez l’oursin, la β-caténine maternelle joue un rôle important dans la lecture des déterminants végétatifs [
7]. La formation de l’hémisphère animal requiert, elle, l’action du facteur de transcription maternel Gata4/5/6 [
8]. La fécondation de l’ovocyte induit la formation d’un second axe dont le pôle postérieur est situé du côté du point d’entrée du spermatozoïde. Cet événement provoque deux phases de réorganisation du cytoplasme [
9]. En 1905, E.G. Conklin identifie dans l’œuf différents domaines cytoplasmiques, dont certains se déplacent au cours des réorganisations cytoplasmiques. Il décrit notamment un domaine cortical de couleur jaune clair, qui migre d’abord au pôle végétatif puis est amené au futur pôle postérieur à la fin du premier cycle cellulaire mitotique [2]. Il nomme ce domaine myoplasme car principalement hérité par les cellules qui formeront le muscle larvaire. Presque un siècle après les travaux de E.G. Conklin, l’équipe de H. Nishida identifie chez Halocynthia roretzi un ARNm dont la localisation est concomitante à celle du myoplasme, macho-1. Ce facteur de transcription à doigts de zinc de la famille Zic est à la fois nécessaire et suffisant pour la formation du muscle primaire [
10]. Le rôle de macho-1 ne semble toutefois pas restreint à la formation du muscle. Il est requis plus généralement dans la formation des dérivés postérieurs végétatifs [
11]. De manière intéressante, des expériences de transplantation de cytoplasme ou d’injection de morpholinos antisens contre macho-1 suggèrent que l’absence de déterminants maternels végétaux postérieurs suffit au développement des territoires végétatifs antérieurs. Cette situation contraste avec la logique des embryons de vertébrés, où la formation de destins antérieurs requiert la présence de déterminants antérieurs spécifiques [
12]. macho-1 n’est pas la seule protéine traduite à partir d’un ARNm localisé dans la partie postérieure végétative de l’œuf. Une quarantaine de tels ARNm ont été identifiés [
13], et au moins un autre, Ci-pem, codant pour une protéine sans motif fonctionnel reconnaissable, joue un rôle important dans le positionnement des premiers plans de clivage [
14]. |
De 8- à 32 cellules : autonomie cellulaire du programme zygotique précoce La spécification des axes a lieu de manière précoce : au stade 4 cellules pour l’axe antéro-postérieur et 8 cellules pour l’axe animal-végétatif. Isolés et cultivés de façon indépendante à partir du stade 4 cellules, les blastomères antérieurs (A3) ne donnent naissance qu’à des territoires antérieurs, les blastomères B3 ne donnant eux que des territoires postérieurs. Le facteur macho-1 joue un rôle important dans cette régionalisation et 13 cibles zygotiques de ce facteur au stade 32 cellules ont été identifiées par Yagi et al. [
15]. Ces gènes sont exprimés dans le muscle notamment et contiennent dans leurs séquences flanquantes des séquences de fixation pour macho-1. Au moins trois de ces gènes, Tbx6b et c et ZicL, sont requis pour la différenciation musculaire [
16]. macho-1 n’est cependant probablement pas le seul facteur maternel impliqué dans la spécification de l’axe antéro-postérieur. Le gène FoxAa est exprimé au stade 8 cellules dans les dérivés antérieurs, et est requis pour l’acquisition de leur identité [16,
17]. Celle-ci semble indépendante de macho-1 dans l’hémisphère animal [15], et les séquences régulatrices de FoxAa ne contiennent pas de sites pour ce facteur (Denans, Lamy et Lemaire, données non publiées). Entre les stades 4 et 8 cellules, le troisième clivage sépare les hémisphères animaux et végétatifs, et les destins cellulaires correspondants (Figure 2C). L’injection de morpholinos antisens contre la β-caténine conduit à l’animalisation de l’embryon tandis que sa surexpression donne une identité végétative (endoderme) à l’ensemble des territoires embryonnaires [7]. En aval de la β-caténine, parmi la dizaine de cibles identifiées (revue dans [
18]), trois gènes activés à partir du stade 16 cellules dans les territoires végétatifs pourraient être des cibles directes : FoxD, FGF9/16/20 et FoxA-a. Tous trois sont requis pour l’activation ultérieure de Brachyury dans la notochorde [
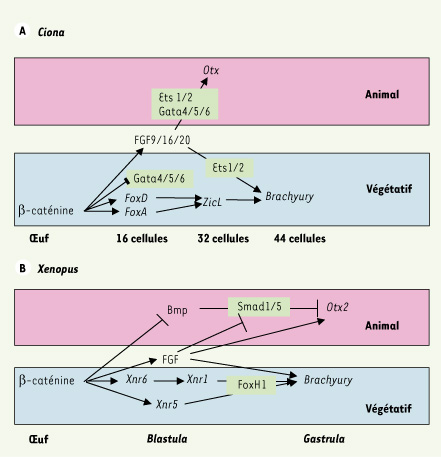
19, 6]. Une cascade de gènes se met ainsi en place en aval de la β-caténine (Figure 4A).
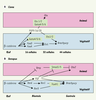 | Figure 4.
Comparaison des réseaux de gènes spécifiant la notochorde et le tissu neural antérieur chez Ciona (A) et le xénope (B). Les gènes indiqués sur fond vert clair sont des gènes à transcrits maternels. Les deux réseaux possèdent quelques éléments communs (voie FGF) et de nombreuses différences (facteurs Xnr). Les stades de développement sont indiqués horizontalement, les hémisphères, verticalement. |
L’hémisphère animal apparaît comme un territoire plus uniforme jusqu’au stade 32 cellules. L’exclusion progressive de l’activité β-caténine nucléaire de ce territoire permet l’activation par le facteur maternel GATA4/5/6 de gènes pan-animaux précoces tels que Friend of Gata (Fog) au stade 16 cellules [8]. Ainsi, au début du stade 32 cellules, l’embryon d’ascidie est assez grossièrement régionalisé. Contrairement aux vertébrés, certains tissus mésendodermiques (endoderme, ectoderme, muscle) sont spécifiés très précocement et de manière autonome (indépendamment de l’environnement). Enfin, si un rôle de la β-caténine dans la formation des territoires végétatifs apparaît relativement conservé, les déterminants maternels musculaires, de l’ectoderme et de l’endoderme diffèrent entre ascidies et vertébrés. |
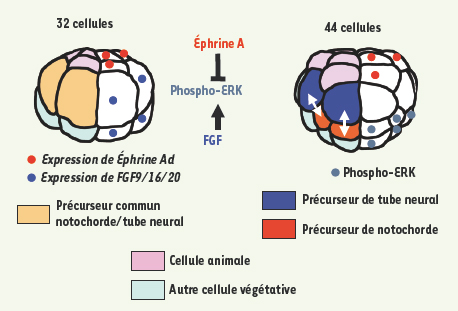
De la fin du stade 32 cellules au début de la gastrulation : raffinement du patron par des phénomènes d’induction À partir du stade 32 cellules, le facteur sécrété FGF9/16/20 initie une cascade d’inductions qui conduit à la définition puis à la régionalisation des tissus manquants : notochorde, mésenchyme, système nerveux et cœur [18]. L’induction de la notochorde et du système nerveux illustre le raffinement des mécanismes de contrôle des inductions dans les embryons de Ciona. Le FGF 9/16/20, exprimé à partir du stade 16 cellules dans les cellules végétatives, entraîne à la fois l’induction de la notochorde dans l’hémisphère animal et celle du tissu neural dans l’hémisphère végétatif. L’analyse des séquences régulatrices des gènes Brachyury, exprimé dans la notochorde et requis pour sa formation, et Otx, exprimé dans le tissu neural induit, a permis de comprendre comment le même FGF pouvait induire deux tissus distincts (Figure 4A). Dans les deux cas, la voie FGF active la MAP-kinase ERK et, en aval de celle-ci, le facteur maternel ETS1/2 qui se comporte comme un médiateur général de cette voie. ETS1/2 coopère néanmoins avec des facteurs distincts, spécifiques de chaque hémisphère. Dans les territoires végétatifs, il s’agit des facteurs de compétence FoxA-a, FoxD et ZicL, cibles zygotiques de la β-caténine maternelle [
20]. Dans les territoire animaux il s’agit du facteur maternel GATA4/5/6, qui relaye lui même l’action du FGF [
21]. La cascade qui émerge semble ainsi bien différente de celle mise en évidence chez les vertébrés (Figure 4B). En particulier, les voies Nodal et Bmp qui jouent un rôle majeur dans l’induction de la notochorde et du tissu neural chez les vertébrés [
40,
41], n’interviennent que marginalement dans ces processus chez Ciona [18]. Lors de la formation de la notochorde et du tissu neural, seule une partie des territoires compétents est induite. Cette restriction de l’induction à certains précurseurs compétents est bien comprise depuis peu et repose sur des logiques différentes dans les deux hémisphères. Dans l’hémisphère végétatif, les précurseurs communs à la notochorde et au tube neural postérieur expriment FGF9/16/20 au stade 32 cellules, mais seule la cellule fille la plus végétative peut lire ce signal au stade 44 cellules et adopter un destin de notochorde (Figure 5). Comment expliquer cette polarisation de la lecture du signal inducteur ? Des expériences élégantes de recombinaison et d’ablation de blastomères ont indiqué qu’un signal inhibiteur issu des cellules animales polarisait la cellule mère au stade 32 cellules [
22]. Le gène EphrinAd, exprimé dans l’ensemble des cellules animales précoces, code pour ce signal. L’Éphrine agit en empêchant la phosphorylation de ERK par la voie FGF [
23]. Ce mode original de polarisation d’une cellule démontre que les molécules Ephrine peuvent jouer un rôle direct dans la spécification des destins cellulaires.
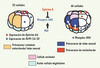 | Figure 5.
Contrôle spatial de l’induction de la notochorde. Le signal éphrine au pôle animal empêche l’activation de ERK par le FGF dans les cellules précurseurs du tube neural. |
Dans l’hémisphère animal, le choix des cellules compétentes induites est également dicté par la géométrie de l’embryon, mais ne semble pas impliquer de signal asymétriquement distribué. Le signal FGF agissant à très courte distance, peut-être par contact, l’étendue de la surface de contact entre cellules animales compétentes et cellules inductrices semble être le déterminant majeur du choix des cellules induites [
24]. |
De l’étude de quelques gènes à l’établissement de réseaux de gènes Cette brève description des mécanismes de spécification de la notochorde et du système nerveux illustre d’une part les progrès rapides obtenus, la sophistication des mécanismes de contrôle à l’œuvre dans ces embryons apparemment simples, mais aussi la puissance de la combinaison d’analyses de régions cis-régulatrices et d’expériences de perte de fonction. Cette approche, couplée à un atlas spatio-temporel extensif des patrons d’expression de plus de 500 gènes de facteurs de transcription ou de signalisation [
25,
26], permet de dresser, à chaque stade du développement, un schéma précis des gènes exprimés dans chacune des cellules de l’embryon, puis de les relier à leurs régulateurs en amont et à leurs cibles en aval. De telles cascades géniques émergent pour le mésenchyme [6], le muscle [16], le cœur [
27], la régionalisation de la plaque neurale [
28] ou de l’épiderme de la queue [6,
29]. L’analyse systématique de la perte de fonction d’une trentaine de gènes régulateurs exprimés au stade du zygote a conduit à l’émergence d’un réseau de régulation plus général couvrant l’embryon entier jusqu’au démarrage de la gastrulation, un succès qui n’a encore été atteint dans aucun autre système modèle [6]. Ces réseaux de régulation mettent en évidence les gènes clés situés aux nœuds du réseau et leurs relations hiérarchiques. Encore incomplets, ils incluent probablement beaucoup de liens indirects. L’analyse des régions cis-régulatrices de certains gènes clés, tels Otx ou Brachyury, a permis de découvrir les facteurs régulant directement leur expression [21,
30], ainsi que la logique transcriptionnelle sous-jacente. Les génomes de C. intestinalis et C. savignyi ont été entièrement séquencés et le niveau de conservation de leurs séquences non-codantes est propice aux approches d’empreinte phylogénétique. Ces approches, alliées à la puissance des techniques d’électroporation, ont permis l’identification en quelques années de plusieurs centaines de séquences régulatrices, actives dans tous les tissus majeurs. L’extension à l’ensemble des gènes du réseau des analyses fines des régions cis-régulatrices constitue désormais un des grands chantiers de la biologie des systèmes chez Ciona. |
Architecture des réseaux et évolution des plans du corps Quel type d’information apportent ces réseaux émergents ? Tout d’abord, l’ascidie Ciona intestinalis est un modèle très bien adapté à l’étude des liens entre l’expression du programme génétique et l’état physiologique ou le comportement des cellules, l’identification de gènes effecteurs cibles des réseaux développementaux étant plus facile que dans d’autres systèmes [
31]. Deuxièmement, l’analyse de l’architecture des réseaux permet de comprendre les détails de la logique du programme développemental [
32]. Ainsi, par exemple, l’établissement d’une boucle positive de régulation en aval d’un signal inducteur transitoire permet de maintenir durablement l’expression des cibles après la disparition du signal. D’autres sous-réseaux permettent eux de n’activer des cibles qu’en la présence d’un signal inducteur persistant. La recherche de sous-réseaux commence à peine chez Ciona, mais il sera intéressant de comparer l’architecture générale des réseaux dans l’embryon simple de Ciona et ceux plus complexes des vertébrés. Par ailleurs, la modification des séquences régulatrices, et donc de l’architecture des réseaux, joue un rôle très important dans l’évolution de la morphologie des animaux [
33]. Les réseaux sont généralement modulaires, mais tous les modules ne sont pas également conservés. Seule une petite fraction des modules est conservée à grande distance évolutive, indiquant des mécanismes qui semblent incontournables [32]. Par exemple, la formation du cœur semble être sous-tendue par un mécanisme conservé des arthropodes (Drosophila) aux chordés (Ciona, vertébrés) [
34,
35]. Pourtant de surprenantes différences de stratégie apparaissent également au sein des chordés. Ainsi la voie Nodal, qui joue un rôle crucial pour une grande majorité des dérivés mésodermiques et endodermiques des vertébrés (revue dans [
36]), ne semble spécifier qu’une partie très restreinte des cellules du mésoderme de l’ascidie Ciona intestinalis [
37]. La persistance d’un plan du corps commun, et donc probablement ancestral, paraît donc compatible avec des changements majeurs dans les réseaux géniques et des stratégies développementales. Une meilleure connaissance des réseaux géniques des ascidies et des vertébrés permettra, en les comparant, de mettre en évidence le degré de liberté des génomes pour former un plan du corps donné, et d’identifier de possibles étapes incontournables. |
Les auteurs remercient les membres de l’équipe pour de nombreuses et fructueuses discussions. Ils remercient également les membres du Service Mer et Observation de la Station biologique de Roscoff pour la collecte d’animaux. Un grand merci à Yann Fontana pour la photo de la Figure 1B.
|
1. Chabry L. Contribution à l’embryologie normale et tératologique des ascidies simples. J Anat Physiol (Paris) 1887; 23 : 167–319. 2. Conklin EG. Mosaic development in ascidian eggs. J Exp Zool 1905; 2 : 145–223. 3. Blair JE, Hedges SB. Molecular phylogeny and divergence times of deuterostome animals. Mol Biol Evol 2005; 22 : 2275–84. 4. Delsuc F, Brinkmann H, Chourrout D, et al. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature 2006; 439 : 965–8. 5. Dehal P, Satou Y, Campbell RK, et al. The draft genome of Ciona intestinalis: insights into chordate and vertebrate origins. Science 2002; 298 : 2157–67. 6. Imai KS, Levine M, Satoh N, et al. Regulatory blueprint for a chordate embryo. Science 2006; 312 : 1183–7. 7. Imai K, Takada N, Satoh N, et al. Beta-catenin mediates the specification of endoderm cells in ascidian embryos. Development 2000; 127 : 3009–20. 8. Rothbächer U, Bertrand V, Lamy C, et al. A combinatorial code of maternal GATA, Ets and beta-catenin-TCF transcription factors specifies and patterns the early ascidian ectoderm. Development 2007; 134 : 4023–32. 9. Sardet C, Prodon F, Prulière G, et al. Polarisation des œufs et des embryons : principes communs. Med Sci (Paris) 2004; 20 : 414–23. 10. Nishida H, Sawada K. Macho-1 encodes a localized mRNA in ascidian eggs that specifies muscle fate during embryogenesis. Nature 2001; 409 : 724–9. 11. Kobayashi K, Sawada K, Yamamoto H, et al. Maternal macho-1 is an intrinsic factor that makes cell response to the same FGF signal differ between mesenchyme and notochord induction in ascidian embryos. Development 2003; 130 : 5179–90. 12. Kageura H. Activation of dorsal development by contact between the cortical dorsal determinant and the equatorial core cytoplasm in eggs of Xenopus laevis. Development 1997; 124 : 1543–51. 13. Prodon F, Yamada L, Shirae-Kurabayashi M, et al. Postplasmic/PEM RNAs: a class of localized maternal mRNAs with multiple roles in cell polarity and development in ascidian embryos. Dev Dyn 2007; 236 : 1698–715. 14. Negishi T, Takada T, Kawai N, et al. Localized PEM mRNA and protein are involved in cleavage-plane orientation and unequal cell divisions in ascidians. Curr Biol 2007; 17 : 1014–25. 15. Yagi K, Satoh N, Satou Y. Identification of downstream genes of the ascidian muscle determinant gene Ci-macho1. Dev Biol 2004; 274 : 478–89. 16. Yagi K, Takatori N, Satou Y, et al. Ci-Tbx6b and Ci-Tbx6c are key mediators of the maternal effect gene Ci-macho1 in muscle cell differentiation in Ciona intestinalis embryos. Dev Biol 2005; 282 : 535–49. 17. Lamy C, Rothbächer U, Caillol D, et al. Ci-FoxA-a is the earliest zygotic determinant of the ascidian anterior ectoderm and directly activates Ci-sFRP1/5. Development 2006; 133 : 2835–44. 18. Nishida, H. Specification of embryonic axis and mosaic development in ascidians. Dev Dyn 2005; 233 : 1177–93. 19. Satou Y, Imai KS, Satoh N. Early embryonic expression of a LIM-homeobox gene Cs-lhx3 is downstream of beta-catenin and responsible for the endoderm differentiation in Ciona savignyi embryos. Development 2001; 128 : 3559–70. 20. Kumano G, Yamaguchi S, Nishida H. Overlapping expression of FoxA and Zic confers responsiveness to FGF signaling to specify notochord in ascidian embryos. Dev Biol 2006; 300 : 770–84. 21. Bertrand V, Hudson C, Caillol D, et al. Neural tissue in ascidian embryos is induced by FGF9/16/20, acting via a combination of maternal GATA and Ets transcription factors. Cell 2003; 115 : 615–27. 22. Kim GJ, Kumano G, Nishida H. Cell fate polarization in ascidian mesenchyme/muscle precursors by directed FGF signaling and role for an additional ectodermal FGF antagonizing signal in notochord/nerve cord precursors. Development 2007; 134 : 1509–18. 23. Picco V, Hudson C, Yasuo H. Ephrin-Eph signalling drives the asymmetric division of notochord/neural precursors in Ciona embryos. Development 2007; 134 : 1491–7. 24. Tassy O, Daian F, Hudson C, et al. A quantitative approach to the study of cell shapes and interactions during early chordate embryogenesis. Curr Biol 2006; 16 : 345–58. 25. Imai KS, Hino K, Yagi K, et al. Gene expression profiles of transcription factors and signaling molecules in the ascidian embryo: towards a comprehensive understanding of gene networks. Development 2004; 131 : 4047–58. 26. Miwata K, Chiba T, Horii R, et al. Systematic analysis of embryonic expression profiles of zinc finger genes in Ciona intestinalis. Dev Biol 2006; 292 : 546–54. 27. Davidson B, Shi W, Beh J, et al. FGF signaling delineates the cardiac progenitor field in the simple chordate, Ciona intestinalis. Genes Dev 2006; 20 : 2728–38. 28. Hudson C, Yasuo H. Patterning across the ascidian neural plate by lateral Nodal signalling sources. Development 2005; 132 : 1199–210. 29. Pasini A, Amiel A, Rothbächer U, et al. Formation of the ascidian epidermal sensory neurons: insights into the origin of the chordate peripheral nervous system. PLoS Biol 2006; 4 : e225. 30. Matsumoto J, Kumano G, Nishida H. Direct activation by Ets and Zic is required for initial expression of the Brachyury gene in the ascidian notochord. Dev Biol 2007; 306 : 870–82. 31. Davidson B, Christiaen L. Linking chordate gene networks to cellular behavior in ascidians. Cell 2006; 124 : 247–50. 32. Davidson EH, Erwin DH. Gene regulatory networks and the evolution of animal body plans. Science 2006; 311 : 796–800. 33. Wray GA. The evolutionary significance of cis-regulatory mutations. Nat Rev Genet 2007; 8 : 206–16. 34. Cripps RM, Olson EN. Control of cardiac development by an evolutionarily conserved transcriptional network. Dev Biol 2002; 246 : 14–28. 35. Davidson B, Levine M. Evolutionary origins of the vertebrate heart: specification of the cardiac lineage in Ciona intestinalis. Proc Natl Acad Sci USA 2003; 100 : 11469–73. 36. Weng W, Stemple DL. Nodal signaling and vertebrate germ layer formation. Birth Defects Res C Embryo Today 2003; 69 : 325–32. 37. Hudson C, Yasuo H. A signalling relay involving Nodal and Delta ligands acts during secondary notochord induction in Ciona embryos. Development 2006; 133 : 2855–64. 38. Munro EM, Odell G. Morphogenetic pattern formation during ascidian notochord formation is regulative and highly robust. Development 2002; 129 : 1–12. 39. Delsuc F, Baurain D, Philippe H. Origine des vertébrés : la tunique fait-elle le moine ? Med Sci (Paris) 2006; 22 : 688–90. 40. Vincent S. Mise en place de l’asymétrie droite-gauche : Notch et Nodal dans le nœud embryonnaire. Med Sci (Paris) 2003; 19 : 1188–90. 41. Dubois L. Morphogènes et endocytose. Med Sci (Paris) 2003; 19 : 351–7. |