| |
| Med Sci (Paris). 2008 March; 24(3): 284–289. Published online 2008 March 15. doi: 10.1051/medsci/2008243284.Granulopoïèse et leucémogenèse Ce que nous apportent les neutropénies congénitales Jean Donadieu,1* Blandine Beaupain,2 and Christine Bellanné-Chantelot3 1Coordinateur du registre français des neutropénies, Service d’Hémato-oncologie Pédiatrique, Registre français des neutropénies congénitales, Hôpital Trousseau, 26, avenue du Docteur Arnold Netter, 75012 Paris, France 2Monitrice d’étude clinique, registre français des neutropénies, Service d’Hémato-oncologie Pédiatrique, Registre français des neutropénies congénitales, Hôpital Trousseau, 26, avenue du Docteur Arnold Netter, 75012 Paris, France 3Département de Génétique, Groupe Hospitalier Pitié-Salpétrière, 47/83, boulevard de l’Hôpital, 75013 Paris, France |
La granulopoïèse est le processus physiologique qui assure la production des polynucléaires neutrophiles du sang et la régule. Les polynucléaires neutrophiles (dénommés dans la suite du texte « neutrophiles ») sont les cellules responsables, avec les cellules de la lignée monocytaire, de la défense immunitaire innée, naïve. Cette action anti-infectieuse est dirigée contre les bactéries et les champignons et repose sur le phénomène physiologique de la phagocytose, pour lequel les cellules sont armées d’un arsenal de protéases, de peptides anti-microbiens et de réactifs oxydatifs [
1,
2]. Ces cellules jouent aussi un rôle dans l’inflammation et la cicatrisation. Ce système cellulaire n’est pas « éducable », contrairement au système lymphocytaire, et il est très primitif dans la phylogenèse, retrouvé chez les mollusques comme cela a été décrit par Elie Metchnikof dès 1891 [
3]. La dynamique globale du système et la répartition des neutrophiles dans l’organisme ont été décrites par des méthodes de radio-marquage dans les années 1960-1970, permettant de calculer les ordres de grandeur de la durée de la granulopoïèse (entre 7 et 13 jours), et la durée de vie des cellules (demi-vie entre 4 et 7 heures pour les granuleux dans le sang périphérique). Les neutrophiles circulants ne représentent que 1 à 5 % de la totalité des granuleux et leur nombre total est d’environ 35 x 107 par kilo de poids [
4]. À partir des années 1980 et jusqu’à la fin des années 1990, les substances contrôlant ce processus, dénommées les cytokines, sont décrites de même que leurs mécanismes d’action et leurs interactions. Ces découvertes ont permis d’aboutir à des succès pharmaceutiques comme celui du G-CSF (granulocyte colony-stimulating factor) et de l’érythropoïétine, dont l’usage thérapeutique a modifié la prise en charge des patients dans de très nombreux domaines de la médecine, comme la néphrologie, l’ensemble de la cancérologie et l’hématologie. La dernière « strate » de connaissance vient de la découverte des bases moléculaires de plusieurs neutropénies congénitales. Ces anomalies se situent dans un axe de connaissance bien distinct des précédentes connaissances et obligent à reconsidérer la physiologie de la granulopoïèse. |
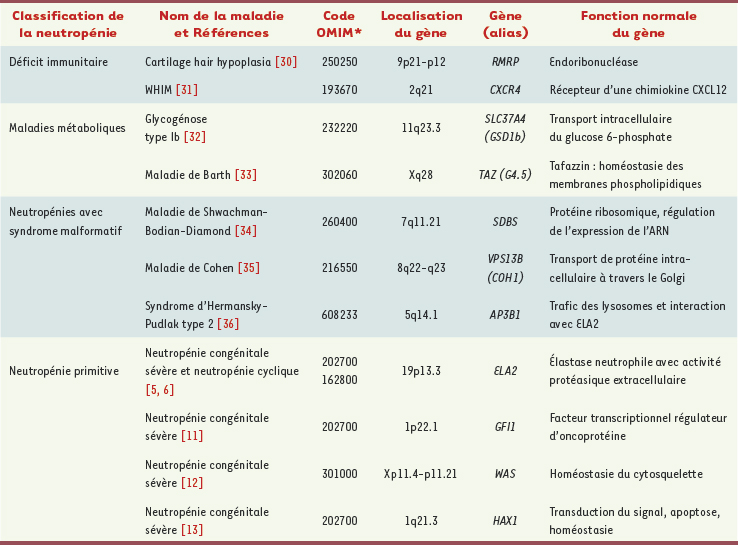
Généralités sur les neutropénies congénitales La neutropénie se définit par un nombre de neutrophiles mesurés dans le sang circulant inférieur à 1500/mm3. La neutropénie est qualifiée de sévère lorsque ce nombre est inférieur à 500/mm3. Elle est chronique si la neutropénie persiste au delà de trois mois. La neutropénie est dite permanente si elle persiste sur tous les hémogrammes répétés sur une période de temps assez grande (au minimum de 3 mois). Elle est intermittente s’il existe des périodes de correction spontanée de la neutropénie. Si la périodicité des épisodes de neutropénie et de récupération est de 21 jours, la neutropénie est dite cyclique. La neutropénie est dite « centrale » s’il existe une diminution du compartiment de réserve médullaire des neutrophiles, objectivée par une diminution des stades tardifs de maturation sur le myélogramme (en particulier diminution de la proportion des neutrophiles matures de la moelle en dessous de 10 %), et la neutropénie est dite « périphérique » si la maturation des neutrophiles est normale dans la moelle osseuse. Les conséquences cliniques de la neutropénie sont infectieuses : si la susceptibilité aux infections est faible lorsque le nombre de neutrophiles excède 1000/mm3, et augmente modérément entre 1000 et 200/mm3, elle devient très importante pour des nombres inférieurs à 200/mm3. Les sites les plus fréquents ciblés par ces infections sont cutanéo-muqueux, ORL et pulmonaires. Les manifestations stomatologiques, quasi-constantes en cas de neutropénie centrale profonde, sont la gingivite, avec parodontopathie, associée à des aphtes. Les germes rencontrés sont des bactéries et des champignons. Pratiquement dans toutes les neutropénies, l’administration thérapeutique de G-CSF augmente le nombre de neutrophiles et abolit le risque infectieux. Dans les neutropénies congénitales, le schéma thérapeutique est en règle personnalisé, certains patients ne reçoivent du G-CSF qu’à petites doses « à la demande » (< 5 µg/kg/jour, moins de 30 jours par an), tandis que d’autres reçoivent du G-CSF à forte dose au long cours (> 15 µg/kg/jour plus de 90 jours par an). Dans de rares cas, la neutropénie est résistante au G-CSF. La transplantation médullaire est efficace, à la fois en cas de résistance au G-CSF mais aussi pour traiter les transformations leucémiques. Pour affirmer le caractère congénital de la neutropénie, de très nombreuses étiologies acquises (infectieuses, auto-immunes, pathologies malignes…) doivent avoir été éliminées. En dehors de l’identification d’une anomalie génétique constitutionnelle et causale, seule la reconstitution de l’histoire de la maladie du patient permet d’affirmer le caractère congénital de la maladie. En pratique, parmi les neutropénies congénitales, 3 cadres nosologiques sont retrouvés (Tableau I) :
 | Tableau I.
Principaux gènes impliqués dans les neutropénies congénitales.
|
-
les neutropénies associées à un déficit fonctionnel ou quantitatif de la lignée lymphocytaire.
-
Les neutropénies associées à un syndrome malformatif ou à une anomalie métabolique bien définie. Ici la neutropénie est un élément parmi d’autres au sein d’un syndrome complexe.
-
Les neutropénies congénitales primitives. La neutropénie est au premier plan de la maladie. Ce groupe de maladies comporte schématiquement deux entités : la neutropénie congénitale sévère, où le nombre de neutrophiles est en règle constamment inférieur à 200/mm3, et la neutropénie cyclique caractérisée par une fluctuation régulière (cycle de 16 à 28 jours) du nombre des neutrophiles.
|
Bases moléculaires des neutropénies congénitales primitives : les gènes ELA2, GFI1, WAS et HAX1
ELA2 Une analyse de liaison et un clonage positionnel chez 13 familles avec une longue histoire de neutropénie cyclique, de transmission autosomique dominante, révélèrent en 1999 [
5] plusieurs mutations hétérozygotes du gène de l’élastase neutrophile de type 2 (ELA2). ELA2 est une sérine protéase clivant tout particulièrement l’élastine, et dont l’inhibiteur physiologique est l’α1-antitrypsine. ELA2 est homologue à 2 autres protéases du polynucléaire : la protéinase 3 (cible des anticorps dirigés contre le cytoplasme des polynucléaires présents dans la maladie de Wegener) et l’azurocidine. Ces 3 protéines, dont les gènes sont contigus sur le chromosome 19p13.3, sont régulées conjointement. ELA2 est empaquetée sélectivement dans les granules azurophiles des polynucléaires dès le stade des promyélocytes, mais une partie peut être libérée à la surface de la cellule ou dans le cytoplasme. Rapidement après la découverte de l’implication d’ELA2 dans les neutropénies cycliques, des mutations du gène ont été identifiées dans les neutropénies congénitales sévères (45 mutations répertoriées), contribuant à rapprocher ces 2 entités auparavant considérées comme distinctes. Cette anomalie génétique est présente dans 35 % à 70 % des neutropénies congénitales sévères et 40 % des neutropénies cycliques [
6]. Certaines mutations, entraînant l’apparition d’un codon stop prématuré et par conséquent la synthèse d’une protéine tronquée (absence du dernier exon), ne sont observées que dans les neutropénies congénitales sévères et permanentes. Quelques mutations sont communes aux deux types de neutropénies, cyclique et permanente. L’effet des mutations sur la protéine est encore mal compris. La souris dont le gène ELA2 est inactivé n’est pas neutropénique, ni la souris porteuse d’une mutation de ELA2 responsable de neutropénie congénitale sévère chez l’homme [
7]. De même, il n’a pas été retrouvé de corrélation entre les mutations et l’activité enzymatique de la protéine. En revanche, des anomalies de conformation de la protéine et son accumulation au niveau intracytoplasmique [
8,
9] ont été décrites. Un taux excessif de la protéine entraînerait une mort cellulaire par apoptose. Notre connaissance des conséquences des mutations d’ELA2 sur le trafic intracellulaire de la protéine, et tout particulièrement sur son empaquetage dans les granules, a bénéficié de l’exploration d’une pathologie génétique ayant des conséquences très proches et impliquant le gène codant pour la protéine AP3. Cette protéine « cargo » est responsable du trafic intraluminal des protéines de l’appareil de Golgi vers les lysosomes, dont les granules du polynucléaire sont un exemple. Les mutations de la sous-unité β du tétramère AP3 sont responsables chez l’homme du syndrome d’Hermansky-Pudlak de type 2 comportant un albinisme partiel et chez le chien « grey collie » d’une neutropénie cyclique considérée comme le modèle animal par excellence de la neutropénie cyclique. De façon remarquable, les mutations d’ELA2 entraînent une inhibition de la liaison avec la protéine AP3, et donc une limitation de son empaquetage [
10]. GFI1 GFI1, une protéine nucléaire, est un facteur répresseur d’un proto-oncogène impliqué dans la formation de lymphomes T et dans le développement des progéniteurs T. Son implication dans la granulopoïèse et l’activité des macrophages a été démontrée dans un modèle de souris knock-out, associant aussi une atteinte de l’oreille interne. Puis, à partir d’une approche gène candidat, l’implication de mutations hétérozygotes de ce gène a été mise en évidence chez 2 patients atteints de neutropénies congénitales qui présentaient également une lymphopénie modérée [
11]. Les mutations de GFI1 entraînent une augmentation de l’expression d’ELA2, rapprochant cette mutation des conséquences des mutations d’ELA2. Protéine du syndrome de Wiskott-Aldrich À partir d’une étude de liaison dans un pedigree évoquant une transmission génétique liée au sexe, des mutations du gène WAS ( Wiskott-Aldrich syndrome protein) ont été identifiées dans une famille de patients porteurs d’une neutropénie congénitale sévère [
12], et plus récemment dans deux autres cas sporadiques. Le phénotype de ces patients est complètement distinct de celui de la forme classique du syndrome de Wiskott-Aldrich qui comporte un eczéma, une thrombocytopénie à petites plaquettes et un déficit immunitaire. Les conséquences fonctionnelles des mutations observées du gène WAS sont également différentes dans ces deux entités : activation de la protéine dans les neutropénies congénitales et défaut d’activité de la protéine dans le syndrome classique. La protéine WAS étant impliquée dans la polymérisation de l’actine intra-cytoplasmique, les mutations observées dans les neutropénies aboutissent à une augmentation de la polymérisation de l’actine, avec en particulier une augmentation du taux de podosomes et une augmentation de l’apoptose cellulaire. HAX1 Le dernier gène identifié dans les neutropénies congénitales est HAX1 (HS1 associated protein X1) [
13]. Une analyse de liaison génétique classique dans trois familles kurdes (dont deux consanguines), suivie d’une cartographie fine de la région d’intérêt sur le chromosome 1q, a conduit à l’identification de HAX1. Ce dernier a été sélectionné parmi les 275 gènes présents dans l’intervalle de liaison sur plusieurs arguments : la protéine est impliquée dans la transduction du signal, l’apoptose et l’organisation du cytosquelette d’actine. Le séquençage du gène a révélé une insertion nucléotidique unique, homozygote, créant un codon stop. L’insertion existait dans le génome de 16 des 63 autres patients étudiés, dont ceux de la famille décrite par R. Kostmann en 1956 (mais dans ce cas, il s’agit d’une mutation distincte de celles des familles kurdes). HAX1 (35 kDa) est une protéine mitochondriale connue, ubiquitaire, ayant de multiples partenaires, anti-apoptotique par son rôle de stabilisation du potentiel membranaire mitochondrial. Les neutrophiles des patients, mais aussi leurs fibroblastes, sont très sensibles aux stimulus apoptotiques, et cette anomalie est corrigée in vitro par la restauration d’un taux normal de la protéine dans les progéniteurs myéloïdes CD34 + médullaires, et in vivo par la fonction anti-apoptotique du G-CSF. HAX1 est d’expression ubiquitaire, on remarque que dans les familles suédoises, issues du pedigree décrit par Rolf Kostmann, une atteinte neurologique est retrouvée chez 5 des 6 patients [
14]. |
Ce que nous apporte la connaissance des bases moléculaires des neutropénies congénitales La connaissance des bases moléculaires des neutropénies congénitales apporte trois informations importantes concernant la granulopoïèse. Un mauvais empaquetage des granules intracellulaires entraîne un déficit des granuleux Le(s) défaut(s) d’empaquetage des enzymes cellulaires dans les granules (dans le cas des mutations ELA2, GFI1, HAX1) et les modifications du cytosquelette ( WASP) modifient ainsi la dynamique de la granulopoïèse, possiblement par excès d’apoptose ou défaut d’engagement cellulaire dans le processus de maturation [
15,
16]. Cela rapproche ces pathologies de plusieurs tableaux cliniques comportant un albinisme et une neutropénie et caractérisant le syndrome d’Hermansky-Pudlak de type 2, le déficit en AP14 [
17] (protéine ayant des fonctions similaires à AP3), le syndrome de Chediak-Higashi et le syndrome de Griscelli, ces 2 dernières entités présentant en plus un syndrome d’activation macrophagique [
18,
19]. On retrouve aussi la mise en cause d’une protéine transmembranaire de l’appareil de golgi dans d’autres pathologies comportant une neutropénie comme la glycogénose Ib et la maladie de Cohen, mais dont l’expression phénotypique met en cause d’autres systèmes. La stabilité intracytoplasmique et les conditions du transport intracellulaires d’ELA2 apparaissent déterminantes Les modifications conformationelles directement induites par les mutations de la protéine ou indirectement par des anomalies induites par des mutations d’AP3 ou de GFI1, contribuent à ces modifications. La neutropénie cyclique et la neutropénie permanente reflètent le caractère chaotique (au sens mathématique) de la granulopoïèse Le lien entre un défaut de production de neutrophiles ou un excès d’apoptose des précurseurs des neutrophiles et la neutropénie permanente se conçoit facilement. Mais l’aspect cyclique apparaît à priori comme incompréhensible, sauf à évoquer l’existence d’une horloge biologique cachée concernant la granulopoïèse, que des mutations précises révéleraient. Pour unifier ces aspects (cyclique et permanent), il est utile de reprendre les notions les plus anciennes sur la dynamique de la granulopoïèse. Tout d’abord on doit rappeler que le chiffre de neutrophiles, chez le sujet sain, varie dans le sang d’une façon importante (entre 1 800 et 4 500/mm3), imprévisible et chaotique [
20]. Par ailleurs, les facteurs « extrinsèques » qui modifient en plus ou en moins le nombre médian de neutrophiles, aboutissent à changer le rythme de variation des neutrophiles dans le sang par rapport au sujet sain. Ainsi, le G-CSF non seulement augmente le nombre de neutrophiles dans le sang, mais entraîne des irrégularités, pseudo-cycliques, du nombre circulant des neutrophiles [
21]. Et a contrario, une drogue cytostatique comme le cyclophosphamide transforme, lorsqu’elle est administrée à petite dose, les variations chaotiques des neutrophiles du sang en variations pseudo-cycliques [
22], alors que de fortes doses entraînent une neutropénie permanente profonde. L’ensemble de ces faits peut être intégré dans un modèle mathématique non linéaire. Ainsi, ce type de modèle permet de décrire les variations temporelles de la taille d’une population depuis une variation chaotique, sans rythme précis, mais entre des bornes fixes, jusqu’à une abolition complète de la population, en passant par une variation quasi-sinusoïdale de l’effectif de cette population, à partir de la variation d’un seul coefficient correspondant au taux de reproduction de la population, qui est le rapport entre la production et la mort des individus qui composent cette population [
23]. Dans le cas de la population des neutrophiles, un excès d’apoptose, dans une proportion variable que l’on ne sait pas quantifier finement, qui peut varier en fonction des mutations précises et du contexte épigénétique [
24], contribue à l’excès de mort cellulaire [16]. Cette modélisation qui reste théorique permet ainsi d’intégrer la situation physiologique et des entités pathologiques impliquant une altération de la granulopoïèse. |
Neutropénie et risque leucémique L’augmentation très importante du risque de leucémies est une donnée majeure chez ces patients. Ainsi, l’incidence cumulée des leucémies parmi les patients porteurs de neutropénie congénitale sévère est d’environ 15 % à l’âge de 20 ans [
25]. Ces leucémies présentent des caractéristiques particulières. Il s’agit principalement de proliférations de cellules très peu différenciées et l’anomalie cytogénétique la plus constante est une monosomie 7. Un grand nombre de ces leucémies est précédé par l’apparition d’anomalies acquises du récepteur du G-CSF [
26]. Ces mutations ne sont pas retrouvées dans les leucémies aiguës myéloblastiques ou lymphoblastiques de novo. L’étude des patients porteurs de mutations ELA2 montre que le facteur de risque principal d’apparition d’une leucémie est la sévérité de la neutropénie et non pas les mutations ELA2 par elles-mêmes. Ainsi le risque leucémique est nul ou très faible dans les neutropénies cycliques. Il est maximum si la neutropénie est permanente, inférieure à 100 neutrophiles/mm3. Plusieurs facteurs sont de fait associés à cette sévérité, comme le nombre d’infections, mais aussi l’utilisation du G-CSF, en particulier lorsque les doses sont élevées (> 15 µg/kg/jour) et le traitement prolongé [25]. Le lien entre les anomalies du récepteur au G-CSF, régulièrement observées chez ces patients avant et lors de la transformation maligne, et la monosomie 7 n’est pas connu ; à l’inverse, il a été montré que les lignées de cellules blastiques porteuses d’une monosomie 7 sont particulièrement sensibles au G-CSF qui sélectionne les cellules porteuses de cette anomalie [
27]. L’absence d’effet oncogénique direct d’ELA2 et l’impact à la fois de la profondeur de la neutropénie - qui modifie fortement les conditions d’homéostasie médullaire et entraîne une hyperstimulation compensatrice de la lignée monocytaire - et des fortes doses du G-CSF démontrent qu’une stimulation médullaire au long cours peut être responsable d’une transformation leucémique. La présence du risque leucémique pour les patients recevant les doses les plus élevés de G-CSF fait envisager, pour eux uniquement, l’indication d’une transplantation médullaire [25,
28,
29]. |
Les auteurs remercient le Dr Laure Coulombel pour sa relecture attentive du manuscrit et ses remarques.
|
1. Chakravarti A, Allaeys I, Poubelle PE. Neutrophil and immunity : is it innate or acquired ? Med Sci (Paris) 2007; 23 : 862–7. 2. Gougerot-Pocidalo MA, El Benna J, My-Chan Dang P, Elbim C. Pathogens trapped in neutrophils nets. Med Sci (Paris) 2007; 23 : 464–5. 3. Metchnikof E. Leçons sur la pathologie comparée de l’inflammation, faites à l’Institut Pasteur en avril et mai 1891. Paris : Masson, 1892. 4. Dresch C, Faille A, Bauchet J, Najean Y. Granulopoïèse : comparaison de differentes methodes d’étude de la durée de maturation et des réserves médullaires. Nouv Rev Fr Hematol 1973; 13 : 5–22. 5. Horwitz M, Benson KF, Person RE, et al. Mutations in ELA2, encoding neutrophil elastase, define a 21-day biological clock in cyclic haematopoiesis. Nat Genet 1999; 23 : 433–6. 6. Bellanne-Chantelot C, Clauin S, Leblanc T, et al. Mutations in the ELA2 gene correlate with more severe expression of neutropenia : a study of 81 patients from the French neutropenia register. Blood 2004; 103 : 4119–25. 7. Grenda DS, Johnson SE, Mayer JR, et al. Mice expressing a neutrophil elastase mutation derived from patients with severe congenital neutropenia have normal granulopoiesis. Blood 2002; 100 : 3221–8. 8. Horwitz MS, Duan Z, Korkmaz B, et al. Neutrophil elastase in cyclic and severe congenital neutropenia. Blood 2007; 109 : 1817–24. 9. Kollner I, Sodeik B, Schreek S, et al. Mutations in neutrophil elastase causing congenital neutropenia lead to cytoplasmic protein accumulation and induction of the unfolded protein response. Blood 2006; 108 : 493–500. 10. Horwitz M, Benson KF, Duan Z, et al. Hereditary neutropenia : dogs explain human neutrophil elastase mutations. Trends Mol Med 2004; 10 : 163–70. 11. Person RE, Li FQ, Duan Z, et al. Mutations in proto-oncogene GFI1 cause human neutropenia and target ELA2. Nat Genet 2003; 34 : 308–12. 12. Devriendt K, Kim AS, Mathijs G, et al. Constitutively activating mutation in WASP causes X-linked severe congenital neutropenia. Nat Genet 2001; 27 : 313–7. 13. Klein C, Grudzien M, Appaswamy G, et al. HAX1 deficiency causes autosomal recessive severe congenital neutropenia (Kostmann disease). Nat Genet 2007; 39 : 86–92. 14. Carlsson G, Fasth A. Infantile genetic agranulocytosis, morbus Kostmann : presentation of six cases from the original « Kostmann family » and a review. Acta Paediatr 2001; 90 : 757–64. 15. Li FQ, Horwitz M. Characterization of mutant neutrophil elastase in severe congenital neutropenia. J Biol Chem 2001; 276 : 14230–41. 16. Mackey MC, Aprikyan AA, Dale DC. The rate of apoptosis in post mitotic neutrophil precursors of normal and neutropenic humans. Cell Prolif 2003; 36 : 27–34. 17. Bohn G, Allroth A, Brandes G, et al. A novel human primary immunodeficiency syndrome caused by deficiency of the endosomal adaptor protein p14. Nat Med 2007; 13 : 38–45. 18. De Saint-Basile G, Fischer A. Defective cytotoxic granule-mediated cell death pathway impairs T lymphocyte homeostasis. Curr Opin Rheumatol 2003; 15 : 436–45. 19. Ménasché G, Ménager M, Le Deist F, et al. Defect in lytic granule exocytosis : several causes, a same effect. Med Sci (Paris) 2006; 22 : 733–8. 20. Morley AA. A neutrophil cycle in healthy individuals. Lancet 1966; 2 : 1220–2. 21. Bonilla MA, Gillio AP, Ruggeiro M, et al. Effects of recombinant human granulocyte colony-stimulating factor on neutropenia in patients with congenital agranulocytosis. N Engl J Med 1989; 320 : 1574–80. 22. Morley A, Stohlman F Jr. Cyclophosphamide-induced cyclical neutropenia. An animal model of a human periodic disease. N Engl J Med 1970; 282 : 643–6. 23. May RM. Simple mathematical models with very complicated dynamics. Nature 1976; 261 : 459–67. 24. Duan Z, Person RE, Lee HH, et al. Epigenetic regulation of protein-coding and microRNA genes by the Gfi1-interacting, tumor suppressor PRDM5. Mol Cell Biol 2007; 27 : 6889–902. 25. Donadieu J, Leblanc T, Bader-Meunier B, et al. Analysis of risk factors for myelodysplasias, leukemia and death from infection among patients with congenital neutropenia. Experience of the French severe chronic neutropenia study group. Haematologica 2005; 90 : 45–53. 26. Germeshausen M, Ballmaier M, Welte K. Incidence of CSF3R mutations in severe congenital neutropenia and relevance for leukemogenesis : results of a long-term survey. Blood 2007; 109 : 93–9. 27. Sloand EM, Yong AS, Ramkissoon S, et al. Granulocyte colony-stimulating factor preferentially stimulates proliferation of monosomy 7 cells bearing the isoform IV receptor. Proc Natl Acad Sci USA 2006; 103 : 14483–8. 28. Ferry C, Ouachee M, Leblanc T, et al. Hematopoietic stem cell transplantation in severe congenital neutropenia : experience of the French SCN register. Bone Marrow Transplant 2005; 35 : 45–50. 29. Rosenberg PS, Alter BP, Bolyard AA, et al. The incidence of leukemia and mortality from sepsis in patients with severe congenital neutropenia receiving long-term G-CSF therapy. Blood 2006; 107 : 4628–35. 30. Ridanpaa M, Sistonen P, Rockas S, et al. Worldwide mutation spectrum in cartilage-hair hypoplasia : ancient founder origin of the major70A Š G mutation of the untranslated RMRP. Eur J Hum Genet 2002; 10 : 439–47. 31. Gorlin RJ, Gelb B, Diaz GA, et al. WHIM syndrome, an autosomal dominant disorder : clinical, hematological, and molecular studies. Am J Med Genet 2000; 91 : 368–76. 32. Veiga-da-Cunha M, Gerin I, Chen YT, et al. The putative glucose 6-phosphate translocase gene is mutated in essentially all cases of glycogen storage disease type I non-a. Eur J Hum Genet 1999; 7 : 717–23. 33. Barth PG, Wanders RJ, Vreken P, et al. X-linked cardioskeletal myopathy and neutropenia (Barth syndrome) (MIM 302060). J Inh Metabol Dis 1999; 22 : 555–67. 34. Boocock GR, Morrison JA, Popovic M, et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet 2003; 33 : 97–101. 35. Kolehmainen J, Black GC, Saarinen A, et al. Cohen syndrome is caused by mutations in a novel gene, COH1, encoding a transmembrane protein with a presumed role in vesicle-mediated sorting and intracellular protein transport. Am J Hum Genet 2003; 72 : 1359–69. 36. Huizing M, Scher CD, Strovel E, et al. Nonsense mutations in ADTB3A cause complete deficiency of the beta3A subunit of adaptor complex-3 and severe Hermansky-Pudlak syndrome type 2. Pediatr Res 2002; 51 : 150–8. |