| |
| Med Sci (Paris). 2008 April; 24(4): 372–374. Published online 2008 April 15. doi: 10.1051/medsci/2008244372.Contrôle circadian du transcriptome musculaire Sandrine Dulong,1,2 Franck Delaunay,3 and Francis Lévi1,2* 1Inserm, U776, Rythmes biologiques et Cancers, Hôpital Paul Brousse, 14, avenue Paul Vaillant Couturier, 94807 Villejuif, France. 2Université Paris-Sud 11, UMR S0776, 91405, Orsay France 3UMR 6548, Laboratoire de Physiologie cellulaire et moléculaire, Bâtiment Sciences Naturelles, Avenue de Valrose, 06108 Nice Cedex 2, France MeSH keywords: Animaux, Horloges biologiques, Rythme circadien, Analyse de profil d'expression de gènes, Régulation de l'expression des gènes, Humains, Muscles squelettiques |
Les composants du système circadien On sait depuis longtemps que le système circadien rythme sur 24 heures le métabolisme et la prolifération cellulaire de la plupart des êtres vivants et influence ainsi l’activité de nombreux traitements [
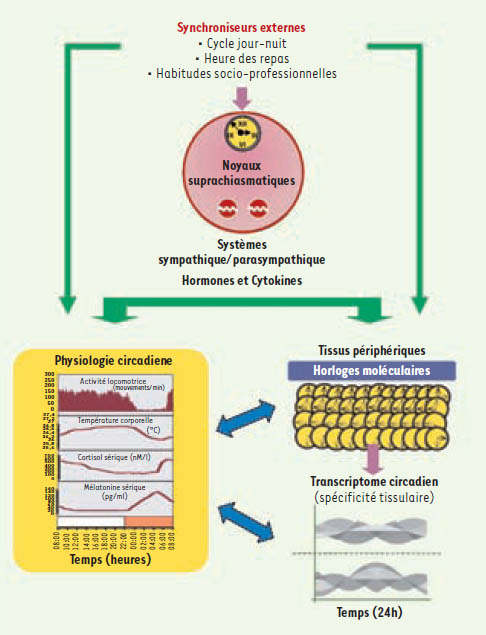
1]. Le système circadien est composé d’horloges moléculaires situées dans chacune des cellules de l’organisme et coordonnées par un pacemaker central, les noyaux suprachiasmatiques de l’hypothalamus (NSC). Les cycles de l’environnement, dont la périodicité est d’environ 24 heures, jouent le rôle de synchroniseur en fournissant des repères temporels externes au système circadien. Celui-ci cale alors les heures des pics et des creux des rythmes biologiques en fonction de l’alternance du jour et de la nuit, des horaires des repas, des habitudes socio-professionnelles, etc. Pour cela, les NSC engendrent ou rythment un grand nombre de fonctions physiologiques. Citons l’activité physique, la température centrale, les sécrétions de mélatonine et de cortisol, etc., qui jouent un rôle de signalisation circadienne auprès des horloges moléculaires et/ou d’autres fonctions cellulaires. Ces trois composantes du système circadien - horloges moléculaires, pacemaker central et physiologie circadienne (Figure 1) permettent l’optimisation temporelle de l’énergie disponible et l’adaptation aux cycles de l’environnement et à leurs modifications.  | Figure 1.
Représentation schématique du système circadien. L’activité locomotrice (mouvement par minute), la température (°C), le cortisol sérique (nM/l) et la mélatonine sérique (pg/ml) concernent des données humaines. |
L’oscillation circadienne est produite par des boucles transcriptionnelles et translationnelles de rétrocontrôle impliquant une douzaine de gènes spécifiques [
2]. Cette horloge moléculaire continue de fonctionner dans des conditions constantes d’environnement, avec une période endogène qui varie de 20 à 28 heures selon l’espèce, le génotype ou les caractéristiques propres du synchroniseur (par exemple, l’intensité lumineuse). Les synchroniseurs externes calibrent à précisément 24 heures la période des horloges internes [
3]. Au niveau moléculaire, les dimères des protéines de l’horloge CLOCK : BMAL1 ou NPAS2 : BMAL1 contrôlent de façon rythmique la transcription de 1 à 10 % du génome. Les gènes dits « contrôlés par l’horloge » concernent tous les domaines des fonctions cellulaires et présentent une spécificité en rapport avec la fonction du tissu considéré [
4]. L’étude du transcriptome circadien permet donc de mieux comprendre l’organisation physiologique temporelle des différents tissus de l’organisme. Une recherche sur PubMed nous apprend que près de 50 publications scientifiques concernent l’expression circadienne du transcriptome dans des organismes aussi divers qu’Arabidopsis thaliana, la drosophile [
5], la souris ou l’homme, depuis la découverte et le clonage du gène Clock en 1997 [
6,
7]. La rythmicité du transcriptome des mammifères a été démontrée dans de nombreux organes (NSC, épiphyse, foie, coeur, poumon, glande surrénale), et même dans des cellules en cultures [
8]. |
Une horloge moléculaire dans le muscle Dans un article récent, l’équipe de K.A. Esser, spécialisée dans le domaine de la physiologie musculaire, et celle de J. Takahashi, découvreur de Clock, identifient le transcriptome circadien du muscle strié chez des souris C57BL/6J mâles sauvages ou mutantes pour le gène horloge Clock [
9]. La masse musculaire représente environ 40 % de la masse corporelle et une perte de masse musculaire est corrélée à une augmentation de la mortalité et une altération de la qualité de vie chez l’homme [
10]. Tout comme dans la plupart des tissus [
11,
12], les gènes de l’horloge s’expriment dans le muscle squelettique. De plus, la rythmicité de l’activité locomotrice est un marqueur du système circadien : ce sont les modifications du phénotype de ce rythme qui ont conduit à l’identification de la plupart des gènes de l’horloge circadienne [1, 4, 6]. Ainsi, les animaux porteurs d’une mutation du gène Clock présentent un retard de phase du rythme de l’activité locomotrice dans un environnement photopériodique où lumière et obscurité alternent chaque 12 heures, et un allongement de la période circadienne puis sa disparition après 4 semaines d’obscurité continue [6]. Pour étudier la rythmicité endogène du transcriptome musculaire, les auteurs synchronisent des souris adultes mâles de la lignée C57BL/6J par 12 heures de lumière et 12 heures d’obscurité durant 14 jours. Ils les placent ensuite en obscurité constante durant 30 heures pour éviter l’effet de masque de la lumière. Les muscles gastrocnémiens sont alors prélevés toutes les 4 heures pendant 48 h et les ARN totaux sont extraits. L’analyse du transcriptome est réalisée par hybridation des ADNc sur des puces Affymetrix de 36 182 gènes. Le programme COSOPT identifie 215 transcrits rythmiques avec une période de 20 à 28 heures et MMC- β ≤ 0,15 (facteur de correction). Dans le muscle squelettique des souris, 9002 gènes sont exprimés. L’expression circadienne des transcrits des gènes de l’horloge a été confirmée par RT-PCR quantitative. Ces études confirment que le muscle possède bien une horloge moléculaire puisque les gènes horloges Bmal1, Per2, Cry2, Rorα, Rev-erbα [
13] ainsi que plusieurs gènes directement contrôlés par l’horloge tels que Dbp, Tef et Hlf présentent une expression circadienne. Il est intéressant de noter que la répartition des pics d’expression des gènes est semblable la nuit (113) et le jour (102), mais que un tiers des gènes est activé à Circadian Time 18 au voisinage du milieu de la phase d’activité nocturne des animaux. Les gènes transcrits rythmiquement au cours des 24 heures interviennent majoritairement dans la transcription (18 %), la signalisation cellulaire (15 %), le métabolisme protéique (12 %) et le métabolisme intermédiaire (9 %) |
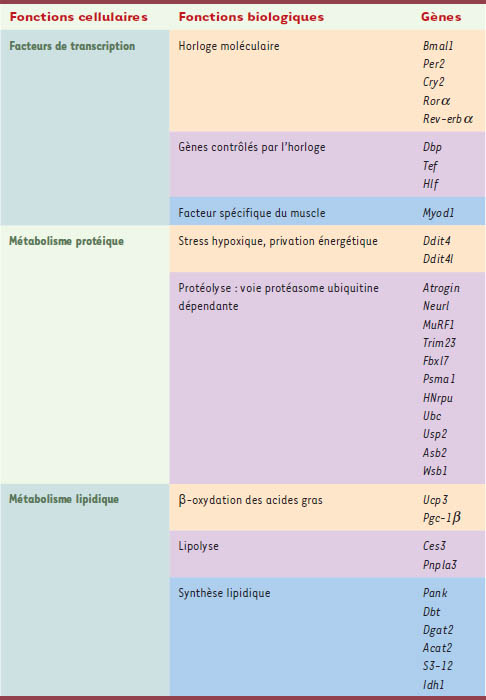
Gènes musculaires soumis au contrôle circadien Un contrôle circadien de l’expression de différents gènes importants pour l’activité musculaire a été mis en évidence. Il concerne (Tableau I) :
-
le facteur de transcription spécifique du muscle (Myod1) qui joue un rôle clef dans la myogenèse et intervient dans le maintien de l’intégrité du tissu ;
-
les gènes Ddit4 et Ddit4l qui codent pour des protéines de réponse à l’hypoxie et à la privation énergétique ; de plus Ddit4l, spécifique du muscle, intervient dans l’équilibre atrophie/hypertrophie musculaire ;
-
plusieurs gènes de la voie faisant intervenir l’ubiquitine qui participent à la protéolyse réalisée par le protéasome (Atrogin, Neurl, MuRF1, Trim23, Fbxl7, Psma1, HNrpu, Ubc, Usp2, Asb2 et Wsb1) ; ces gènes codent pour des protéines qui ont une activité ubiquitine ligase ou qui s’associent aux complexes ubiquitine ligase ; le contrôle circadien des ubiquitines ligases semble spécifique au muscle ;
-
plusieurs gènes du métabolisme lipidique ; les acides gras constituent en effet la source principale d’énergie du tissu musculaire ; deux gènes de l’horloge, Rorα et Rev-erbα/β, participent directement au métabolisme lipidique ; Ucp3, régulé par Myod1, et PGC-1β interviennent dans la régulation de la β-oxydation des acides gras et ainsi dans la production d’énergie. Ces deux protéines jouent un rôle important dans le métabolisme cellulaire et leur dérégulation peut être associée au diabète et à l’obésité [
14,
15].
 | Tableau I.
Liste des gènes exprimés de façon circadienne classés par fonction biologique (d’aprés [8]). |
Chez les mutants Clock, les expressions de Per2, Dbp et Myod1 perdent leur rythmicité circadienne. Ces résultats suggèrent que la transcription de ces trois gènes est directement sous le contrôle du gène Clock. Chez ces animaux mutants, où Myod1 n’est plus rythmé, Ucp3 présente toujours une expression circadienne, mais avec un maximum décalé dans le temps. D’autres études avaient précédemment montré que l’interruption de l’horloge moléculaire du foie, provoquée par la mutation du gène de l’horloge Per2 ou le décalage horaire chronique, pouvait déréprimer le rythme circadien des ARNm de c-Myc [
16,
17]. Enfin un certain nombre de gènes codent pour des enzymes intervenant dans l’hydrolyse (Ces3 et Pnpla3) ou dans la synthèse (Pank, Dbt, Dgat2, Acat2, S3-12 et Idh1) des acides gras. En dernier lieu, l’équipe de K.A. Esser [9] montre que la mutation Clock modifie aussi le niveau d’expression de 35 % des gènes dont la transcription n’est pas circadienne : 79 % de ces gènes sont réprimés et 21 % surexprimés. Ces résultats montrent que chez les animaux mutants pour Clock et qui présentent un déficit structurel et fonctionnel sévère du muscle squelettique, le métabolisme protéique et lipidique est très affecté mais aussi les processus de contraction musculaire, en particulier par une désorganisation des fibres musculaire en raison de la baisse d’expression des protéines de structure (dystrophine, titine, myosine et actine). |
Dans son ensemble, cette étude met en évidence le rôle central de l’horloge circadienne dans la régulation de homéostasie du muscle squelettique et son adaptation aux cycles de l’environnement. Plusieurs études indiquent que la survenue d’une fonte musculaire et d’une asthénie est souvent associée à un dérèglement de l’horloge circadienne en cas de cancer évolutif [10,
18]. L’étude présentée montre l’intérêt d’approfondir les connaissances sur les interactions entre horloge circadienne et activités musculaires en cas de pathologie et suggère l’utilité de traitements chronopharmacologiques ciblés sur le contrôle circadien du muscle squelettique pour améliorer la qualité de vie de ces patients. |
1. Levi F, Schibler U. Circadian rhythms: mechanisms and therapeutic implications. Annu Rev. Pharmacol Toxicol 2007; 47 : 593–628. 2. Dardente H, Cermakian N. Les noyaux suprachiasmatiques : une horloge circadienne composée. Med Sci (Paris) 2005; 21 : 66–72. 3. Hastings MH, Reddy AB, Maywood ES. Nat Rev Neurosci 2003; 4 : 649–61. 4. Nonaka S, Shiratori H, Saijoh Y, Hamada H. Determination of left-right patterning of the mouse embryo by artificial nodal flow. Nature 2002; 418 : 96–9. 5. Rouyer F. Des horloges du matin et du soir dans le cerveau de la drosophile. Med Sci (Paris) 2005; 21 : 808–10. 6. Antoch MP, Song EJ, Chang AM, et al. Functional identification of the mouse circadian Clock gene by transgenic BAC rescue. Cell 1997; 89 : 655–67. 7. King DP, Zhao Y, Sangoram AM, et al. Positional cloning of the mouse circadian clock gene. Cell 1997; 89 : 641–53. 8. Delaunay F, Laudet V. Circadian clock and microarrays : mammalian genome gets rhythm. Trends Genet 2002; 18 : 595–7. 9. McCarthy JJ, Andrews JJ, McDearmon EL, et al. Identification of the circadian transcriptome in adult mouse skeletal muscle. Physiol Genomics 2007; 31 : 86–95. 10. Fouladium M, Kömer U, Gunnebo L, et al. Daily physical-rest activities in relation to nutritional state, metabolism, and quality of life in cancer patients with progressive cachexia. Clin Cancer Res 2007; 13 : 6379–85. 11. Brown SA, Schibler U. La variance de la période circadienne chez l’homme, dans sa peau. Med Sci (Paris) 2006; 22 : 474–5. 12. Teboul M, Rayet B, Delaunay F. Du rythme dans le foie en régénération. Med Sci (Paris) 2004; 20 : 146–7. 13. Teboul M, Delaunay F. Le récepteur nucléaire orphelin Rev-erbalpha oscille entre répression et activation. Med Sci (Paris) 2003; 19 : 411–3. 14. Schrauwen P, Hesselink M. UCP2 and UCP3 in muscle controlling body metabolism. J Exp Biol 2002; 205 : 2275–85. 15. Mortensen OH, Plomgaard P, Fischer CP, et al. PGC- 1beta is downregulated by training in human skeletal muscle: no effect of training twice every second day vs. once daily on expression of the PGC-1 family. J Appl Physiol 2007; 103 : 1536–42. 16. Fu L, Pelicano H, Liu J, et al. The circadian gene Period2 plays an important role in tumor suppression and DNA damage response in vivo. Cell 2002; 111 : 41–50. 17. Filipski E, Innominato PF, Wu M, et al. Effects of light and food schedules on liver and tumor molecular clocks in mice. J Natl Cancer Inst 2005; 97 : 507–17. 18. Levi F, Filipski E, Iurisci I, et al.
Cross-talks between circadian timing system an cell division cycle determine cancer biology and therapeutics. Cold Spring Harbor Symposia on Quantitative biology Vol LXXII 2007 Cold Spring Harbor Laboratory Press 978-087969823–2. |