| |
| Med Sci (Paris). 2008 May; 24(5): 449–451. Published online 2008 May 15. doi: 10.1051/medsci/2008245449.La « synergie phages-antibiotiques » Un enjeu pour la phagothérapie André M. Comeau,1 Françoise Tétart,1 Sabrina N. Trojet,1 Marie-Françoise Prère,1,2 and Henry M. Krisch1* 1Laboratoire de Microbiologie et Génétique Moléculaires, UMR 5100, Centre National de la Recherche Scientifique, Université Paul Sabatier III, 31062 Toulouse Cedex 9, France 2Laboratoire de Bactériologie, Institut Fédératif de Biologie, Centre Hospitalier Universitaire de Toulouse, Toulouse, France MeSH keywords: Antibactériens, Antiviraux, Bactériophages, Escherichia coli, Infections à Escherichia coli, Humains |
L’activité antibactérienne des phages : un regain d’intérêt Nous avons tous nos prédateurs… L’être humain, après avoir surmonté les dangers des gros prédateurs (tigres aux dents de sabre par exemple), est maintenant menacé par de minuscules prédateurs comme les bactéries pathogènes. Heureusement, les bactéries sont aussi victimes de prédateurs naturels puisque, comme tous les autres organismes vivants, elles peuvent être infectées par des virus. Ces virus de bactéries, les bactériophages ou phages, sont très spécifiques ; ils infectent en général une seule espèce de bactérie et même souvent seulement certaines souches de l’espèce [
1,
2]. Presque toutes les espèces bactériennes peuvent être infectées par de nombreux phages différents. Au total, plus de 5 500 phages distincts ont été identifiés par microscopie électronique dans les laboratoires du monde entier [
3]. Cependant, cet échantillon de phages ne représente qu’une infime fraction de leur vraie diversité. Ces types de virus sont ubiquitaires et sont les « entités biologiques » les plus abondantes de la biosphère ; leur nombre dépasse de 10 à 15 fois celui de leurs bactéries hôtes [
4,
5]. Les phages ont été découverts au début du XXe siècle par Félix d’Hérelle [
6], un microbiologiste franco-canadien ayant travaillé un certain temps à l’Institut Pasteur de Paris. Dès leur découverte, ils ont été utilisés pour combattre certaines infections bactériennes. La vague de « phagothérapie » s’est alors propagée dans la communauté médicale jusqu’à ce qu’elle soit rapidement supplantée par la découverte et l’utilisation des antibiotiques. La phagothérapie a cependant continué d’exister jusqu’à ce jour en ex-Union soviétique, en particulier en République de Géorgie, grâce à l’Institut George Eliava cofondé par d’Hérelle et Eliava dans les années 1920 [
7]. Depuis l’émergence de bactéries pathogènes résistantes aux antibiotiques, les travaux soviétiques suscitent un vif intérêt dans le monde médical et scientifique ; des sociétés biotechnologiques, pharmaceutiques et agroalimentaires tentent d’exploiter commercialement l’activité antibactérienne des phages. Ce regain d’intérêt touche aussi bien la recherche fondamentale que les enjeux cliniques et se traduit par un nombre croissant de publications scientifiques et de colloques internationaux, tel celui de l’Institut Pasteur de Paris en novembre 2007 [
8]. |
Synergie entre antibiothérapie et production de phages La multiplication des phages est critique pour la thérapie phagique ; elle a aussi un énorme impact sur l’écologie microbienne de la planète. Néanmoins, les effets des facteurs environnementaux sur la propagation des phages restent quasiment inexplorés. Dans ce domaine, nous avons fait une découverte potentiellement très importante ; elle a été publiée récemment dans la revue PLoS ONE [
9]. L’addition à des cultures bactériennes de faibles doses d’antibiotiques qui bloquent la division cellulaire et induisent la formation de filaments, comme le font les céphalosporines, augmente de façon significative la production de phages. Nous avons observé ce phénomène chez plusieurs types des phages virulents. Par exemple l’addition de céfotaxime, une céphalosporine de troisième génération, à une culture d’Escherichia coli uropathogène, à dose non létale pour les bactéries, a augmenté de plus de 7 fois la production du phage fMFP. Ces antibiotiques augmentent le volume bactérien par leur blocage de la division cellulaire, permettant ainsi une surproduction de phages, et accélèrent la lyse de la bactérie par les phages. Ces deux facteurs provoquent une propagation plus rapide de l’infection phagique. Nous avons appelé ce phénomène la « synergie phages-antibiotiques » (PAS en anglais) (Figure 1). Nous avons mis en évidence le phénomène PAS avec des antibiotiques de la famille des β-lactames et des quinolones dans divers systèmes bactéries-phages. Le fait que plusieurs phages non apparentés réagissent de manière similaire suggère que ce phénomène leur confère un commun avantage important.
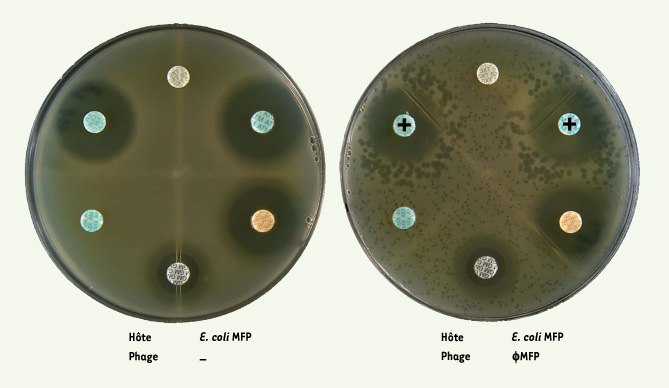
 | Figure 1.
Le phénomène de « Synergie Phages-Antibiotiques » (PAS) avec le phage φMFP sur Escherichia coli MFP. À gauche, un antibiogramme montrant la sensibilité de la souche uropathogène E. coli MFP à différents antibiotiques. Notez que cette souche est résistante à l’amoxicilline et la triméthoprime/sulfaméthoxazole (absence de halo d’inhibition autour des deux pastilles). À droite, le même antibiogramme avec l’addition de plusieurs centaines de phages virulents φMFP dans le tapis bactérien. Les plages de lyse sont beaucoup plus grandes à proximité des antibiotiques b-lactames aztreonam et cefixime (indiqués avec les « + »). L’augmentation de la taille des plages, phénomène PAS, est causée par une surproduction de phages et une lyse plus rapide des bactéries par les phages. La gentamicine et la tétracycline n’ont pas donné de réponse PAS (taille de plages de lyse normale autour des halos). |
|
Intérêt de l’interaction phages-antibiotiques pour l’équilibre des populations microbiennes Cette « synergie phages-antibiotiques » pourrait être utilisée à des fins médicales thérapeutiques et prophylactiques. De plus, ces traitements mixtes devraient recevoir une meilleure approbation que la phagothérapie seule. Le phénomène PAS est-il simplement une curiosité biologique utile pour la phagothérapie, ou correspond-t-il à une particularité jusque-là inconnue des cycles de vie des phages - la capacité de s’adapter avec succès à un environnement moins favorable pour la croissance bactérienne ? La présence naturelle dans l’environnement de faibles quantités d’antibiotiques sécrétées par des champignons et certaines bactéries (par exemple les actinomycètes) constitue une forte pression sélective pour l’émergence de stratégies de résistance. La filamentation chez les bactéries en présence de certains antibiotiques en est une [
10] et cette stratégie s’avère avantageuse pour l’évolution. Les phages, quant à eux, profitent de la physiologie altérée de ces bactéries « stressées » pour amplifier le nombre de phages produits par cycle d’infection par rapport aux situations plus saines. Cette stratégie serait logique car, sous l’effet des antibiotiques, les bactéries hôtes de ces phages sont vouées à disparaître. La production de phages supplémentaires permet aux phages de perdurer jusqu’à la rencontre de nouveaux hôtes dans des environnements plus sains. D’un point de vue écologique, une sorte de mutualisme existerait entre les organismes producteurs d’antibiotiques (champignons et bactéries) et les phages capables de PAS pour concurrencer plus efficacement les bactéries sensibles. Cette synergie entre producteurs d’antibiotiques et phages pourrait jouer un rôle dans l’équilibre des populations microbiennes dans les sols, les eaux ou à l’intérieur de l’être humain (Figure 2).
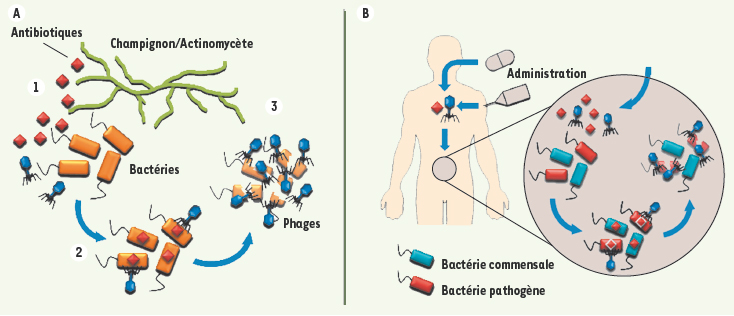
 | Figure 2.
Le phénomène de « synergie phages-antibiotiques » (PAS) dans l’environnement (A) et en phagothérapie (B). Certains champignons et bactéries (exemple : actinomycètes) produisent des antibiotiques contre d’autres bactéries en compétition pour les mêmes ressources (1). Les phages utilisent les bactéries « stressées » par ces antibiotiques pour infecter plus efficacement (2) et se propager plus rapidement. Ce scénario représente une sorte de mutualisme entre les phages et les producteurs d’antibiotiques pour éliminer leurs compétiteurs bactériens (3). Dans le cadre de la phagothérapie, des traitements mixtes d’antibiotiques et de phages devront permettre une élimination plus efficace des bactéries pathogènes en limitant l’agression de la flore commensale grâce aux grandes spécificités des phages. |
Des études supplémentaires seraient nécessaires pour préciser l’impact du phénomène PAS sur les écosystèmes microbiens. Pour l’instant nous tentons de mieux comprendre le(s) mécanisme(s) moléculaire(s) impliqués [9]. Quant à l’enjeu thérapeutique du phénomène PAS, la nature nous a fourni la bonne recette - si vous voulez détruire des bactéries pathogènes, leur administrer simultanément une pincée d’antibiotique et une cuillère de phages serait probablement plus efficace que chacun des traitements individuellement. |
Les auteurs tiennent à remercier Christine Arbiol, Nacer Benmeradi, Germaine Burgener-Krisch, Claire Bertrand, Jean-Yves Bouet, Kaymeuang Cam, François Cornet, Yvette de Preval, Olivier Fayet, David Lane et Jérôme Rech pour leurs diverses contributions à ce travail. AMC est soutenu par le prix scientifique de la Fondation des Treilles. Le laboratoire de HMK est soutenu par le CNRS.
|
1. Holmfeldt K, Middelboe M, Nybroe O, Riemann L. Large variabilities in host strain susceptibility and phage host range govern interactions between lytic marine phages and their Flavobacterium hosts. Appl Environ Microbiol 2007; 73 : 6730–9. 2. Comeau AM, Chan AM, Suttle CA. Genetic richness of vibriophages isolated in a coastal environment. Environ Microbiol 2006; 8 : 1164–76. 3. Ackermann HW. 5500 phages examined in the electron microscope. Arch Virol 2007; 152 : 227–43. 4. Suttle CA. Marine viruses: major players in the global ecosystem. Nat Rev Microbiol 2007; 5 : 801–12. 5. Filée J, Comeau AM, Suttle CA, Krisch HM. Les bactériophages de type T4 : des composants prépondérants de la « matière noire » de la biosphère. Med Sci (Paris) 2006; 22 : 111–2. 6. Summers WC. Bacteriophage therapy. Annu Rev Microbiol 2001; 55 : 437–51. 7. Bradbury J. My enemy’s enemy is my friend. Using phages to fight bacteria. Lancet 2004; 363 : 624–5. 8. Biet E. La seconde naissance de la phagothérapie : une méthode pastorienne centenaire délaissée. Le Quotidien du Médecin 2007; n° 8265. 9. Comeau AM, Tétart F, Trojet SN, et al. Phage-antibiotic synergy (PAS): β-lactam and quinolone antibiotics stimulate virulent phage growth. PLoS One 2007; 2 : e799. 10. Miller C, Thomsen LE, Gaggero C, et al. SOS response induction by β-lactams and bacterial defense against antibiotic lethality. Science 2004; 305 : 1629–31. |