| |
| Med Sci (Paris). 2008 May; 24(5): 454–456. Published online 2008 May 15. doi: 10.1051/medsci/2008245454.Les papillomavirus humains cutanés oncogènes sont-ils des commensaux défectifs ? Maciej Lazarczyk1,2 and Michel Favre1* 1Unité de Génétique, Papillomavirus et Cancer Humain, Institut Pasteur, 75015 Paris, France 2Inserm U563, CPTP et Université Paul Sabatier, 31300 Toulouse, France MeSH keywords: Alphapapillomavirus, Virus défectifs, Humains, Tumeurs, Infections à papillomavirus, Transcription génétique, Réplication virale, Verrues |
Les papillomavirus humains (PVH) sont les agents de lésions cutanées (divers types cliniques de verrues) ou muqueuses (condylomes acuminés, néoplasies intraépithéliales cervicales) qui guérissent, généralement, spontanément ou après traitement. Cependant, certaines lésions génitales persistantes, notamment du col utérin, induites par des PVH potentiellement oncogènes (essentiellement les PVH16 et 18) peuvent se transformer en cancers invasifs chez un petit nombre de patientes [
1]. Il en est de même pour les carcinomes de la peau associés au PVH5 chez des patients atteints d’épidermodysplasie verruciforme (EV) [
2]. Des études épidémiologiques sont en faveur de l’implication de facteurs génétiques de l’hôte dans l’issue des lésions génitales, tels que certains allèles de gènes de classe II du complexe majeur d’histocompatibilité ou le gène TSCOT (thymic stromal co-transporter). Cependant, la prédisposition génétique aux maladies induites par les PVH, en particulier les PVH oncogènes, est loin d’être comprise et reste un domaine encore peu exploré. |
L’épidermodysplasie verruciforme : un modèle de prédisposition aux papillomavirus humains L’épidermodysplasie verruciforme (EV) constitue une maladie modèle pour identifier des gènes de prédisposition aux infections par les PVH et pour comprendre les mécanismes viraux et cellulaires mis en jeu dans la pathogénie par des virus oncogènes. En effet, cette génodermatose rare, liée en général à un gène de transmission autosomique récessive, est caractérisée par des lésions ressemblant à des verrues planes ou à des macules, apparaissant dès l’enfance et durant toute la vie [2]. L’EV correspond à une sensibilité anormale à l’infection par un groupe de PVH apparentés appartenant au genre bêta (PVH bêta) dont le PVH5 oncogène. Des troubles de l’immunité à médiation cellulaire interviennent également dans la pathogénie de la maladie. De plus, la présence de carcinomes cutanés induits par le PVH5 chez plus de 80 % des patients dans des régions exposées au soleil indique que des facteurs de l’environnement jouent un rôle important dans cette maladie multifactorielle. De façon surprenante, les PVH β sont très répandus mais apparemment inoffensifs pour la population générale [
3]. Cependant, la détection avec une fréquence élevée, par des méthodes de PCR nichée, de quelques copies du génome des PVH β dans des carcinomes de la peau de sujets immunocompétents ou immunodéprimés pourrait indiquer un rôle de ces virus dans la carcinogenèse cutanée [3]. Il y a maintenant quelques années, nous avons identifié deux gènes (EVER1 et EVER2) dont des mutations homozygotes confèrent la sensibilité à l’infection virale des patients atteints d’EV [
4]. Ces deux gènes, encore appelés respectivement TMC6 et TMC8, appartiennent à la famille des protéines TMC (transmembrane channel-like proteins). Les protéines EVER1 et EVER2 comportent respectivement 10 et 8 domaines transmembraires putatifs et sont localisées au niveau du réticulum endoplasmique (Figure 1). Leur fonction est inconnue, mais comme pour la protéine TMC1, on peut émettre l’hypothèse que les protéines EVER jouent un rôle dans le transport d’oligoéléments (potassium, calcium, zinc…) ou dans la transmission de signaux cellulaires.
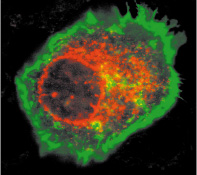
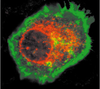 | Figure 1.
La protéine EVER2 (en rouge) est localisée dans la membrane nucléaire et dans le cytoplasme des kératinocytes. La membrane plasmique est colorée en vert. |
|
Protéines EVER et homéostasie du zinc Pour tenter d’élucider la fonction des protéines EVER1 et EVER2, nous avons entrepris d’identifier leurs protéines cellulaires partenaires par une méthode de double hybride chez la levure [
5]. Nous avons montré que les protéines EVER forment un complexe avec ZnT-1, une protéine transporteuse de zinc. Le zinc est un oligoélément extrêmement toxique sous forme libre dans la cellule. Aussi, certaines protéines cellulaires comme les métallothionéines 1 et 2 sont capables de fixer le zinc libre alors que d’autres, appartenant à la famille ZIP ou ZnT, interviennent dans l’import ou l’export cellulaire du zinc ou dans son transport intracellulaire [
6]. Il a également été montré que le zinc était capable d’induire la synthèse des métallothionéines et de ZnT-1, permettant ainsi de réduire la quantité de zinc libre. Dans les kératinocytes, la cellule hôte des PVH, le complexe EVER/ZnT1 n’est pas mis en jeu dans l’efflux du zinc. En revanche, nous avons montré que la protéine EVER2 régule la distribution du zinc libre et inhibe son transport dans le noyau vers le nucléole qui est le siège d’une transcription active des ARN ribosomaux [5]. De fait, les kératinocytes possédant un gène EVER2 muté ont une croissance plus rapide que les cellules normales. Nous avons également montré que le complexe EVER/ZnT1 réprime l’activité du facteur de transcription MTF-1 (metal-responsive transcription factor-1), dont la synthèse dépend du zinc et qui active la transcription des métallothionéines. De même, les protéines EVER et ZnT-1 inhibent les voies de signalisation des MAP kinases (mitogen-activated protein kinases) qui conduisent à la synthèse de facteurs de transcription comme c-Jun et c-Fos de la famille AP-1. Ces facteurs jouent un rôle très important dans la synthèse de cytokines et chimiokines et dans la transcription des génomes de PVH. Aussi, au cours de l’infection virale, la levée de cette inhibition exercée par le complexe EVER/ZnT-1 pourrait jouer un rôle important dans la réponse immune des kératinocytes contre les infections par des PVH β, ou dans le contrôle intracellulaire de l’expression du génome viral ou de l’activité des protéines virales précoces comme les protéines E6 et E7. Protéines EVER et contrôle de l’infection virale Nous étudions actuellement l’impact de mutations dans les protéines EVER1 ou EVER2 dans le profil d’expression de cytokines et de chimiokines de lignées lymphoblastoïdes et de kératinocytes isolés de patients et de sujets sains de familles atteintes d’EV. Dans le but de démontrer un contrôle intracellulaire de l’expression ou de l’activité des protéines virales précoces, nous avons tenté de mettre en évidence une interaction entre les protéines EVER ou ZnT-1 avec des protéines virales précoces des PVH cutanés et génitaux. Cette étude était d’autant plus justifiée qu’une publication récente avait montré qu’une protéine précoce du PVH16, la protéine E5 (16 E5), était capable d’interagir avec ZnT-1 [
7]. Aucune interaction n’a été observée avec les protéines E6 et E7 de PVH oncogènes cutanés ou génitaux. En revanche, nous avons montré que la protéine 16 E5 était capable d’interagir avec les protéines EVER1 et EVER2 et de lever l’inhibition exercée par le complexe EVER/ZnT-1 sur la synthèse de facteurs de transcription MTF-1 ou de la famille AP-1 [5]. 16 E5 est une protéine membranaire de 83 acides aminés fortement hydrophobe. Elle est principalement localisée dans le réticulum endoplasmique mais également dans l’appareil de Golgi et la membrane nucléaire [
8]. Parmi ses fonctions, on notera que 16 E5 active le récepteur du facteur de croissance de l’épiderme (EGFR) grâce à une interaction avec la sous-unité 16 kDa de l’ATPase-H+ vacuolaire, conduisant à une durée de vie accrue du récepteur. Cette activation est responsable d’une cascade d’événements favorisant la synthèse de proto-oncogènes et de facteurs de transcription mis en jeu dans la prolifération cellulaire. Les PVH ont la particularité de se répliquer dans les kératinocytes en voie de différenciation terminale. Dans les lésions associées au PVH16, 16 E5 est essentiellement décelée dans les couches basales et parabasales de l’épiderme. Cela suggère que cette protéine joue un rôle prépondérant, en conjonction avec les protéines E6 et E7, dans la prolifération des cellules basales et dans la réinitiation, au cours de l’étape de différenciation, de la phase S du cycle cellulaire pendant laquelle sont synthétisées les ARN et ADN polymérases nécessaires à la réplication virale. Il a également été rapporté que 16 E5 est capable, par la voie PKC et les voies de signalisation dépendantes de ras, de stimuler la synthèse de facteurs de transcription c-Jun, Jun B et c-fos [8]. Étant donné que plusieurs sites de fixation de ces facteurs sont localisés dans la longue région de régulation des PVH, on peut penser que 16 E5 joue un rôle essentiel dans l’activation de la transcription des gènes viraux, en particulier les gènes de transformation E6 et E7 et les gènes de réplication E1 et E2. |
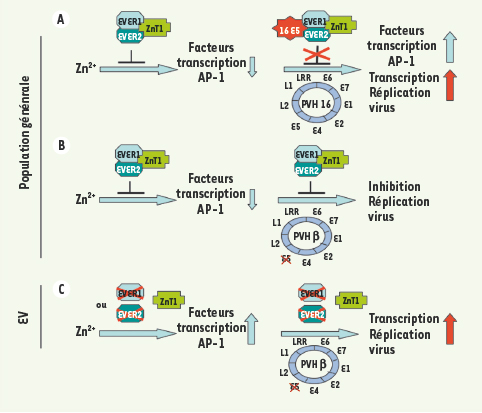
Les PVH β, des commensaux défectifs Il avait été préalablement montré que la protéine E8 du papillomavirus du lapin cottontail, une protéine possédant une structure et des propriétés analogues à celles de la protéine E5, était également capable d’interagir avec ZnT-1 et, de ce fait, jouer un rôle important dans l’homéostasie du zinc et dans le cycle de réplication du virus [7]. Ainsi, selon le type de papillomavirus, deux protéines virales (E5 et E8) pourraient interférer avec la régulation du zinc et favoriser l’activation de voies de signalisation impliquées dans la synthèse de facteurs de transcription essentiels pour l’expression et la réplication du génome viral (Figure 2). Parmi les PVH cutanés ou muqueux, les PVH du genre β se distinguent par l’absence des gènes E5 et E8 [
9]. Ainsi, nos résultats viennent corroborer l’hypothèse récemment formulée [2] selon laquelle les PVH β, en particulier le PVH5 oncogène, sont des commensaux défectifs très répandus et asymptomatiques dans la population générale. Seules une mutation dans les gènes EVER1 ou EVER2 ou des conditions physiologiques particulières, comme la régénération de l’épiderme [
10], sont capables de permettre leur réplication et de lever la restriction d’hôte observée dans la population générale. Ainsi, que ce soit par une protéine virale ou par une mutation dans une protéine cellulaire, l’homéostasie du zinc semble jouer un rôle primordial dans l’infection par les papillomavirus. Il convient donc maintenant de déterminer la place à accorder aux propriétés antivirales des protéines EVER dans le traitement des lésions associées aux PVH, en particulier les PVH oncogènes. 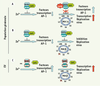 | Figure 2.
Modèle proposé pour la restriction de l’expression des PVH β dans les kératinocytes de sujets normaux ou atteints d’épidermodysplasie verruciforme. A. Dans un kératinocyte normal, l’activation par le zinc de la synthèse de facteurs de transcription de la famille AP-1 est contrecarrée par le complexe EVER1/EVER2/ZnT-1. L’infection de la cellule par le PVH16 permet la synthèse de la protéine 16 E5 qui vient lever l’inhibition du complexe EVER/ZnT-1 et favoriser l’expression des facteurs de transcription nécessaires à la transcription et la réplication du génome viral. B. L’absence d’un gène E5 dans le génome des PVH β ne permet pas de lever cette inhibition, ce qui pourrait expliquer l’absence de réplication végétative de ces virus et de lésions dans la population générale. C. En revanche, dans l’épidermodysplasie verruciforme, une mutation dans le gène EVER1 ou dans le gène EVER2 bloquerait la formation du complexe EVER/ZnT-1 et permettrait l’expression des facteurs de transcription de la famille AP-1 et la réplication virale. |
|
Contrats de la Ligue Nationale contre le Cancer (n°R05/75-129 et n° RS07/75-75) et de l’Association de la Recherche contre le Cancer (n°3731XA0531F et n°4867). M.L. est financé par une bourse de l’ARC et par la Foundation for Polish Science
|
1. Schiffman M, Castle PE, Jeronimo J, et al. Human papillomavirus and cervical cancer. Lancet 2007; 370 : 890–907. 2. Orth G. Genetics of epidermodysplasia verruciformis : insights into host defense against papillomaviruses. Semin Immunol 2006; 18 : 362–74. 3. Forslund O, Iftner T, Andersson K, et al. Viraskin study group. Cutaneous human papillomaviruses found in sun-exposed skin : beta-papillomavirus species 2 predominates in squamous cell carcinoma. J Infect Dis 2007; 196 : 876–83. 4. Ramoz N, Rueda LA, Bouadjar B, et al. Mutations in two adjacent novel genes are associated with epidermodysplasia verruciformis. Nat Genet 2002; 32 : 579–81. 5. Lazarczyk M, Pons C, Mendoza JA, et al. Regulation of cellular zinc balance as a potential mechanism of EVER-mediated protection against pathogenesis by cutaneous oncogenic papillomaviruses. J Exp Med 2008; 205 : 35–42. 6. Palmiter RD. Protection against zinc toxicity by metallothionein and zinc transporter 1. Proc Natl Acad Sci USA 2004; 101 : 4918–23. 7. Nonnenmacher M, Salmon J, Jacob Y, et al. Cottontail rabbit papillomavirus E8 protein is essential for wart formation and provides new insights into viral pathogenesis. J Virol 2006; 80 : 4890–900. 8. Tsai TC, Chen SL. The biochemical and biological functions of human papillomavirus type 16 E5 protein. Arch Virol 2003; 148 : 1445–53. 9. Bravo IG, Alonso A. Mucosal human papillomaviruses encode four different E5 proteins whose chemistry and phylogeny correlate with malignant or benign growth. J Virol 2004; 78 : 13613–26. 10. Favre M, Majewski S, Noszczyk B, et al. Antibodies to human papillomavirus type 5 are generated in epidermal repair process. J Invest Dermatol 2000; 114 : 403–7. |