| |
| Med Sci (Paris). 2008 June; 24(6-7): 665–666. Published online 2008 June 15. doi: 10.1051/medsci/20082467665.Diabète de type 2 cétonurique et virus de l’herpès humain de type 8 Jean-François Gautier* Hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010 Paris, France Inserm UMR-S 872, Équipe 8, Centre de Recherches des Cordeliers, Paris, France MeSH keywords: Afrique subsaharienne, Diabète de type 1, Diabète de type 2, Prédisposition génétique à une maladie, Infections à Herpesviridae, Cercopithecine herpesvirus 1, Humains |
Le diabète de type 2 cétonurique Il a été décrit il y a une vingtaine d’années, une forme atypique de diabète chez des individus originaires d’Afrique sub-saharienne. Cette forme est caractérisée par un début bruyant associant hyperglycémie sévère et cétose (production de corps cétoniques par le foie), voire acidocétose, nécessitant une insulinothérapie [
1–
4]. L’insulinothérapie peut ensuite être arrêtée car il existe une rémission qui peut durer plusieurs années (jusqu’à 12 ans) au cours de laquelle le patient reste très bien contrôlé sous régime seul ou avec des hypoglycémiants oraux. L’évolution est marquée par des rechutes cétosiques qui nécessitent de nouveau une insulinothérapie transitoire. Compte tenu de son début aigu, qui ressemble à celui d’un diabète de type 1 mais qui n’est pas associé aux marqueurs d’auto-immunité habituels, cette forme atypique de dia des patients prédisposés au diabète de type 2. Les facteurs classiques qui précipitent ou aggravent une hyperglycémie tels qu’une infection bactérienne, un traitement par les glucocorticoïdes, la consommation massive d’alcool, ont été exclus dans la majorité des cohortes décrivant cette forme atypique de diabète. Compte tenu de la situation géographique de l’hôpital Saint-Louis, nous sommes amenés à prendre en charge des patients diabétiques originaire d’Afrique sub-saharienne et nous étudions la physiopathologie de ce type de diabète. |
L’herpès virus humain de type 8 (HHV-8) HHV-8 est présent à l’état endémique en Afrique Sub-Saharienne où 30 % à 60 % des adultes ont des marqueurs de l’infection HHV-8 sans avoir eu de manifestations cliniques dans fection par le virus HHV-8 pourrait être un facteur participant au déficit transitoire de l’insulinosécrétion. Le VIH n’a pas été considéré car les premiers cas de diabète de type 2 cétonurique décrits en Afrique ont été rapportés à partir des années 1960, bien avant la survenue de l’infection par le VIH. Le virus de l’hépatite C qui a parfois été associé au diabète de type 2 n’a également pas été considéré car il est associé à une insulinorésistance et non pas à un déficit de l’insulinosécrétion [
10,
11]. |
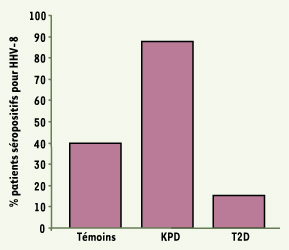
Les marqueurs d’infection par le HHV-8 dans le diabète de type 2 cétonurique Afin de tester notre hypothèse, nous avons recherché d’une part la présence d’anticorps anti-HHV-8 chez des patients diabétiques ayant migré en France à l’âge adulte et d’autre part l’existence d’ADN viral dans le sang total chez des patients hospitalisés pour décompensation hyperglycémique, inaugurale ou non, du diabète. Nous avons recherché la présence d’anticorps anti-HHV-8 chez des patients diabétiques d’origine d’Afrique subsaharienne hospitalisés pour ajustement thérapeutique, bilan du diabète ou éducation ; 187 patients consécutifs ont été vus pendant cette période (81 patients diabétiques de type 2 cétonurique et 106 patients ayant un diabète de type 2 classique). Ces patients ont été comparés à 90 africains normoglycémiques témoins, d’âge et de sexe comparables. Les anticorps anti-HHV-8 ont été retrouvés chez 87,7 % des patients diabétiques de type 2 cétonurique mais seulement 15 % des patients diabétiques de type 2 non cétonurique et 40 % des sujets témoins (Figure 1).
 | Figure 1.
Prévalence des anticorps anti-HHV-8 chez les patients diabétiques de type 2 cétonuriques (KPD), les patients diabétiques de type 2 (T2D) et les sujets témoins
|
Nous avons pu mettre en évidence de l’ADN viral (signant un état actif d’infection) dans le sang total de patients hospitalisés pour épisode cétosique chez 6/13 diabétiques de type 2 cétonurique testés. En revanche, de l’ADN viral n’a été retrouvé chez aucun des 9 patients diabétiques de type 2 non cétonurique hospitalisés pour hyperglycémie. |
HHV-8 peut infecter des cellules humaines β cultivées in vitro
Dans le cadre du programme de greffe d’îlots de l’Hôpital St-Louis, nous avons pu obtenir des îlots de Langerhans isolés à partir d’un donneur en état de mort cérébrale. Après 4 jours de culture en présence d’un surnageant contenant du HHV-8, nous avons observé au microscope confocal après immunomarquage, des cellules marquées pour l’insuline et marquées pour une protéine virale HHV-8. L’existence de ces cellules « doublement marquées » signe la capacité du virus à pénétrer les cellules β sécrétrices d’insuline. |
Conclusion et perspectives Cette étude [11] suggère donc que le phénotype diabète de type 2 cétonurique est associé à l’infection par le HHV- 8 sur 3 arguments :
-
Près de 90 % des patients présentant le phénotype sont séropositifs.
-
La moitié des individus qui ont été testés au moment d’une décompensation cétosique ont de l’ADN viral dans le sang.
-
Le virus est capable d’infecter les cellules β pancréatiques in vitro.
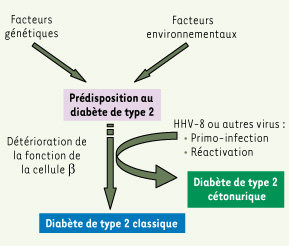
La plus faible prévalence de la séropositivité chez les patients diabétiques de type 2 comparativement au diabète de type 2 cétonurique mais également par rapport aux sujets contrôles suggère que HHV-8 est le facteur qui ferait basculer le phénotype classique de diabète de type 2 vers le phénotype cétonurique (Figure 2). Autrement dit, des individus prédisposés au diabète de type 2 qui sont exposés au HHV-8 débuteraient la maladie sur un mode cétosique. Parmi les mécanismes invoqués, il est logique de s’orienter vers une atteinte de la cellule β par l’infection directe de la cellule par le virus. Cela reste à démontrer de même que les mécanismes de toxicité cellulaire utilisés par le virus.
 | Figure 2.
Hypothèse étiopathogénique du diabète de type 2 cétonurique
|
|
1. Mauvais-Jarvis F, Sobngwi E, Porcher R, et al.Ketosis-prone type 2 diabetes in patients of sub- Saharan African origin: clinical pathophysiology and natural history of beta-cell dysfunction and insulin resistance. Diabetes 2004; 53 : 645–53. 2. Sobngwi E, Mauvais-Jarvis F, Vexiau P, et al.Diabetes in Africans. Part 1: epidemiology and clinical specificities. Diabetes Metab 2001; 27 : 628–34. 3. Sobngwi E, Mauvais-Jarvis F, Vexiau P, et al.Diabetes in africans. Part 2 : ketosis prone atypical diabetes mellitus. Diabetes Metab 2002; 28 : 5–12. 4. Umpierrez GE, Smiley D, Kitabchi AE. Narrative review: ketosis-prone type 2 diabetes mellitus. Ann Intern Med 2006; 144 : 350–7. 5. Sobngwi E, Gautier JF. Adult-onset idiopathic type I or ketosis-prone type II diabetes: evidence to revisit diabetes classification. Diabetologia 2002; 45 : 283–5. 6. Umpaichitra V, Bastian W, Taha D, et al.C-peptide and glucagon profiles in minority children with type 2 diabetes mellitus. J Clin Endocrinol Metab 2001; 86 : 1605–9. 7. Umpierrez GE, Casals MM, Gebhart SP, et al.Diabetic ketoacidosis in obese African-Americans. Diabetes 1995; 44 : 790–5. 8. Schulz TF. Kaposi’s sarcoma-associated herpesvirus (human herpesvirus 8): epidemiology and pathogenesis. J Antimicrob Chemother 2000; 45 (suppl 3) : 15–27. 9. Crispo A, Tamburini M, De Marco MR, et al.HHV- 8 prevalence, immunosuppression and Kaposi’s sarcoma in South Italy. Int J Mol Med 2001; 7 : 535–8. 10. Weissmann A, Linn S, Weltfriend S, Friedman- Birnbaum R. Epidemiological study of classic Kaposi’s sarcoma: a retrospective review of 125 cases from Northern Israel. J Eur Acad Dermatol Venereol 2000; 14 : 91–5. 11. Sobngwi E, Choukem SP, Agbalika F, et al.Ketosis prone type 2 diabetes and human herpes virus 8 infection in sub-Saharan Africans. JAMA 2008; 299 : 2770–6. |