| |
| Med Sci (Paris). 2009 January; 25(1): 15–16. Published online 2009 January 15. doi: 10.1051/medsci/200925115.Les neurones dopaminergiques greffés dans la maladie de Parkinson sont-il à leur tour atteints par le processus dégénératif ? Faustine Lelan* and Philippe Damier Inserm, UMR643, F44093 Nantes, France CHU de Nantes, Institut de Transplantation et de Recherche en Transplantation, ITERT, F44093 Nantes, France Université de Nantes, Faculté de Médecine, F44093 Nantes, France MeSH keywords: Encéphale, Dopamine, Cellules souches embryonnaires, Humains, Neurones, Maladie de Parkinson |
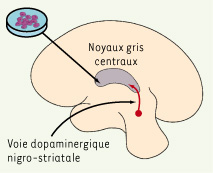
La maladie de Parkinson (MP) est l’une des premières affections neurodégénératives pour laquelle une approche de thérapie cellulaire a été considérée et effectuée. Les lésions qui caractérisent cette maladie - une destruction assez sélective des neurones dopaminergiques nigro-striataux - sont en effet relativement simples, au moins en début d’évolution (Figure 1). Envisager le remplacement des cellules détruites par de nouvelles cellules s’est donc logiquement imposé [
1]. La principale stratégie mise en œuvre jusqu’à aujourd’hui est la greffe de neurones dopaminergiques fœtaux dans le striatum (la principale structure cible de la voie dopaminergique nigro-striatale) [1]. Ce traitement a montré une certaine efficacité pour corriger les symptômes parkinsoniens [
2], mais son intérêt thérapeutique en termes de rapport bénéfice/risque pour les patients n’a pas été confirmé dans deux études contrôlées (greffe versus simulation de greffe) [
3,
4].  | Figure 1.
Une greffe en situation ectopique. La lésion de la voie dopaminergique nigro-striatale est le « cœur » pathologique de la maladie de Parkinson (flèche rouge). La greffe de neurones fœtaux est en situation ectopique dans le striatum, la principale structure cible de la voie dopaminergique. |
|
Devenir des neurones dopaminergiques fœtaux greffés chez les patients atteints de MP Une question jusqu’à présent restée sans réponse est celle de la survie à long terme des cellules greffées et leur éventuelle atteinte par le processus dégénératif. Trois articles récemment publiés simultanément dans Nature Medicine fournissent des éléments de réponse en rapportant les données de l’examen neuropathologique de patients parkinsoniens (au total 8 dans ces 3 études) décédés 9 à 16 ans après avoir reçu une greffe de cellules dopaminergiques fœtales (greffes bilatérales composées chacune de cellules issues de 2 à 4 embryons donneurs par côté) (Figure 1) [
5–
7]. Ces études ont toutes confirmé la survie du greffon. Les analyses histologiques ont montré au niveau des sites de greffe la présence de nombreux amas de neurones dopaminergiques avec des arborescences denses et des prolongements dans le striatum avoisinant. Le résultat le plus surprenant a été l’observation chez trois patients (les deux patients rapportés par Li et al. et le patient rapporté par Kordower et al.) [5,
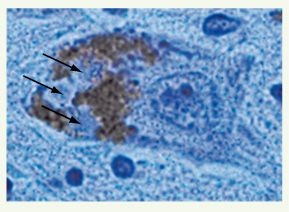
6] d’agrégats exprimant la synucléine et l’ubiquitine dans le corps cellulaire ou les neurites de certains neurones dopaminergiques au niveau du site de la greffe. Ces agrégats, appelés aussi corps de Lewy (Figure 2) et neurites de Lewy, constituent les stigmates neuropathologiques caractéristiques du processus neurodégénératif de la MP. Ils sont considérés comme traduisant un dysfonctionnement du système ubiquitine-protéasome. Ces données suggèrent donc que les neurones greffés ont été à leur tour atteints par le processus dégénératif.  | Figure 2.
Les corps de Lewy stigmates pathologiques de la maladie de Parkinson. Neurone dopaminergique de la substance noire humaine identifiable par la présence de neuromélanine (pigment brun) à l’intérieur duquel on observe des inclusions éosinophiles, les corps de Lewy (flèches). Ce sont ces inclusions caractéristiques du processus dégénératif qui ont été observées dans les neurones greffés. |
La première conséquence de ces résultats est d’ordre pratique. L’atteinte de cellules greffées par le processus dégénératif compromet à terme leur survie et donc l’efficacité de cette stratégie thérapeutique. La deuxième conséquence est d’ordre physiopathologique. Ces observations sont en effet susceptibles d’apporter de nouveaux éléments de connaissance sur le processus dégénératif de la MP ; les cellules greffées devenant en quelque sorte un « modèle » de ce dernier. |
Hypothèses à l’origine de l’atteinte des cellules greffées par le processus de la MP La dégénérescence de ces cellules était assez inattendue. Les neurones greffés sont issus de fœtus a priori à faible risque de développer une MP (incidence de la maladie de 0,5/1 000). Surtout, la MP se développe en général chez les personnes âgées de l’ordre d’une cinquantaine d’années et est exceptionnelle entre 10 et 20 ans, l’âge des cellules greffées [
8]. Plusieurs hypothèses explicatives ont été proposées [
9]. La première tient au site ectopique de la greffe, qui expose potentiellement cette dernière à un microenvironnement qui n’est pas favorable [déficit en facteurs neurotrophiques tels que le GDNF (glial derived neurotrophic factor) et le BDNF (brain derived neurotrophic factor) par exemple] [6]. Une autre hypothèse serait la transmission par l’hôte du processus dégénératif par un mécanisme proche de celui qui serait en cause dans les maladies à prions : l’α-synucléine, dotée d’une mauvaise configuration chez l’hôte, pourrait se transmettre aux cellules greffées et ainsi provoquer dans ces cellules une agrégation protéique anormale [7]. La transmission pourrait se faire par les afférences corticostriatales (des synapses entre ces afférences et des cellules greffées ont été montrées chez le rongeur) [
10]. Un élément important est néanmoins le caractère non systématique de ces anomalies cellulaires. En particulier aucune inclusion anormale, ni autre anomalie, n’a été observée dans les sites de greffe chez les 5 patients rapportés par Mendez et al. [7]. Les résultats contradictoires de cette troisième étude par rapport aux deux autres articles pourraient s’expliquer par des différences de techniques de greffe. Chez les patients rapportés par Mendez et al. [7], les cellules ont été greffées sous forme de suspension cellulaire, alors que dans les deux autres études, elles l’ont été sous forme de fragments tissulaires de mésencéphales fœtaux [5, 6]. Dans tous les cas un traitement immunosuppresseur a été administré pendant au moins 6 mois après la greffe. La deuxième modalité de greffe pourrait donc avoir engendré un processus inflammatoire plus marqué à l’origine de la dégénérescence des cellules greffées. Cette hypothèse est d’ailleurs confortée par l’observation d’un infiltrat microglial plus important dans les sites de greffes chez les 2 patients décrits par Li et al. qui présentaient des signes de dégénérescence [6] que chez les patients rapportés par Mendez et al. [7]. |
De nombreux points d’incertitude doivent être clarifiés avant d’envisager la thérapie cellulaire dans la MP [10]. Les conditions de greffe semblent importantes pour la qualité de la survie du greffon. Soulignons enfin qu’au cours de son évolution la MP ne se résume pas à la destruction du système dopaminergique nigro-striatal et qu’assez rapidement la simple restauration du système initialement atteint est insuffisante pour corriger efficacement la symptomatologie des patients. La meilleure compréhension des phénomènes qui conduisent à la dégénérescence neuronale observée dans les greffes pourrait néanmoins, au-delà de l’amélioration des conditions de thérapie cellulaire, offrir des pistes utiles pour comprendre la neurodégénérescence de la MP et alors conduire à des traitements neuroprotecteurs efficaces. |
1. Björklund A. Dopaminergic transplants in experimental parkinsonism: cellular mechanisms of graft-induced functional recovery. Curr Opin Neurobiol 1992; 2 : 683–9. 2. Lindvall O, Hagell P. Clinical observations after neural transplantation in Parkinson’s disease. Prog Brain Res 2000; 127 : 299–320. 3. Freed CR, Greene PE, Breeze RE, et al. Transplantation of embryonic dopamine neurons for severe Parkinson’s disease. N Engl J Med 2001; 344 : 710–9. 4. Olanow CW, Goetz CG, Kordower JH, et al. A double-blind controlled trial of bilateral fetal nigral transplantation in Parkinson’s disease. Ann Neurol 2003; 54 : 403–14. 5. Kordower JH, Chu Y, Hauser RA, et al. Lewy body-like pathology in long-term embryonic nigral transplants in Parkinson’s disease. Nat Med 2008; 14 : 504–6. 6. Li J, Englund E, Holton JL, et al. Lewy bodies in grafted neurons in subjects with Parkinson’s disease suggest host-to-graft disease propagation. Nat Med 2008; 14 : 501–3. 7. Mendez I, Viñuela A, Astradsson A, et al. Dopamine neurons implanted into people with Parkinson’s disease survive without pathology for 14 years. Nat Med 2008; 14 : 507–9. 8. Corti O, Brice A. La maladie de Parkinson : que nous apprennent les gènes responsables des formes familiales ? Med Sci (Paris) 2003; 19 : 613–9. 9. Brundin P, Li J, Holton JL, et al. Research in motion: the enigma of Parkinson’s disease pathology spread. Nat Rev Neurosci 2008; 9 : 741–5. 10. Doucet G, Murata Y, Brundin P, et al. Host afferents into intrastriatal transplants of fetal ventral mesencephalon. Exp Neurol 1989; 106 : 1–19. |