| |
| Med Sci (Paris). 2009 February; 25(2): 123–125. Published online 2009 February 15. doi: 10.1051/medsci/2009252123.Les progéniteurs adipeux blancs et bruns Pourra-t-on transformer la fourmi en cigale ? Anne Bouloumié,* Coralie Sengenès, and Jean Galitzky Équipe Avenir 1, Inserm U858, Institut de Médecine moléculaire de Rangueil, 1, avenue Jean Poulhès, BP 84225, 31432 Toulouse Cedex 4, France. MeSH keywords: Adipocytes, Tissu adipeux, Tissu adipeux brun, Animaux, Fourmis, Gryllidae, Cellules souches |
Tissu adipeux blanc et brun : deux entités distinctes Le tissu adipeux est un organe endocrine qui joue un rôle majeur dans le maintien de l’homéostasie métabolique. Deux types de tissus adipeux sont distingués chez les mammifères : le tissu adipeux blanc et le tissu adipeux brun. Ces deux tissus présentent des caractéristiques et des localisations anatomiques distinctes [
1]. L’ontogenèse des tissus adipeux blanc et brun diffère, avec un développement pré ou post-natal selon les espèces. Chez l’homme, le tissu adipeux brun est présent chez le fœtus et le nouveau-né et régresse ensuite rapidement. Des arguments récents indirects suggèrent cependant la persistance de tissu adipeux brun chez l’adulte [
2]. Quant au tissu adipeux blanc humain, il se développe à partir du troisième mois de grossesse et présente au cours de la vie des modulations physiologiques de son développement, dont le rebond d’adiposité caractéristique de l’enfant de 6-8 ans, suivi par la répartition anatomique des masses adipeuses à la puberté. À tout âge de la vie, des développements anormaux de la masse grasse blanche peuvent conduire à une extension excessive (obésité) ou à une régression (lipodystrophie/atrophie). Une des différences majeures entre les tissus adipeux blancs et bruns réside dans leur anatomie et leur composition cellulaire. Le tissu adipeux brun est considéré comme étant plus innervé et vascularisé que le tissu adipeux blanc. De plus, les adipocytes, constituants cellulaires majoritaires des tissus adipeux et siège de l’activité métabolique, présentent des caractéristiques distinctes. Les adipocytes blancs sont constitués d’une vacuole lipidique unique et ont peu de mitochondries alors que le cytoplasme des adipocytes bruns contient de nombreuses vacuoles lipidiques de petite taille et un grand nombre de mitochondries. Ces morphotypes cellulaires sont associés à des fonctions spécifiques. Les adipocytes blancs mettent en réserve l’excès d’énergie sous forme de triglycérides et, en situation de demande énergétique, libèrent les acides gras. Les adipocytes bruns dissipent l’énergie sous forme de chaleur. Pour assurer cette fonction particulière, les adipocytes bruns expriment dans leurs mitochondries la protéine découplante ou UCP-1 (uncoupling protein 1) [
14]. De nombreuses approches réalisées chez différents modèles murins ont mis en évidence un effet anti-obésité de la stimulation du développement du tissu adipeux brun. Ainsi il est tentant de spéculer que des approches permettant de stimuler et/ou de réactiver la fonction « brune » pourraient présenter un intérêt thérapeutique pour limiter l’obésité [
3]. Cependant il reste à déterminer l’origine de ces deux tissus et notamment si les adipocytes bruns et blancs sont issus d’une même cellule progénitrice et si un adipocyte blanc pourrait, via des processus de transdifférenciation, exprimer des caractéristiques d’adipocyte brun et vice-versa. Des approches réalisées chez la souris ont en effet suggéré que des processus de transdifférenciation d’adipocytes blancs en adipocytes ressemblant à des adipocytes bruns pouvaient être observés lorsque les souris étaient exposées de façon chronique à une stimulation β-adrénergique [
4]. Toutefois, les cellules isolées de la fraction stromale vasculaire des tissus adipeux blancs et bruns adultes qui contient les cellules progénitrices des adipocytes (ou préadipocytes), ne se différencient in vitro respectivement qu’en adipocytes blancs ou bruns. De nombreux travaux ont étudié les mécanismes moléculaires impliqués dans la différenciation des préadipocytes bruns et blancs en adipocytes matures et certains régulateurs transcriptionnels ont été ainsi impliqués dans la voie « blanche » ou « brune ». PGC1 alpha (PPAR gamma coactivator-1) [
15] et très récemment PRDM16 (PRD1-BF1-RIZ1 homologous domain containing 16) ont été décrits comme spécifiques de l’adipogenèse brune [
5]. |
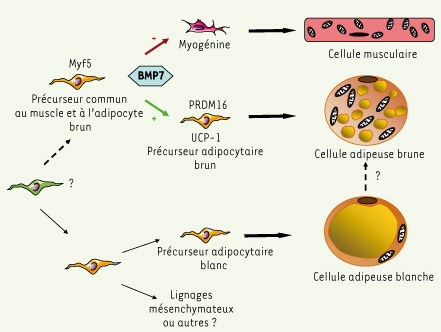
Du préadipocyte à l’adipocyte : le rôle de BMP7 Deux publications récentes viennent d’apporter des éléments de réponse quant à la plasticité des tissus adipeux blancs et bruns (Figure 1). Les travaux de Tseng et al., démontrent que des facteurs externes ayant un rôle clé lors du développement, et plus particulièrement les BMP (bone morphogenetic protein) peuvent être déterminants dans l’acquisition du phénotype brun [
6]. En effet, le traitement des préadipocytes bruns murins par la BMP7 conduit à leur différenciation en adipocytes bruns (expression de marqueurs spécifiques tels que UCP-1 et PRDM16) alors que les préadipocytes blancs ne répondent pas à ce traitement. Cette réponse distincte à BMP7 des deux cellules progénitrices est expliquée par le fait que seuls les préadipocytes bruns sont capables de relayer le signal extracellulaire déclenché par BMP7 en activant la p38 mitogen activated protein kinase. De plus, la masse de tissu adipeux brun des embryons et souriceaux déficients en BMP7 est réduite. Inversement, l’administration de BMP7, via un vecteur viral, à la souris sauvage induit une augmentation de la masse de tissu adipeux brun, ce qui conduit à une élévation de la dépense énergétique et à une baisse de la prise de poids de ces animaux par comparaison à des animaux contrôles. Ainsi, BMP7 pourrait représenter un stimulus externe unique conduisant à la différenciation des préadipocytes bruns en adipocytes bruns fonctionnels.  | Figure 1.
Origine et plasticité des adipocytes du tissu adipeux brun.
|
|
Tissu adipeux brun et tissu musculaire auraient-ils un ancêtre commun ? En parallèle, l’étude de Seale et al. apporte des informations importantes sur l’origine des préadipocytes bruns murins [
7]. La réduction de l’expression de PRDM16 dans des préadipocytes bruns murins exposés à un ARN interférent, provoque, comme attendu, une diminution de l’expression des gènes spécifiques des adipocytes bruns. De façon surprenante, ces cellules ne s’engagent pas dans un programme d’adipogenèse « blanche », mais activent l’expression des gènes myogéniques. À l’inverse, l’expression forcée de PRDM16 dans des myotubes murins en culture primaire conduit à une augmentation de l’expression des gènes marqueurs des adipocytes bruns. Afin d’analyser plus en détails cette relation entre adipocyte brun et muscle squelettique, les auteurs ont réalisé des expériences de suivi des lignages cellulaires chez la souris en utilisant des souris génétiquement modifiées (souris Myf5-Cre knock-in croisées avec des souris R26R3-YFP, exprimant la yellow fluorescent protein à partir du locus Rosa26) permettant de suivre l’expression du facteur myogénique MYF5. Au cours du développement de ces souris, les cellules exprimant MYF5 forment le muscle squelettique et le tissu adipeux brun mais pas le tissu adipeux blanc ; l’étude ne permet toutefois pas de conclure si adipocytes et cellules myogéniques émergent de progéniteurs distincts ou d’un progéniteur commun. Cette étude démontre donc que les voies contrôlant la détermination des lignages adipocytaires bruns et blancs divergent avant la spécification en tissu adipeux brun ou muscle squelettique. Ces résultats renforcent le concept émergeant de lien entre tissu adipeux brun et muscle squelettique. En effet, l’analyse transcriptomique faite par Timmons et al. avait montré une similitude de la signature moléculaire des préadipocytes bruns et des cellules musculaires [
8]. De plus, la présence de préadipocytes bruns a été récemment décrite dans le muscle squelettique chez l’homme [
9]. Enfin, d’un point de vue fonctionnel, ces deux types cellulaires participent au maintien de l’homéostasie thermique par la thermogenèse adaptative pour le tissu adipeux brun et la thermogenèse de frisson pour le muscle squelettique. |
Agir sur le tissu adipeux brun : une perspective chez l’homme ? Le paradigme qui prévaut dans la relation entre thermogenèse et obésité repose sur l’hypothèse que des interventions génétiques ou pharmacologiques qui augmentent les capacités thermogéniques via le tissu adipeux brun vont réduire l’obésité. Ainsi il est tentant de spéculer que la réactivation potentielle du tissu adipeux brun via une exposition à BMP7 ou une activation de PRDM16 pourrait représenter une approche originale pour augmenter la dépense énergétique et limiter l’obésité. Cependant, chez l’homme, l’existence d’une cellule progénitrice du tissu adipeux brun et son identité ne sont pas établies ni le rôle de PRDM16 et des BMP. Une autre question actuellement débattue concerne la cellule progénitrice du tissu adipeux blanc [
10]. Chez la souris, deux études récentes apportent quelques éléments de réponse concernant leur expression de certains marqueurs de surface [
11] et leur localisation particulière au niveau des réseaux vasculaires du tissu adipeux [
12]. Chez l’homme, l’identité et l’origine de cette population cellulaire restent à être clairement déterminées [
13]. Ainsi, en attendant de transformer la fourmi en cigale, l’exercice physique reste la meilleure alternative pour limiter le développement du tissu adipeux blanc : Eh bien dansez maintenant ! |
1. Hansen JB, Kristiansen K. Regulatory circuits controlling white versus brown adipocyte differentiation. Biochem J 2006; 398 : 153–68. 2. Nedergaard J, Bengtsson T, Cannon B. Unexpected evidence for active brown adipose tissue in adult humans. Am J Physiol Endocrinol Metab 2007; 293 : E444–52. 3. Ricquier D. Thermogenèse et obésité. Mécanismes moléculaires. Med Sci (Paris) 1985; 1 : 147–53. 4. Himms-Hagen J, Melnyk A, Zingaretti MC, et al. Multilocular fat cells in WAT of CL-316243-treated rats derive directly from white adipocytes. Am J Physiol Cell Physiol 2000; 279 : C670–81. 5. Farmer SR. Molecular determinants of brown adipocyte formation and function. Genes Dev 2008; 22 : 1269–75. 6. Tseng YH, Kokkotou E, Schulz TJ, et al. New role of bone morphogenetic protein 7 in brown adipogenesis and energy expenditure. Nature 2008; 454 : 1000–4. 7. Seale P, Bjork B, Yang W, et al. PRDM16 controls a brown fat/skeletal muscle switch. Nature 2008; 454 : 961–7. 8. Timmons JA, Wennmalm K, Larsson O, et al. Myogenic gene expression signature establishes that brown and white adipocytes originate from distinct cell lineages. Proc Natl Acad Sci USA 2007; 104 : 4401–6. 9. Crisan M, Casteilla L, Lehr L, et al. A reservoir of brown adipocyte progenitors in human skeletal muscle. Stem Cells 2008; 26 : 2425–33. 10. Billon N, Monteiro MC, Dani C. Developmental origin of adipocytes: new insights into a pending question. Biol Cell 2008; 100 : 563–75. 11. Rodeheffer MS, Birsoy K, Friedman JM. Identification of white adipocyte progenitor cells in vivo. Cell 2008; 135 : E240–9. 12. Tang W, Zeve D, Suh J, et al. White fat progenitor cells reside in the adipose vasculature. Science 2008; 322 : 542–3. 13. Bouloumié A, Maumus M, Galitzky J, Sengenes C. Le tissu adipeux : un donneur de cellules souches ? Cah Nutr Diet 2007; 12 : 73–8. 14. Foufelle F, Ferré P. La réponse UPR : son rôle physiologique et physiopathologique. Med Sci (Paris) 2007; 23 : 291–6. 15. Tiraby C, Langin D. PGC-1alpha, un co-activateur transcriptionnel impliqué dans le métabolisme. Med Sci (Paris) 2005; 21 : 49–54. |