| |
| Med Sci (Paris). 2009 February; 25(2): 127–129. Published online 2009 February 15. doi: 10.1051/medsci/2009252127.SOX18, un nouveau chef d’orchestre moléculaire à l’origine du développement des vaisseaux lymphatiques Mathias François* Koopman Laboratory, Institute for Molecular Bioscience, The University of Queensland, QLD 4072 Brisbane, Australie MeSH keywords: Animaux, Mouvement cellulaire, Développement embryonnaire, Cellules endothéliales, Humains, Vaisseaux lymphatiques, Souris, Mutation, Facteurs de transcription SOX-F |
Quels sont les enjeux de la recherche sur les vaisseaux lymphatiques ? Le système vasculaire lymphatique joue un rôle physiologique majeur dans le contrôle de l’homéostasie des fluides, le trafic des cellules de l’immunité et le transport des lipides. De nombreuses pathologies sont caractérisées par des malformations des vaisseaux lymphatiques comme les lymphœdèmes, la lymphangiectasie, le lymphangiome et la dysplasie lymphatique [
1]. De surcroît, l’arbre vasculaire lymphatique est également au coeur du processus métastatique de certaines tumeurs et joue un rôle clé dans la morbidité d’un nombre important de cancers. En effet, au cours de la tumorigenèse les vaisseaux lymphatiques se redéveloppent afin d’établir un véritable point d’entrée et de faciliter la dissémination des cellules cancéreuses dans l’organisme. L’enjeu est donc clair : identifier et comprendre les programmes génétiques à l’origine du développement des vaisseaux lymphatiques (lymphangiogenèse) constitue une étape essentielle dans la mise en place de futures stratégies thérapeutiques. Moduler la néo-lymphangiogenèse au cours de certaines maladies est déjà envisagé comme une approche complémentaire indispensable aux traitements qui régulent l’angiogenèse (bourgeonnement des vaisseaux sanguins à partir de vaisseaux pré-existants). |
Mutations du gène SOX18 en pathologie humaine La première indication sur le rôle du facteur de transcription SOX18 au cours de la lymphangiogenèse a été fournie par l’identification de mutations récessives ou dominantes de ce gène chez des patients atteints d’un syndrome héréditaire, l’hypotrichosis-lymphedema-telangiectasia ou HLT [
2]. Le syndrome HLT se caractérise principalement par une alopécie (absence ou perte de cheveux), une télangiectasie (malformation vasculaire) et surtout un lymphoedème (accumulation de fluides dans les tissus) sévère chez les patients survivant après la naissance. Ces mutations sont responsables d’un décalage du cadre de lecture qui aboutit à la synthèse d’une protéine SOX18 tronquée : elle agit comme dominant négatif, réduisant ainsi les fonctions endogènes de ce facteur de transcription. Il est important de noter qu’il existe un modèle de souris (Ragged) qui présente naturellement une série de mutations de Sox18 identiques à celles qui ont été identifiées chez l’homme [
3]. Ce modèle animal présente une phénocopie (c’est-à-dire alopécie-télangiectasie-lymphoedème) du phénotype des patients souffrant de HLT, et est consideré comme la contrepartie murine du syndrome humain. La protéine SOX18 appartient à un groupe de facteurs de transcription de la famille du facteur de détermination sexuelle SRY (sex-determining region Y). Cette famille est divisée en 10 sous-groupes (de A à J), SOX18 appartient au groupe F qui comprend egalement SOX7 et SOX17. Ces protéines modulent l’activité transcriptionnelle de leurs gènes cibles en se liant à l’ADN, mais également en le courbant grâce à leur domaine HMG (high mobility group). Les protéines de la famille SOX sont en général des facteurs clefs de l’embryogenèse. Ils sont exprimés dans presque tous les tissus de façon transitoire et spécifique du stade embryonnaire. Ces facteurs de transcription ont de multiples fonctions, par exemple, SOX18 est un modulateur central de la différenciation artério-veineuse [
4], mais joue également un rôle essentiel lors du développement des follicules pileux [3]. |
Développement du système vasculaire lymphatique La première théorie développementale concernant le système lymphatique n’apparaît qu’au début du XXe siècle. En 1902, Florence Sabin [
5] joue un rôle pionnier en suggérant que les cellules endothéliales lymphatiques (CEL) dérivent des cellules endothéliales veineuses déjà préexistantes dans le système vasculaire sanguin de l’embryon. Hypothèse remise en question en 1910 par Huntignton et MacClure, plus favorables à une origine mésenchymateuse des vaisseaux lymphatiques. Tout récemment [
6] une étude basée sur le suivi de cellules ayant un marqueur génétique, a permis de mettre en évidence que les CEL ont comme unique source au cours du développement embryonnaire les cellules endothéliales de la veine cardinale. L’analyse de cette découverte a fait l’objet d’une revue par T. Jaffredo dans un précédent numéro de Médecine/Sciences [
11]. La base de ces récentes avancées est due essentiellement à l’identification d’un gène clé de la lymphangiogenèse : PROX1 (prospero-related homeobox gene). Chez la souris, l’invalidation par recombinaison homologue du gène Prox1 génère un phénotype caractérisé par l’absence complète de cellules lymphatiques endothéliales [
7]. L’expression de ce gène est absolument nécessaire pour maintenir le phénotype lymphatique au cours de l’embryogenèse comme à l’état adulte. Récemment, l’invalidation génique conditionnelle de Prox1 chez la souris adulte a montré que les CEL ne peuvent pas maintenir leur phénotype et se redifférencient en cellules endothéliales vasculaires sanguines [
8]. |
L’étape initiale de la compétence lymphatique Durant les stades très précoces de la différenciation endothéliale lymphatique (9dpc), les cellules endothéliales localisées dans la partie dorsale de la veine cardinale changent de caractéristiques en surexprimant le récepteur de l’acide hyaluronique (LYVE-1, lymphatic vessel endothelial receptor 1). À ce stade l’endothélium vasculaire est considéré comme « compétent » pour exprimer PROX1, le premier marqueur spécifique des CEL. Il est également à noter qu’un partenaire essentiel pour moduler l’activité de PROX1 a été découvert : il s’agit du facteur de transcription COUP-TFII (chicken ovalbumin upstream promoter-transcription factor II), qui joue un rôle indispensable dans le maintien de la différenciation endothéliale veineuse [
9]. En revanche, jusqu’à maintenant aucun mécanisme moléculaire n’avait été caractérisé qui expliquait la régulation génique de Prox1, qui permet de sceller le devenir lymphatique d’une partie de l’endothélium veineux. Au cours de l’embryogenèse, Sox18 est exprimé de façon transitoire dans toutes les cellules endothéliales [3]. Nous avons récemment démontré [
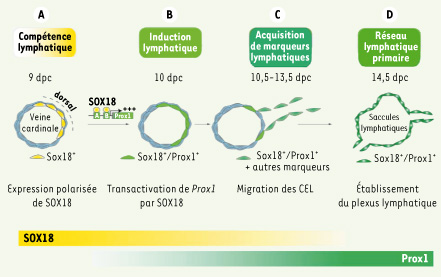
10] que SOX18 est exprimé au cours du développement de façon spécifique dans la partie dorsolatérale de la veine cardinale aux environs de 9 jours post coïtum (dies post-coïtum, dpc). Cette expression précède celle de PROX1 d’environ 12 heures, puis reste colocalisee avec PROX1 dans les CEL jusqu’à 13,5 dpc. Au-delà, l’expression de SOX18 n’est plus détectée dans les CEL, ni pendant le développement, ni à l’état adulte (Figure 1).  | Figure 1.
Modélisation des étapes initiales du développement des vaisseaux lymphatiques chez la souris. A. Vers 9 dpc (dies post-coitum), l’expression de SOX18 se polarise de façon dorso-latérale dans les cellules endothéliales de la veine cardinale. SOX18 active directement la transcription du gène Prox1. B. Les précurseurs des cellules endothéliales lymphatiques (CEL) co-expriment SOX18 et PROX1. C. De 10,5dpc à 13,5dpc les CEL migrent dans le mésenchyme sous-jacent et acquièrent une identité lymphatique après avoir quitté la veine cardinale. Les premiers saccules lymphatiques s’organisent. D. Mise en place du réseau lymphatique primaire où les CEL prolifèrent et développent l’arbre vasculaire lymphatique primordial. |
In vitro, il est possible d’induire la différenciation lymphatique endothéliale à partir de cellules ES (embryonic stem cells) traitées par du VEGF-A (vascular endothelial growth factor) ou VEGF-C. Dans ce système, la surexpression de SOX18 conduit à la surexpression de PROX1 ; de façon complémentaire, la surexpression du dominant négatif de SOX18 induit une inhibition de la production de PROX1. De plus, la surexpression de SOX18 dans des cellules endothéliales vasculaires sanguines (H5V) entraîne une reprogrammation génétique de ces cellules qui aboutit à l’acquisition d’un phénotype lymphatique. L’analyse du promoteur de PROX1 a révélé la présence de deux éléments de réponse aux SOX qui s’avèrent être fonctionnels in vivo. En effet, l’utilisation d’un fragment de 4kb du promoteur de Prox1 fusionné au gène rapporteur de la GFP (green fluorescent protein) permet d’identifier par fluorescence l’endothélium lymphatique en développement. Lorsque les deux éléments de réponse aux SOX sont mutés, une perte d’expression de la GFP est spécifiquement observée dans les CEL des embryons transgéniques Prox1-gfp.
In vivo, il est possible d’induire une lymphangiogenèse ectopique en utilisant des embryons transgéniques, où l’expression ectopique de SOX18 est dirigée par un élément activateur (enhancer) du gène HoxB2 (M. François, Brisbane, Australie, communication personnelle). Enfin, la perte de fonction de Sox18 chez la souris (par invalidation génique ou utilisation d’un dominant négatif Ragged) confère une perte d’expression de PROX1 dans les cellules endothéliales de la veine cardinale ainsi qu’une absence de développement du système vasculaire lymphatique [10]. |
La découverte du rôle majeur de SOX18 en tant que « switch » (commutateur) de la différenciation lymphatique est une étape clef dans la compréhension des mécanismes qui modulent la lymphangiogenèse et permet d’expliquer l’étiologie du syndrome HLT. Cependant il reste encore des zones d’ombre. Par exemple, quels sont les mécanismes qui différencient les diverses fonctions de SOX18 en tant que modulateur artério-veineux ou bien comme inducteur de la différenciation lymphatique ? Le profil d’expression de SOX18 fait de ce gène une cible idéale pour moduler la néo-lymphangiogenèse qui survient durant divers processus pathophysiologiques. En effet SOX18 est complètement absent des CEL chez l’adulte et n’est réexprimé que lors de certains contextes pathologiques comme la cicatrisation ou le développement cancéreux. |
L’auteur remercie Thierry Jafffredo pour ses critiques constructives et ses suggestions lors de la rédaction de ce manuscrit.
|
1. Adams RH, Alitalo K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev 2007; 8 : 464–78. 2. Irrthum A, Devriendt K, Chitayat D, et al. Mutations in the transcription factor gene SOX18 underlie recessive and dominant forms of hypotrichosis-lymphedema-telangiectasia. Am J Hum Genet 2003; 72 : 1470–8. 3. Pennisi D, Gardner J, Chambers D, et al. Mutations in Sox18 underlie cardiovascular and hair follicle defects in ragged mice. Nat Genet 2000; 24 : 434–7. 4. Cermenati S, Moleri S, Cimbro S, et al. Sox18 and Sox7 play redundant roles in vascular development. Blood 2008; 111 : 2657–66. 5. Sabin FR. On the origin of the lymphatic system from the veins, and the development of the lymph hearts and thoracic duct in the pig. Am J Anat 1902; 1 : 367–89. 6. Srinivasan RS, Dillard ME, Lagutin OV, et al. Lineage tracing demonstrates the venous origin of the mammalian lymphatic vasculature. Genes Dev 2007; 21 : 2422–32. 7. Wigle JT, Oliver G. Prox1 function is required for the development of the murine lymphatic system. Cell 1999; 98 : 769–78. 8. Johnson NC, Dillard ME, Baluk P, et al. Lymphatic endothelial cell identity is reversible and its maintenance requires Prox1 activity. Genes Dev 2008; 22 : 3282–91. 9. Lee S, Kang J, Yoo J, et al. Prox1 physically and functionally interacts with COUP-TFII to specify lymphatic endothelial cell fate. Blood 2008, 24 septembre 2008 online. 10. Francois M, Caprini A, Hosking B, et al. Sox18 induces development of the lymphatic vasculature in mice. Nature 2008; 456 : 643–7. 11. Jaffredo T. Origine veineuse des vaisseaux lymphatiques chez les mammifères : l’hypothèse de Sabin vérifiée. Med Sci (Paris) 2008; 24 : 567–9. |