| |
| Med Sci (Paris). 2009 March; 25(3): 253–257. Published online 2009 March 15. doi: 10.1051/medsci/2009253253.La voie Hippo contrôle la croissance des organes au cours du développement Pierre-Luc Bardet** Adresse actuelle : National Institute for Medical Research (MRC), The Ridgeway, NW7 1AA London, Royaume-Uni. Institut Curie, Batiment de Biologie du Développement, 26, rue d’Ulm, 75248 Paris Cedex 05, France |
Pour un tissu donné, deux paramètres contribuent à sa croissance [
1] : la taille moyenne des cellules et leur nombre ; ce dernier augmente avec les divisions cellulaires et diminue par l’élimination de cellules par apoptose (ou mort cellulaire programmée). Ces paramètres font l’objet d’un contrôle génétique précis au cours du développement. D’une part, l’on observe une régulation spécifique de la croissance d’un organisme dans son ensemble [
2] (illustré par le fait qu’un éléphant a une taille d’éléphant, très différente de celle d’une souris). D’autre part, il existe un contrôle spécifique à chaque organe, qui garantit un corps final dont les proportions relatives respectent le plan d’organisation d’une espèce donnée (et mis en évidence par l’observation que les éléphants d’Afrique ont de plus grandes oreilles que ceux d’Asie). La mouche drosophile, nettement plus utilisée que l’éléphant par les généticiens pour des raisons évidentes de taille et de temps de génération, a grandement contribué à améliorer notre compréhension de ces différents mécanismes. Et plus particulièrement leurs disques imaginaux, des tissus larvaires qui, après une croissance très importante au cours du développement post-embryonnaire, sont à l’origine des différents tissus adultes. Leur croissance au cours des stades larvaires détermine en grande partie la taille finale de l’organe adulte, et dépend de contrôles génétiques propres au tissu. Cela a été élégamment démontré par la greffe dans l’abdomen d’une femelle adulte d’un jeune disque imaginal d’aile. Indépendamment de potentiels signaux présents dans la larve dont il provient, ce disque croît, puis s’arrête quand il a atteint une taille identique à celle des disques non transplantés en fin de développement larvaire [
3]. Les mécanismes moléculaires qui « mesurent » ainsi la taille d’un organe et leur impact sur les caractéristiques cellulaires du tissu (prolifération, apoptose et taille des cellules) sont encore très mal compris. La voie Hippo (ou SWH pour Salvador, Warts, Hippo), qui a été nouvellement découverte chez la drosophile, offre un point d’entrée dans l’étude de ce phénomène [
4–
6]. Cette revue s’attachera à décrire les principaux composants de cette voie, leur fonction dans la régulation du nombre de cellules d’un tissu et leurs interactions avec d’autres voies de signalisation. |
Le noyau central de cette voie de signalisation est composé de deux kinases, Warts et Hippo, et de partenaires nécessaires à leur fonction, Salvador et Mats. Warts en fut le premier membre découvert, il y a près de quinze ans [
7,
8]. Les auteurs montrèrent que si l’on induit des mosaïques comprenant des cellules mutantes pour le gène warts (wts) au milieu de tissu sauvage chez la larve (Figure 1), les groupes de cellules déficientes pour Warts grossissent anormalement et forment chez l’adulte des sortes de verrues (warts en anglais). Plus tard, des mutations dans les gènes salvador (sav) [
9,
10], hippo (hpo) [
11–
15] et mats [
16] furent identifiées, conduisant aux mêmes effets dans des tissus mosaïques.  | Figure 1.
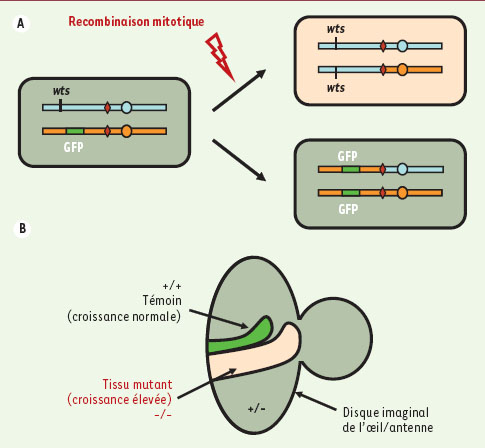
La technique de recombinaison mitotique permet de créer des tissus mosaïques chez la drosophile. A. Pour ce faire, il convient d’insérer une séquence spécifique dite FRT (pour FLP recognition target) à l’extrémité centromérique du bras de chromosome portant la mutation étudiée. Des larves comportant une copie de ce chromosome (bleu) et un site FRT identique accompagné d’un marqueur fluorescent sur le même bras du chromosome homologue (orange) sont hétérozygotes, et donc viables. En induisant l’expression de la recombinase FLP à l’endroit et au moment où on le souhaite, on provoque des événements rares de recombinaison mitotique. Ceci produit deux types de cellules filles différentes, une sauvage avec deux copies du marqueur fluorescent, et l’autre, dépourvue de ce marqueur, qui est homozygote pour la mutation étudiée. B. La descendance de cette dernière forme ensuite un groupe de cellules mutantes pour la fonction du gène étudié dans un tissu environnant sauvage. L’autre cellule fille produit une portion de tissu témoin, générée en même temps mais sauvage. |
L’essentiel de ces expériences fut mené dans le disque imaginal d’œil/antenne. Après une phase de division intense, les cellules de ce disque arrêtent leur prolifération pour se différencier. À l’inverse du tissu sauvage environnant, les cellules mutantes pour sav, hpo, wts ou mats continuent de proliférer. Cela s’accompagne du maintien de l’expression du gène de la cycline E (cycE), qui normalement disparaît à l’arrêt de la prolifération [9, 10]. De plus, la durée du cycle cellulaire de ces cellules mutantes est très légèrement raccourcie, ce qui contribue à leur prolifération excessive [11]. Après cette phase d’arrêt de prolifération, les cellules de l’oeil dans une larve sauvage se différencient en photorécepteurs, soies et cellules interstitielles pigmentaires. Ces dernières sont produites en abondance, l’excédent étant éliminé par apoptose lors du développement normal de l’oeil. Dans les clones mutants pour la voie Hippo, la différenciation des différents types cellulaires est normale, mais les cellules interstitielles pigmentaires restent excédentaires, du fait de la forte diminution de l’apoptose. Cela peut s’expliquer en partie par la suractivation transcriptionnelle du gène codant pour DIAP1 (drosophila inhibitor of apoptosis protein), une protéine connue pour bloquer l’apoptose [11]. Outre l’excès de prolifération, la résistance à l’apoptose des cellules mutantes contribue donc à l’excroissance des mosaïques. Au fur et à mesure de la découverte de ces mutations aux phénotypes similaires, leurs interactions génétiques et biochimiques furent étudiées. Les activités Ser/Thr kinase de Hippo et Warts - suggérées par leur analogie avec des kinases connues - furent rapidement confirmées. En particulier, Hippo s’auto-phosphoryle, et a aussi pour substrat Mats, Warts et Sav. Ce dernier facilite la phosphorylation de Warts par Hippo, potentiellement en favorisant le rapprochement des deux kinases [6]. La phosphorylation de Warts par Hippo, ainsi que son interaction avec Mats, conduisent à l’activation de sa fonction kinase. Ces données biochimiques corroborent les observations génétiques. En particulier, le fait que la mutation warts réduise fortement l’induction de l’apoptose produite par la surexpression de hippo [
12], suggère que l’activité Ser/Thr kinase de Hippo active celle de Warts, formant ainsi une cascade de phosphorylations qui conduit à la suppression de la transcription de gènes cibles, tels que cycE et diap1
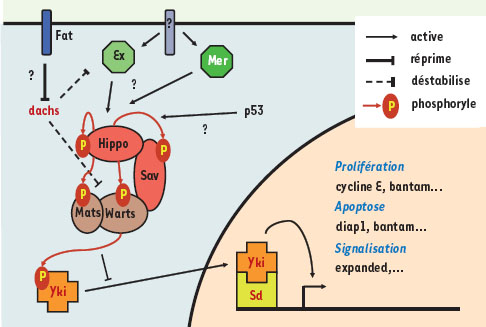
(Figure 2).  | Figure 2.
Schéma résumant les principaux composant de la voie Hippo et leurs relations. Pour le détail des explications, se reporter au texte et aux références citées. Les protéines sont représentées en rouge pour les activateurs des gènes cibles de la voie et en noir si elles les répriment. Les points d’interrogation et de suspension indiquent les principaux points inconnus ou incomplets à ce jour. |
L’étude de ces mosaïques montre donc que la voie Hippo est requise pour restreindre la croissance des tissus, en limitant le nombre final de cellules. La modification transcriptionnelle des gènes comme diap1 et cycE suggère un contrôle transcriptionnel, qui réduit la prolifération cellulaire tout en favorisant la mort cellulaire. Par contre, ces mutations n’ont aucun effet sur la taille des cellules. De même, les cellules mutantes se différencient de façon en grande partie normale, indiquant que le signal Hippo est requis spécifiquement pour limiter le nombre de cellules. |
La régulation transcriptionnelle en aval de la voie Hippo Les liens entre l’activité de Warts et la régulation transcriptionnelle commencent à être bien élucidés. En cherchant des protéines qui interagissent avec Warts, Yorkie (Yki), un homologue d’un co-activateur transcriptionnel chez les vertébrés (YAP, pour Yes-associated protein), fut identifié [
17]. Yki est directement phosphorylé par Warts, et sa surexpression dans des clones mime le phénotype d’excroissance observé dans les mutants perte de fonction de la voie Hippo. A l’inverse, les cellules mutantes pour Yki ne survivent presque pas dans les disques imaginaux, et n’expriment plus diap1. Pour finir, la mutation yki supprime l’effet des mutations hpo, sav, wts, confirmant que ce co-activateur est essentiel pour le contrôle de la croissance par le signal Hippo. La phosphorylation de Yki par Warts promeut son interaction avec la protéine 14-3-3 dans le cytoplasme, l’empêchant d’activer ses gènes cibles (Figure 2). L’un des facteurs de transcription essentiel pour la régulation des gènes cibles de Yki est Scalloped (Sd), un facteur de la famille TEAD (TEA domain (TEAD) proteins)1. Des expériencces de perte et gain de fonction confirment qu’il est requis pour l’expression du phénotype de la cascade conduisant à Yki [
18–
20]. De plus, il fixe spécifiquement le promoteur de diap1, et coopère avec Yki pour activer son expression [
19]. Il est probable que cette fonction de Scalloped soit spécifique à certains organes (comme l’aile) et que, selon le tissu, d’autres facteurs de transcription encore inconnus collaborent avec Yki pour contrôler la croissance [6]. Comme on l’a vu précédemment, les gènes cibles de la voie Hippo contrôlent la prolifération (comme cycE) ou l’apoptose (comme diap1). Mais ces deux exemples n’expliquent pas l’intégralité des effets de la voie Hippo, et la liste des cibles est pour l’instant loin d’être complète. Un autre gène régulé par la voie hippo a été identifié : il code pour le microARN bantam [
21,
22]. Les microARN, de petite taille et non transcrits, peuvent réguler de nombreux processus cellulaires, en s’hybridant à des séquences spécifiques contenues dans des ARN messagers de leur cible. Dans ce cas, bantam est un activateur de la prolifération tout en inhibant l’apoptose. Il favorise la survie en activant la dégradation de l’ARNm du gène pro-apoptotique hid quand il le fixe [21]. Réprimé par la voie Hippo, il contribue donc au contrôle de l’arrêt de la croissance des tissus larvaires. Comme bien souvent dans les voies de signalisation, la voie Hippo régule aussi l’expression de facteurs impliqués dans son propre contrôle, permettant ainsi des boucles de rétroaction négatives limitant l’effet d’une activation. Par exemple, Yki active l’expression d’expanded (voir ci-dessous), qui active Hippo et Warts et réprime ainsi l’activité de Yki. Enfin, il a été montré que la voie Hippo régulait un aspect de la différenciation tardive des photorécepteurs après l’arrêt de la prolifération [4] ou de l’architecture cellulaire dans l’ovocyte [
23]. Ces effets, spécifiques à certains types cellulaires, impliquent l’existence de gènes cibles différents, qui restent encore entièrement à découvrir. On voit donc qu’une fois activée, la cascade Hippo-Warts réprime l’activité transcriptionnelle de Yki, réduisant ainsi à la fois la prolifération et la résistance à l’apoptose des cellules. Ce système permet donc de limiter la croissance d’un tissu donné. Découvrir les signaux qui régulent ces kinases représente une étape cruciale dans la compréhension du contrôle de la croissance des tissus. Quelques protéines agissant en amont de Hippo ont été identifiées, mais beaucoup reste encore à faire. |
Le signal Hippo permet d’intégrer différents signaux Merlin (Mer) et Expanded (Ex) sont deux protéines à domaine FERM (ezrin, radixin, moesin)2, appartenant à une famille de molécules connues entre autres pour leur rôle de lien entre les protéines de la membrane et le cytosquelette. Des yeux mosaïques pour ces mutations individuelles produisent de faibles excroissances. Ensemble, elles agissent en synergie pour produire un phénotype proche de celui que créent des pertes de fonction de la voie Hippo. Logiquement, il a été montré que Mer et Ex activent Hippo, en agissant de façon partiellement redondante [
24]. De plus, ex (et dans certaines situations mer) est activé en réponse à l’activation du signal Hippo, renforçant leur implication dans cette voie de signalisation. Bien que le mécanisme précis de leur contribution reste incompris, on peut postuler l’existence d’au moins un récepteur transmembranaire commun dont l’action sur Hippo nécessite au moins l’une de ces deux protéines (Figure 2). Fat est une protéine transmembranaire proche des cadhérines, connues pour leur activité d’adhésion cellulaire. Cependant, elle ne semble pas directement promouvoir l’adhésion entre cellules, mais joue un rôle de molécule de signalisation [6]. Elle est impliquée dans le contrôle de la polarisation des cellules dans le plan de l’épithélium (PCP pour planar cell polarity) et la croissance cellulaire. C’est cette dernière fonction qui a conduit de nombreux laboratoires à se pencher sur la relation entre le signal Fat et la voie Hippo [
25–
28]. Dans des mosaïques contenant des cellules mutantes pour le gène fat, ces dernières surexpriment les gènes cibles de la voie Hippo. De plus, comme ex, la mutation fat agit en synergie avec mer pour produire un grand excès de cellules dans l’œil. Cette grande similitude des phénotypes des mutants fat et ex - ce dernier présentant aussi des défauts d’ordre PCP - suggère un lien dans leur fonction. Fat agit en réprimant l’activité de la myosine non-conventionelle Dachs, dont la mutation antagonise celle de Fat. Or, Dachs agit en diminuant la stabilité des protéines Warts et Ex, indépendamment de Hippo (Figure 2) [6]. Ainsi, la diminution de l’abondance de Ex dans les cellules mutantes pour fat [
26, 28], en partie responsable de l’excès de croissance, explique la similitude de ces deux mutations. Le morphogène Decapentaplegic (Dpp) est une molécule diffusible qui organise le disque imaginal de l’aile et contrôle la différenciation des cellules dans les différents domaines. Il est aussi nécessaire et suffisant pour induire la croissance du tissu [
29]. Or, ce contrôle implique Fat et sa fonction sur la voie Hippo. En particulier, le gradient de Dpp produit une asymétrie dans l’activité de Fat sur Dachs, ce qui permet de contrôler d’une façon dynamique la quantité de Warts et donc l’intensité du signal Hippo [
30]. Cela indique que différenciation et croissance sont liées, car régulées en partie par des signaux communs. Enfin, la voie Hippo est régulée par d’autres voies de signalisation. C’est le cas par exemple de p53, activé lors de lésions génomiques pour contrôler la mort cellulaire et muté dans de nombreux cancers chez l’Homme. En cas d’irradiation de disques d’ailes chez la drosophile, p53 est activée et induit une réponse apoptotique. Lorsque le tissu est mutant pour des membres de la voie Hippo, le nombre de cellules apoptotiques diminue dans les disques irradiés, et tout indique que p53 agit en partie en activant Hippo, par un mécanisme encore inconnu [
31]. |
Bien loin d’être complet, un modèle se dessine où la voie Hippo intègre des signaux intracellulaires (comme p53) et extracellulaires (comme Dpp), pour déterminer la prolifération et la sensibilité à l’apoptose des cellules d’un tissu (Figure 2). L’un des principaux défis des années à venir consiste à identifier tous les signaux régulant Hippo et Warts, et à comprendre comment ils sont simultanément coordonnés pour assurer la différenciation et la morphogenèse des tissus dont ils contrôlent la croissance. L’implication récente du morphogène Dpp représente un pas important vers cette compréhension. Pour finir, l’étude de cette voie de signalisation, qui a connu un véritable engouement chez les drosophilistes, est en train d’être explorée chez les mammifères [
32]. Et tout confirme que tant les interactions entre ses principaux membres que son rôle dans le contrôle de la croissance sont conservés. Par exemple, YAP, homologue de Yki, est phosphorylé par la même cascade de kinases, ce qui conduit au même effet, sa séquestration dans le cytoplasme, bloquant ainsi la prolifération et la résistance à l’apoptose [
33]. In vitro, l’activation de cette cascade a été impliquée dans l’arrêt de la prolifération des cellules par inhibition de contact [33]. Et tout comme chez la drosophile, la voie Hippo contrôle la taille finale des organes. Ainsi, si le facteur YAP est surexprimé dans le foie d’une souris, celui-ci devient anormalement gros [
34]. Et qui dit excès de croissance dit cancer : après quelques mois, ces souris développent des tumeurs du foie. Confirmant cette observation, des mutations dans les homologues de mer (NF2 pour Neurofibromatosis type-2), sav (hWW45) et warts (lats) ont été trouvées dans des cellules cancéreuses humaines [4]. Cela illustre bien l’intérêt des recherches très fondamentales sur les mécanismes développementaux d’un animal aussi distant de l’homme qu’est la drosophile. Car, au-delà de la satisfaction de notre curiosité face aux mécanismes du vivant, la confrontation de ces modèles est riche de découvertes pour la compréhension de processus humains, dont celui qui conduit au développement de cancers chez l’humain, avec les promesses d’identifier à terme de potentiels traitements. |
Je remercie Jean-Paul Vincent et Golnar Kolahgar pour leur relecture attentive et leurs conseils pour améliorer cet article.
|
Footnotes |
1. Roisin-Bouffay C, Gomer RH. Comment atteindre la bonne taille ? Med Sci (Paris) 2004; 20 : 219–24. 2. Colombani J, Bianchini L, Layalle S, Leopold P. Stéroïdes, insuline et croissance : les mouches dopent la recherche. Med Sci (Paris) 2006; 22 : 241–3. 3. Day SJ, Lawrence PA. Measuring dimensions: the regulation of size and shape. Development 2000; 127 : 2977–87. 4. Pan D. Hippo signaling in organ size control. Genes Dev 2007; 21 : 886–97. 5. Saucedo LJ, Edgar BA. Filling out the Hippo pathway. Nat Rev Mol Cell Biol 2007; 8 : 613–21. 6. Reddy BV, Irvine KD. The Fat and Warts signaling pathways: new insights into their regulation, mechanism and conservation. Development 2008; 135 : 2827–38. 7. Justice RW, Zilian O, Woods DF, et al. The Drosophila tumor suppressor gene warts encodes a homolog of human myotonic dystrophy kinase and is required for the control of cell shape and proliferation. Genes Dev 1995; 9 : 534–46. 8. Xu T, Wang W, Zhang S, et al. Identifying tumor suppressors in genetic mosaics: the Drosophila lats gene encodes a putative protein kinase. Development 1995; 121 : 1053–63. 9. Tapon N, Harvey KF, Bell DW, et al. Salvador promotes both cell cycle exit and apoptosis in Drosophila and is mutated in human cancer cell lines. Cell 2002; 110 : 467–78. 10. Kango-Singh M, Nolo R, Tao C, et al. Shar-pei mediates cell proliferation arrest during imaginal disc growth in Drosophila. Development 2002; 129 : 5719–30. 11. Wu S, Huang J, Dong J, Pan D. Hippo encodes a Ste-20 family protein kinase that restricts cell proliferation and promotes apoptosis in conjunction with salvador and warts. Cell 2003; 114 : 445–56. 12. Jia J, Zhang W, Wang B, et al. The Drosophila Ste20 family kinase dMST functions as a tumor suppressor by restricting cell proliferation and promoting apoptosis. Genes Dev 2003; 17 : 2514–9. 13. Harvey KF, Pfleger CM, Hariharan IK. The Drosophila Mst ortholog, hippo, restricts growth and cell proliferation and promotes apoptosis. Cell 2003; 114 : 457–67. 14. Udan RS, Kango-Singh M, Nolo R, et al. Hippo promotes proliferation arrest and apoptosis in the Salvador/Warts pathway. Nat Cell Biol 2003; 5 : 914–20. 15. Pantalacci S, Tapon N, Leopold P. The Salvador partner Hippo promotes apoptosis and cell-cycle exit in Drosophila. Nat Cell Biol 2003; 5 : 921–7. 16. Lai ZC, Wei X, Shimizu T, et al. Control of cell proliferation and apoptosis by mob as tumor suppressor, mats. Cell 2005; 120 : 675–85. 17. Huang J, Wu S, Barrera J, et al. The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie, the Drosophila Homolog of YAP. Cell 2005; 122 : 421–34. 18. Wu S, Liu Y, Zheng Y, et al. The TEAD/TEF family protein scalloped mediates transcriptional output of the hippo growth-regulatory pathway. Dev Cell 2008; 14 : 315–6. 19. Zhang L, Ren F, Zhang Q, et al. The TEAD/TEF family of transcription factor Scalloped mediates Hippo signaling in organ size control. Dev Cell 2008; 14 : 377–87. 20. Goulev Y, Fauny JD, Gonzalez-Marti B, et al. SCALLOPED interacts with YORKIE, the nuclear effector of the hippo tumor-suppressor pathway in Drosophila. Curr Biol 2008; 18 : 435–41. 21. Thompson BJ, Cohen SM. The Hippo pathway regulates the bantam microRNA to control cell proliferation and apoptosis in Drosophila. Cell 2006; 126 : 767–74. 22. Nolo R, Morrison CM, Tao C, et al. The bantam microRNA is a target of the hippo tumor-suppressor pathway. Curr Biol 2006; 16 : 1895–904. 23. Polesello C, Tapon N. Salvador-warts-hippo signaling promotes Drosophila posterior follicle cell maturation downstream of notch. Curr Biol 2007; 17 : 1864–70. 24. Hamaratoglu F, Willecke M, Kango-Singh M, et al. The tumour-suppressor genes NF2/Merlin and Expanded act through Hippo signalling to regulate cell proliferation and apoptosis. Nat Cell Biol 2006; 8 : 27–36. 25. Willecke M, Hamaratoglu F, Kango-Singh M, et al. The fat cadherin acts through the hippo tumor-suppressor pathway to regulate tissue size. Curr Biol 2006; 16 : 2090–100. 26. Silva E, Tsatskis Y, Gardano L, et al. The tumor-suppressor gene fat controls tissue growth upstream of expanded in the hippo signaling pathway. Curr Biol 2006; 16 : 2081–9. 27. Cho E, Feng Y, Rauskolb C, et al. Delineation of a Fat tumor suppressor pathway. Nat Genet 2006; 38 : 1142–50. 28. Bennett FC, Harvey KF. Fat cadherin modulates organ size in Drosophila via the Salvador/Warts/Hippo signaling pathway. Curr Biol 2006; 16 : 2101–10. 29. Affolter M, Basler K. The Decapentaplegic morphogen gradient: from pattern formation to growth regulation. Nat Rev Genet 2007; 8 : 663–74. 30. Rogulja D, Rauskolb C, Irvine KD. Morphogen control of wing growth through the Fat signaling pathway. Dev Cell 2008; 15 : 309–21. 31. Colombani J, Polesello C, Josue F, Tapon N. Dmp53 activates the Hippo pathway to promote cell death in response to DNA damage. Curr Biol 2006; 16 : 1453–8. 32. Zeng Q, Hong W. The emerging role of the hippo pathway in cell contact inhibition, organ size control, and cancer development in mammals. Cancer Cell 2008; 13 : 188–92. 33. Zhao B, Wei X, Li W, et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev 2007; 21 : 2747–61. 34. Dong J, Feldmann G, Huang J, et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell 2007; 130 : 1120–33. |