| |
| Med Sci (Paris). 2009 March; 25(3): 259–265. Published online 2009 March 15. doi: 10.1051/medsci/2009253259.Ostéoimmunologie : une vision globale et intégrée du tissu squelettique et du système immunitaire Implication pour la recherche en rhumatologie Anne Gallois,* Marlène Mazzorana, Jean Vacher, and Pierre Jurdic Institut de génomique fonctionnelle de Lyon, ENS Lyon, 46, allée d’Italie, 69364 Lyon, France |
Contrairement aux idées reçues, l’os est un tissu métaboliquement dynamique qui est en constant renouvellement puisque chez les vertébrés adultes, 10 % du squelette osseux sont remplacés chaque année par de l’os néoformé. L’homéostasie osseuse résulte de l’équilibre dynamique entre la formation osseuse assurée par les ostéoblastes d’origine mésenchymateuse et la résorption effectuée par les ostéoclastes d’origine hématopoïétique, les seules cellules capables de dégrader les tissus minéralisés. L’équilibre entre ces deux processus antagonistes est régulé par un grand nombre de facteurs systémiques ou locaux : des cytokines (RANKL, receptor activator of NF-κB ligand ; M-CSF, macrophage colony stimulating factor, des interleukines IL-1, 6, 11, 17…), des hormones (calcitonine, PTH ou parathormone, 1,25-dihydroxyvitamin D3, prostaglandine E2, leptine), des neuromédiateurs, des récepteurs membranaires, des molécules de signalisation intra- et inter-cellulaire et des facteurs de transcription. Les premiers liens entre système immunitaire et physiologie osseuse ont été établis après l’identification de facteurs sécrétés par les cellules de l’immunité, capables d’activer la différenciation ostéoclastique, comme l’IL-1β [
1]. Depuis, il a été mis en évidence que de très nombreuses molécules, décrites initialement comme des régulateurs de la fonction des cellules immunitaires (cytokines, récepteurs, facteurs de transcription) jouaient également un rôle dans la biologie des ostéoclastes et des ostéoblastes. Parmi les autres interactions décrites entre les deux systèmes, il faut également mentionner le rôle central que jouent les ostéoblastes dans la régulation de la « niche » des cellules souches hématopoïétiques. De plus, les ostéoclastes partagent un précurseur myéloïde commun avec les macrophages et les cellules dendritiques (DC) [
2,
3]. L’ensemble de ces données conduit à penser l’os et le système immunitaire non plus comme deux entités distinctes mais comme deux parties intégrantes de l’ostéo-immunosystème, ce qui a abouti, il y a quelques années, à l’émergence d’un nouveau champ de recherche : l’ostéo-immunologie [
4]. Cette discipline en pleine expansion a pour objectif d’analyser les conséquences des interactions entre os et système immunitaire pour le développement et l’homéostasie osseuses, dans des conditions physiologiques normales ou dans le cas de pathologies inflammatoires. Les exemples les plus typiques de l’interaction entre ces deux systèmes sont observés dans les maladies auto-immunes inflammatoires comme la polyarthrite rhumatoïde (PR) dans laquelle une activation anormale du système immunitaire conduit à une perte osseuse généralisée par la formation de lésions ostéolytiques associées à une réduction de la synthèse osseuse. Longtemps controversé, le rôle prépondérant des ostéoclastes dans la PR, à la fois dans la perte osseuse généralisée et dans la formation des lésions focalisées, est aujourd’hui bien établi [
5,
6] (Figure 1).  | Figure 1.
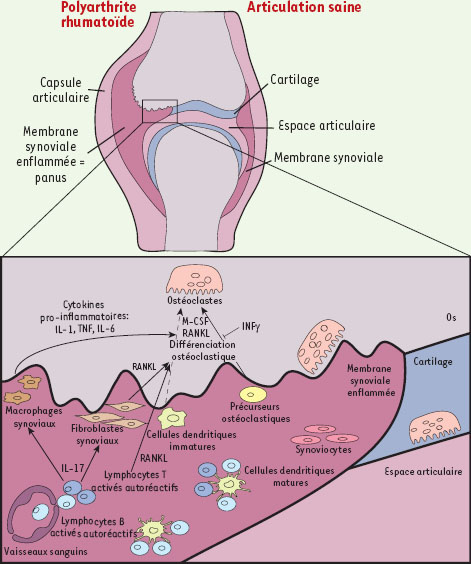
Principaux acteurs de la polyarthrite rhumatoïde. La polyarthrite rhumatoïde est une maladie auto-immune multifactorielle d’étiologie inconnue, caractérisée par une inflammation chronique conduisant à une perte osseuse généralisée accompagnée par la formation de lésions ostéolytiques. Le processus inflammatoire qui touche les articulations des patients est caractérisé par l’infiltration dans la membrane synoviale de nombreuses cellules du système immunitaire (lymphocytes B et T, cellules dendritiques, monocytes, macrophages…). On constate également une prolifération des synoviocytes de type fibroblastique ou macrophagique chroniquement activés, qui conduit au développement d’un panus synovial situé à la périphérie de l’articulation et qui envahit progressivement l’os et le cartilage. La destruction osseuse est le résultat de l’activité de résorption des ostéoclastes, dont le nombre, la durée de vie, et/ou l’activité sont potentialisés par de nombreuses cytokines inflammatoires produites en grande quantité par un système immunitaire activé (RANKL, IL-1, IL-6, TNF-α). Parmi les cellules présentes au niveau de la membrane synoviale, on trouve également des lymphocytes TH17, seule population de lymphocytes capable d’induire l’ostéoclastogenèse en sécrétant de grandes quantités d’IL-17. Cette interleukine active en effet la production de RANKL par les fibroblastes synoviaux et la sécrétion par les macrophages synoviaux des cytokines pro-inflammatoires IL-1, IL-6 et TNF-α qui stimulent la différenciation ostéoclastique. |
|
Origines diverses des précurseurs ostéoclastiques Les ostéoclastes sont des cellules d’origine hématopoïétique provenant de précurseurs de la lignée monocyte/macrophage, qui se différencient sous le contrôle de deux cytokines, M-CSF et RANKL [
7]. Ils sont identifiables par leur multinucléation résultant de la fusion de précurseurs monocytaires. Bien que non entièrement spécifiques des ostéoclastes, certains marqueurs sont couramment utilisés pour les caractériser : l’isoforme 5b de la phosphatase acide résistante au tartrate (TRAP5b), la cathepsine K, le récepteur à la calcitonine, l’intégrine αVβ3 et NFATc1 (nuclear factor of activated T-cells), facteur de transcription clé de l’ostéoclastogenèse, activé en aval de la phospholipase PLCγ et du flux calcique résultant. Mais le meilleur marqueur fonctionnel des ostéoclastes reste leur capacité unique à résorber des matrices minéralisées. Nous avons montré, ainsi que d’autres, que les cellules dendritiques (DC) humaines et murines étaient également capables de fusionner entre elles et de se transdifférencier en ostéoclastes fonctionnels in vitro et in vivo [
8–
10] (Figure 2). Une étude récente vient de démontrer que l’injection de DC purifiées de la rate pouvait partiellement restaurer le phénotype ostéopétrotique de souris oc/oc dépourvues d’ostéoclastes [
11]. Ces résultats mettent donc en évidence l’existence d’un nouveau précurseur ostéoclastique tardif, au même titre que les monocytes et les macrophages. Les DC pourraient ainsi être impliquées dans la génération d’ostéoclastes, notamment dans des pathologies inflammatoires comme la polyarthrite rhumatoïde. D’ailleurs, la transdifférenciation des DC en ostéoclastes, à la différence de la différenciation classique des ostéoclastes décrite à partir de monocytes, est fortement potentialisée par l’addition de liquides synoviaux a-cellulaires issus de patients atteints de polyarthrite rhumatoïde [8]. De plus, les DC purifiées ex vivo à partir de liquides synoviaux de patients atteints de PR sont également capables d’engendrer des ostéoclastes fonctionnels lorsqu’elles sont mises en présence de M-CSF et de RANKL. À ce jour, la finalité de cette diversité d’origine des ostéoclastes n’est pas encore totalement élucidée et, outre les précurseurs ostéoclastiques tardifs que représentent les monocytes, les macrophages et les DC, il existe une grande variété de précurseurs hématopoïétiques beaucoup plus précoces [
12]. 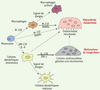 | Figure 2.
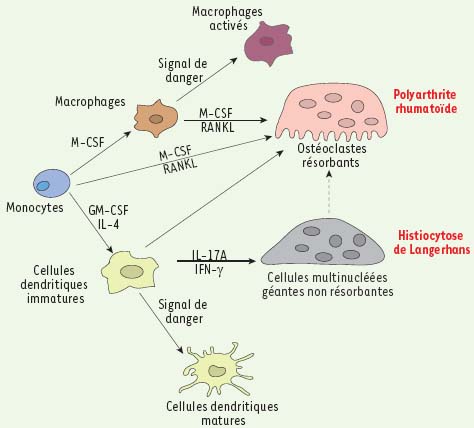
Plasticité au sein de la lignée myéloïde. Les monocytes ont la capacité de se différencier en macrophages en présence de M-CSF, en ostéoclastes en réponse aux cytokines ostéoclastogéniques M-CSF et RANKL et en cellules dendritiques myéloïdes en présence de GM-CSF et d’IL-4. Ces cellules dendritiques sont quant à elles capables d’engendrer des ostéoclastes résorbants en présence des deux cytokines ostéoclastogéniques, mais aussi des cellules multinucléées géantes non résorbantes en présence d’IL-17A. Ces ostéoclastes et ces cellules multinucléées géantes pourraient être impliqués dans des situations pathologiques inflammatoires comme, respectivement, la polyarthrite rhumatoïde et l’histiocytose de Langerhans. |
Il faut noter, par ailleurs, que le processus de fusion des DC en cellules multinucléées géantes est impliqué dans l’histiocytose de Langerhans, une maladie orpheline caractérisée par une accumulation de DC anormales et associée à des lésions tissulaires et osseuses. Une étude a mis en évidence le rôle majeur joué par l’interleukine 17A dans la fusion des DC engendrant ainsi des cellules géantes multinucléées qui produisent une grande quantité d’enzymes protéolytiques directement impliquées dans la destruction tissulaire [
13]. |
Communauté des voies de signalisation entre ostéoclastes et cellules immunes La triade RANKL/RANK/OPG RANKL est une protéine homotrimérique membranaire de type II, synthétisée par les ostéoblastes et les lymphocytes T activés, qui se lie à son récepteur RANK présent à la surface des précurseurs ostéoclastiques [
14]. Ce récepteur est également exprimé par les monocytes, les DC, les fibroblastes et les lymphocytes B et T. L’interaction de RANKL avec son récepteur RANK est indispensable à l’ostéoclastogenèse [
15], mais également à la survie et à l’activation des DC [
16]. Dans ce dernier cas, c’est le contact entre les lymphocytes T, qui synthétisent RANKL, et les DC exprimant le récepteur RANK qui permet son action. La délétion du gène codant pour RANKL chez la souris a fourni l’une des premières preuves du rôle crucial de ce facteur, à la fois dans le système osseux et dans le système immunitaire. Les souris déficientes en RANKL présentent une ostéopétrose, liée à l’absence d’ostéoclastes, dont la sévérité est caractérisée par l’absence d’éruption des dents et de cavité médullaire [
17]. Par conséquent, le siège de l’hématopoïèse est déplacé de la moelle osseuse vers la rate ou le foie [
18]. Si le nombre de monocytes et de macrophages n’est pas affecté chez les souris RANKL−/−, ces animaux sont dépourvus de ganglions lymphatiques et présentent un thymus de taille réduite, ainsi qu’une splénomégalie. Ces travaux ont démontré la nécessité de RANKL dans le développement des précurseurs lymphocytaires. Quant aux souris déficientes pour le récepteur RANK, elles expriment pour l’essentiel le même phénotype que celui des souris RANKL−/− (ostéopétrose, absence totale de ganglions lymphatiques, maturation des lymphocytes B altérée), bien que la différenciation thymique soit intacte [
19]. Enfin, il existe un récepteur leurre soluble de RANKL, l’ostéoprotégérine (OPG), synthétisé par les ostéoblastes, les cellules lymphoïdes et les DC, qui inhibe l’interaction RANK/RANKL [
20] et se comporte donc comme un régulateur négatif important de l’ostéoclastogenèse. Les souris OPG−/− présentent effectivement une ostéoporose sévère caractérisée par une importante porosité de l’os cortical et une forte incidence de fractures. De plus, le développement des lymphocytes B est altéré et les DC ont une capacité accrue à stimuler la prolifération des lymphocytes T [
21]. Le rôle de RANKL dans la PR a été mis en évidence après avoir constaté que des souris RANKL−/− étaient protégées de la dégradation osseuse induite par le transfert de sérum dans un modèle d’arthrite inflammatoire destructrice [5]. Bien que les lymphocytes soient la source majeure de RANKL, des travaux ont montré que le RANKL exprimé à la surface des fibroblastes synoviaux est également responsable de la destruction osseuse [
22]. De plus, on observe chez l’homme une surexpression de RANKL, accompagnée d’une diminution d’OPG dans les tissus synoviaux de patients atteints d’une forme active et destructive de PR [
23]. Même si les mécanismes responsables du déséquilibre de la balance RANKL/OPG doivent être éclaircis, l’implication de la triade RANKL/RANK/OPG dans la dégradation osseuse de la PR est bien caractérisée. Des études récentes concernant l’utilisation d’anticorps monoclonaux dirigés contre RANKL - mimant ainsi la fonction d’OPG - dans le traitement de la perte osseuse liée à la PR donnent des résultats encourageants [
24]. La voie des costimulateurs à domaine ITAM (immunoreceptor tyrosine based activation motif) La différenciation ostéoclastique requiert, en plus des facteurs M-CSF et RANKL, une troisième voie de signalisation passant par les protéines adaptatrices à domaine ITAM. Ces signaux, dits de co-stimulation, mis en évidence dans les cellules immunitaires, sont déclenchés par l’activation de récepteurs possédant un très court domaine intracellulaire. Pour fonctionner après la fixation d’un ligand, ces récepteurs doivent s’associer à des protéines adaptatrices transmembranaires - ou co-récepteurs - qui permettent le déclenchement de différentes voies de signalisation via leur domaine ITAM et la protéine kinase Syk (Figure 3). L’étude des souris déficientes pour les adaptateurs et récepteurs impliqués dans les signaux de co-activation a été déterminante dans la compréhension de leur rôle dans les systèmes osseux, immunitaire mais aussi nerveux. Nous nous intéresserons plus particulièrement aux adaptateurs DAP12 1 et FcRg ( un récepteur du fragment Fc des immunoglobulines) qui jouent un rôle prépondérant dans les ostéoclastes, et à leurs récepteurs associés, respectivement TREM-2 ( triggering receptor expressed on myeloid cells 2) et OSCAR ( osteoclasts associated receptor). En plus des ostéoclastes, les adaptateurs DAP12 et FcRγ sont exprimés dans les autres cellules du lignage myéloïde (DC, monocytes, macrophages, cellules microgliales), mais également dans certaines populations de lymphocytes et dans les oligodendrocytes. 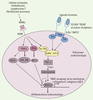 | Figure 3.
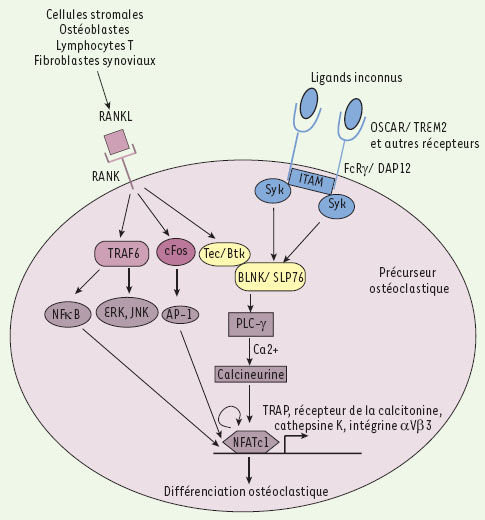
Intégration des voies RANK et ITAM par les protéines kinase Btk et Tec. L’ostéoclastogenèse est stimulée par les ostéoblastes, les lymphocytes T, les fibroblastes synoviaux et les cellules stromales de la moelle osseuse qui fournissent le RANKL, le M-CSF et les ligands - encore inconnus - des adaptateurs à domaines ITAM. La liaison de RANKL à son récepteur RANK permet à la fois le recrutement de TRAF6, qui active NK-κB et les MAPK, JNK et ERK, et celui de c-Fos qui induit la formation du complexe AP-1. Les facteurs de transcription NK-κB et AP-1 vont alors permettre en partie l’activation de NFATc1, facteur de transcription clé de la différenciation ostéoclastique. Les kinases Btk et Tec sont également activées par RANK après phosphorylation. En parallèle, les adaptateurs DAP12 et FcRγ possèdent dans leur domaine intracellulaire un motif ITAM chargé de deux tyrosines. Après interaction des récepteurs membranaires (TREM-2, OSCAR, MDL-1, SIRPβ - signal-regulatory protein β - et PIRα) avec leurs ligands respectifs et leur association avec leur adaptateur, ces derniers sont phosphorylés par les kinases de la famille Src. Cela entraîne la création de sites d’ancrage permettant le recrutement des tyrosine kinases Syk qui sont alors phosphorylées. L’ensemble induit l’activation de protéines adaptatrices comme BLNK (B cell linker) et SLP-76 qui permettent la formation du complexe de signalisation ostéoclastogénique en recrutant à la fois les kinases Tec et Btk induites par RANK et la PLCγ (phospholipase Cγ). Ce complexe est indispensable à l’augmentation du flux calcique, lui-même nécessaire à l’activation de NFATc1. De nombreuses études concernant NFATc1 ont permis de montrer qu’il régulait directement de nombreux gènes spécifiques des ostéoclastes tels que TRAP, le récepteur à la calcitonine, la cathepsine K, l’intégrine αVβ3 et OSCAR. |
Chez l’homme, des mutations dans les gènes codant pour DAP12 et TREM-2 ont été corrélées à une pathologie rare, appelée maladie de Nasu Hakola, observée essentiellement au Japon et en Finlande et caractérisée par des kystes osseux, des fractures, une démence présénile et une mort prématurée. Les précurseurs monocytaires des patients atteints de cette maladie sont incapables de se différencier in vitro en ostéoclastes fonctionnels en présence de M-CSF et de RANKL [
25]. L’étude des souris déficientes en DAP12 a également mis en évidence l’incapacité des précurseurs ostéoclastiques médullaires ou spléniques à se différencier in vitro en ostéoclastes en présence de M-CSF et RANKL [
26,
27]. Une modeste différenciation peut néanmoins être obtenue lorsque ces précurseurs sont co-cultivés avec des ostéoblastes. Les souris DAP12−/− présentent une ostéopétrose liée à un défaut de résorption par les ostéoclastes, présents au niveau de la matrice osseuse, mais incapables de la résorber. Quant aux souris FcRg−/−, elles ne présentent pas de phénotype osseux. En revanche, les souris double-knock out pour DAP12−/− et FcRγ−/− ont une ostéopétrose beaucoup plus sévère que celle des souris DAP12−/−, caractérisée par une absence d’ostéoclastes. De plus, la co-culture d’ostéoblastes normaux avec des précurseurs médullaires DAP12−/− FcRγ−/− n’est pas capable de restaurer leur différenciation ostéoclastique, contrairement à celle des précurseurs DAP12−/−. Tous ces résultats montrent que la voie RANK/RANKL est indispensable, mais insuffisante, pour induire la différenciation terminale des ostéoclastes qui requiert des signaux supplémentaires de co-stimulation relayés par les protéines adaptatrices DAP12 et FcRγ. De plus, l’étude des souris DAP12−/− FcRγ−/− suggère que les ostéoblastes - par un contact cellule-cellule - apportent un signal essentiel, autre que celui délivré par M-CSF et RANKL, qui passerait par FcRγ en l’absence de DAP12 [
28]. Cependant, la nature de ce signal reste à ce jour inconnue et son identification s’avère complexe. En effet, les souris déficientes en TREM2 n’ont pas de phénotype ostéopétrotique ni de kystes osseux, ce qui est en contradiction avec les caractéristiques de la maladie de Nasu Hakola [
29]. Des résultats non publiés, communiqués par Y.W. Choi (University of Pennsylvania School of Medicine, USA) au dernier congrès d’ostéo-immunologie (Rhodes, Juin 2008), montrent que la double inactivation de TREM-2 et d’OSCAR n’entraîne aucun phénotype osseux chez la souris. Ces résultats en apparence contradictoires conduisent à conclure que le rôle des adaptateurs DAP12 et FcRγ est essentiel dans l’ostéoclastogenèse et que ces adaptateurs sont activés par plusieurs récepteurs - en plus de TREM2 et d’OSCAR -, via des ligands qui restent à découvrir. L’intégration des signaux RANK et ITAM par les protéines tyrosine kinases Bruton et Tec Si les signaux d’activation en amont des adaptateurs à domaine ITAM restent inconnus, le groupe d’H. Takayanagi (Tokyo Medical and Dental University, Japon) vient d’identifier les acteurs moléculaires capables d’intégrer à la fois les signaux stimulés en aval du complexe RANK/RANKL et ceux transmis par les immunorécepteurs à domaine ITAM, afin d’induire le flux calcique nécessaire à l’activation de NFATc1 [
30]. Afin d’identifier les molécules activées par RANK et capables de stimuler le signal calcique en réponse à l’activation par phosphorylation de la protéine phospholipase C γ (PLCγ), les auteurs se sont intéressés aux tyrosine kinases fortement exprimées par les ostéoclastes. C’est une étude transcriptomique qui a ainsi permis d’identifier les tyrosine kinases Tec et Btk (Bruton tyrosine kinase), dont le rôle avait été surtout étudié dans les lymphocytes. Les souris déficientes en Tec n’ayant pas de phénotype osseux et celles dépourvues de Btk n’ayant qu’une très légère ostéopétrose, l’étude s’est concentrée sur l’analyse des souris ayant une double délétion Tec−/− Btk−/−. Ces dernières développent une ostéopétrose sévère, caractérisée par un défaut de résorption dû à une altération de la différenciation ostéoclastique. Les auteurs démontrent que le défaut de différenciation des précurseurs médullaires de souris Tec−/− Btk−/− a une origine intrinsèque. Dans les cellules Tec−/− Btk−/−, la phosphorylation des tyrosines de la PLCγ, ainsi que les oscillations de calcium nécessaires à l’induction en aval de NFATc1, sont fortement altérées, tandis que les auteurs observent un niveau normal d’expression des MAPK (ERK, JNK, p38) en aval de TRAF6. Ces résultats convergent et orientent vers un rôle de Btk et Tec dans la phosphorylation des PLCγ et, donc, dans l’intégration des signaux induits par RANK et vers un rôle du signal calcique induit par les adaptateurs à domaine ITAM. Plus précisément, les auteurs montrent que c’est l’activation de Btk par RANK et celle de BLNK (B cell linker, adaptateur phosphorylé par Syk) par les signaux des immunorécepteurs à domaine ITAM, qui permet la formation du complexe Btk/BLNK, induisant ainsi l’activation de NFATc1. Cependant, le fait que les cellules BLNK−/− n’aient aucun défaut de différenciation ostéoclastique suggère un effet compensatoire d’autres protéines comme SLP76, protéine adaptatrice homologue à BLNK dans les lymphocytes T. Par ailleurs, chez l’homme, des mutations dans le gène codant pour Btk induisent un défaut dans le développement des cellules B, ainsi qu’une réduction de la densité osseuse. Outre la connexion entre deux voies de signalisation, les tyrosine kinases Bruton et Tec établissent ainsi, une fois de plus, un lien entre les systèmes immunitaire et osseux, donnant de ce fait une vision intégrée de ces deux systèmes jusqu’à très récemment encore considérés comme indépendants. |
Importance du microenvironnement dans l’activation ostéoclastique Implications thérapeutiques L’ostéo-immunologie apporte un éclairage totalement nouveau dans la compréhension de l’ostéoclastogenèse et soulève de nombreuses questions portant sur l’origine, la différenciation et l’activation des ostéoclastes, en fonction de leur microenvironnement et/ou des conditions physiopathologiques dans lesquelles ils se trouvent. Nous avons vu que les ostéoclastes des souris DAP12−/− sont incapables de résorber l’os et qu’ils sont absents des souris DAP12−/− FcRγ−/−. Pourtant, l’ovariectomie des femelles, mimant une situation de carence estrogénique, entraîne une ostéoporose qui diffère selon les sites osseux étudiés. Ainsi, l’on observe une importante perte osseuse induite après ovariectomie au niveau de l’os trabéculaire des os longs, traduisant une réactivation des ostéoclastes, tandis qu’elle est bloquée au niveau des vertèbres et de l’os cortical [
31,
32]. Ces résultats suggèrent que des variations d’expression de l’un et/ou de l’autre des adaptateurs ont des répercussions locales différentes et qu’il existe probablement des voies de signalisation alternatives qui sont engagées en fonction des interactions avec le microenvironnement, afin d’induire le remodelage osseux [
33]. Ces résultats limitent donc considérablement l’utilisation de stratégies visant à réprimer les adaptateurs pour combattre certaines pathologies comme l’ostéoporose. À l’inverse, les données du groupe de H. Takayanagi montrent que les souris Tec−/− Btk−/− sont légèrement protégées de la perte osseuse induite après ovariectomie, mais surtout qu’elles sont protégées de la perte osseuse induite dans un modèle inflammatoire murin après injection de LPS (lipopolysaccharide) [30]. Ces auteurs spéculent donc avec raison sur le développement d’une stratégie thérapeutique visant à réprimer l’ostéoclastogenèse in vivo dans des situations pathologiques comme l’ostéoporose ou la polyarthrite rhumatoïde, en inactivant Tec grâce notamment à l’utilisation d’inhibiteurs comme LFM-A13. |
Conclusions et perspectives Les recherches effectuées en ostéo-immunologie suggèrent que la différenciation et la fonction même des ostéoclastes sont sous le contrôle de voies de signalisation qui dépendent de facteurs environnementaux qui restent à élucider. En effet, en conditions pathologiques, notamment dans les cas d’ostéoporose, il semblerait que l’ostéoclastogenèse dépende de voies de signalisation différentes de celles requises en conditions physiologiques. Dans le cas de maladies osseuses inflammatoires, certains immunosuppresseurs comme les anti-TNF-α ou les anti-IL-1β ont déjà démontré leur efficacité. Dans ce cadre, l’utilisation d’inhibiteurs des kinases Tec ou Btk représente une nouvelle stratégie potentielle pour prévenir la perte osseuse associée à des situations inflammatoires. Il faudra cependant rester très prudent, dans la mesure où ces molécules sont également impliquées dans le fonctionnement normal du système immunitaire. |
Le travail de l’équipe de PJ est soutenu par la FRM, le Pro-A (Inserm), et l’ANR (maladies rares).
|
Footnotes |
1. Dewhirst FE, Stashenko PP, Mole JE, Tsurumachi T. Purification and partial sequence of human osteoclast-activating factor : identity with interleukin 1 beta. J Immunol 1985; 135 : 2562–8. 2. Miyamoto T, Ohneda O, Arai F, et al. Bifurcation of osteoclasts and dendritic cells from common progenitors. Blood 2001; 98 : 2544–54. 3. Servet-Delprat C, Arnaud S, Jurdic P, et al. Flt3+ macrophage precursors commit sequentially to osteoclasts, dendritic cells and microglia. BMC Immunol 2002; 24 : 3:15. 4. Arron JR, Choi Y. Bone versus immune system. Nature 2000; 408 : 535–6. 5. Pettit AR, Ji H, von Stechow D,et al.TRANCE/RANKL knockout mice are protected from bone erosion in a serum transfer model of arthritis. Am J Pathol 2001; 159 : 1689–99. 6. Redlich K, Hayer S, Ricci R,et al. Osteoclasts are essential for TNF-alpha-mediated joint destruction. J Clin Invest 2002; 110 : 1419–27. 7. Solari F, Jurdic P. Nouveaux concepts sur l’origine des ostéoclastes : relation avec les macrophages normaux et inflammatoires. Med Sci
(Paris) 1997; 13 : 1285–93. 8. Rivollier A, Mazzorana M, Tebib J, et al. Immature dendritic cell transdifferentiation into osteoclasts : a novel pathway sustained by the rheumatoid arthritis microenvironment. Blood 2004; 104 : 4029–37. 9. Alnaeeli M, Penninger JM, Teng YT. Immune interactions with CD4+ T cells promote the development of functional osteoclasts from murine CD11c+ dendritic cells. J Immunol 2006; 177 : 3314–26. 10. Speziani C, Rivollier A, Gallois A, et al. Murine dendritic cell transdifferentiation into osteoclasts is differentially regulated by innate and adaptive cytokines. Eur J Immunol 2007; 37 : 747–57. 11. Wakkach A, Mansour A, Dacquin R, et al. Bone marrow microenvironment controls the in vivo differentiation of murine dendritic cells into osteoclasts. Blood 2008; 112 : 5074–83. 12. Xing L, Schwarz EM, Boyce BF Osteoclast precursors, RANKL/RANK, and immunology. Immunol Rev 2005; 208 : 19–29. 13. Coury F, Annels N, Rivollier A, et al. Langerhans cell histiocytosis reveals a new IL-17A-dependent pathway of dendritic cell fusion. Nat Med 2008; 14 : 81–7. 14. Marie P, Halbout P OPG/RANKL : implication et cible thérapeutique dans l’ostéoporose. Med Sci (Paris) 2008; 24 : 105–10. 15. Hsu H, Lacey DL, Dunstan CR, et al. Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand. Proc Natl Acad Sci USA 1999; 96 : 3540–5. 16. Anderson DM, Maraskovsky E, Billingsley WL, et al. A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell function. Nature 1997; 390 : 175–9. 17. Kim N, Odgren PR, Kim DK, et al. Diverse roles of the tumor necrosis factor family member TRANCE in skeletal physiology revealed by TRANCE deficiency and partial rescue by a lymphocyte-expressed TRANCE transgene. Proc Natl Acad Sci USA 2000; 97 : 10905–10. 18. Kong YY, Yoshida H, Sarosi I, et al. OPGL is a key regulator of osteoclastogenesis, lymphocyte development and lymph-node organogenesis. Nature 1999; 397 : 315–23. 19. Dougall WC, Glaccum M, Charrier K, et al. RANK is essential for osteoclast and lymph node development.Genes Dev 1999; 18 : 2412–24. 20. Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin : a novel secreted protein involved in the regulation of bone density. Cell 1997; 89 : 309–19. 21. Yun TJ, Tallquist MD, Aicher A, et al. Osteoprotegerin, a crucial regulator of bone metabolism, also regulates B cell development and function. J Immunol 2001; 166 : 1482–91. 22. Takayanagi H, Iizuka H, Juji T, et al. Involvement of receptor activator of nuclear factor kappaB ligand/osteoclast differentiation factor in osteoclastogenesis from synoviocytes in rheumatoid arthritis. Arthritis Rheum 2000; 43 : 259–69. 23. Crotti TN, Smith MD, Weedon H, et al. Receptor activator NF-kappaB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients : semiquantitative and quantitative analysis. Ann Rheum Dis 2002; 61 : 1047–54. 24. Haynes DR, Barg E, Crotti TN, et al. Osteoprotegerin expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathies and osteoarthritis and normal controls. Rheumatology 2003; 42 : 123–34. 25. Paloneva J, Mandelin J, Kiialainen A, et al. DAP12/TREM2 deficiency results in impaired osteoclast differentiation and osteoporotic features. J Exp Med 2003; 198 : 669–75. 26. Kaifu T, Nakahara J, Inui M, et al. Osteopetrosis and thalamic hypomyelinosis with synaptic degeneration in DAP12-deficient mice. J Clin Invest 2003; 111 : 323–32. 27. Nataf S, Anginot A, Vuaillat C, et al. Brain and bone damage in KARAP/DAP12 loss-of-function mice correlate with alterations in microglia and osteoclast lineages. Am J Pathol 2005; 166 : 275–86. 28. Mócsai A, Humphrey MB, Van Ziffle JA,et al. The immunomodulatory adapter proteins DAP12 and Fc receptor gamma-chain (FcRgamma) regulate development of functional osteoclasts through the Syk tyrosine kinase. Proc Natl Acad Sci USA 2004; 101 : 6158–63. 29. Colonna M, Turnbull I, Klesney-Tait J. The enigmatic function of TREM-2 in osteoclastogenesis. Adv Exp Med Biol 2007; 602 : 97–105. 30. Shinohara M, Koga T, Okamoto K, et al. Tyrosine kinases Btk and Tec regulate osteoclast differentiation by linking RANK and ITAM signals. Cell 2008; 132 : 794–806. 31. Lee SH, Kim T, Jeong D, et al. The tec family tyrosine kinase Btk Regulates RANKL-induced osteoclast maturation. J Biol Chem 2008; 283 : 11526–34. 32. Anginot A, Dacquin R, Mazzorana M, Jurdic P. Lymphocytes and the Dap12 adaptor are key regulators of osteoclast activation associated with gonadal failure. PLoS One 2007; 2 : e585. 33. Wu Y, Torchia J, Yao W, et al. Bone microenvironment specific roles of ITAM adapter signaling during bone remodeling induced by acute estrogen-deficiency. PLoS One 2007; 2 : e586. |