| |
| Med Sci (Paris). 2009 April; 25(4): 343–345. Published online 2009 April 15. doi: 10.1051/medsci/2009254343.Migration des cellules tumorales : GEF et GAP montrent le chemin Gilles Gadéa* Équipe Pierre Roux, Centre de Recherche de Biochimie Macromoléculaire, CNRS UMR 5237, 1919, route de Mende, 34293 Montpellier Cedex 05, France MeSH keywords: Animaux, Antinéoplasiques, Mouvement cellulaire, Protéines de liaison à l'ADN, Systèmes de délivrance de médicaments, dGTPases, Protéines d'activation de la GTPase, Humains, Modèles biologiques, Métastase tumorale, Protéines tumorales, Transduction du signal, Facteurs de transcription, Protéine G cdc42, Protéines G rac, Protéines G rho |
Dans la plupart des cancers, la mortalité est essentiellement liée à la formation de métastases. Lors de ce processus, les cellules tumorales dont les fonctions prolifératives sont déjà altérées, complètent leur potentiel malin par un accroissement de leur capacité migratoire. Cela permet leur dissémination et l’établissement de tumeurs secondaires au niveau de sites distants. L’absence de stratégies thérapeutiques efficaces contre ce processus métastatique justifie l’effort de recherches et le besoin de découvertes dans ce domaine. Dans l’organisme, les cellules sont en contact avec une matrice extracellulaire et évoluent dans un environnement en trois dimensions (3D). Les études récentes du processus de migration cellulaire à l’intérieur d’une matrice 3D (gels de collagène, matrices issues de cellules ou cultures associant plusieurs couches de cellules mimant la diversité d’un tissu) plus représentative de la réalité physiologique que les systèmes 2D classiques ont révolutionné la manière d’appréhender les mécanismes de motilité. Dans de tels environnements, la façon dont les cellules migrent et les morphologies qu’elles peuvent adopter sont complètement différentes de celles qu’elles adoptent lorsqu’elles sont cultivées sur les substrats bidimensionnels plats et rigides qui sont habituellement utilisés. Ainsi, en 3D, on distingue deux types de migration individuelle : la migration amiboïde et la migration de type mésenchymateux [
1]. Ces deux phénotypes migratoires ont également été observés in vivo et plusieurs études ont révélé que les cellules pouvaient alterner ces deux modes de migration, en fonction notamment des conditions environnementales [1,
2]. Si les conditions environnementales ne sont pas propices à l’un de ces modes de migration, certaines cellules cancéreuses opteront pour l’autre mode de migration afin de ne pas interrompre leur déplacement. Lorsque les cellules se déplacent selon le mode amiboïde, leur morphologie générale est celle d’une sphère dotée de protrusions membranaires globulaires extrêmement dynamiques. Dans ces conditions, les cellules semblent pouvoir migrer au travers de la MEC en s’affranchissant au moins partiellement de la dégradation protéique qui accompagne ce processus. A contrario, si les cellules choisissent une migration de type mésenchymateux, leur morphologie est allongée de type fibroblastique. Dans ce cas, la dégradation de la MEC est un prérequis pour que les cellules puissent la traverser. |
Rho et Rac déterminent le mode amiboïde ou mésenchymateux de la migration Or, morphologie et migration sont sous la dépendance du cytosquelette d’actine et de l’ensemble des molécules capables de le remanier, notamment les petites GTPases de la famille Rho [
8,
9]. Ainsi, les deux modes de migration dans une structure 3D sont déterminés par l’utilisation de voies de signalisation spécifiques et antagonistes. La migration amiboïde nécessite l’activation de la GTPase RhoA et de sa kinase effectrice ROCK, alors que la migration mésenchymateuse fait intervenir l’activation de la Rho GTPase Rac [
3]. Une cellule est donc capable d’adapter sa morphologie et son type de migration aux contraintes imposées par le milieu extracellulaire en modifiant l’équilibre entre les voies de signalisation dépendantes soit de RhoA soit de Rac. Bien que les contributions de RhoA et Rac soient clairement définies, les mécanismes permettant la régulation de leur activité respective restent mal documentés. La régulation de l’activité des Rho GTPases est sous le contrôle essentiellement de deux grandes familles de protéines : les GEF (guanine nucleotide exchange factors) qui facilitent l’échange du GDP (guanosine-5’-diphosphate) par le GTP (guanosine-5’-triphosphate) et contrôlent ainsi l’activation des GTPases, et les GAP (GTPases accelerating protein) qui catalysent la réaction d’hydrolyse du GTP conduisant à l’inactivation des GTPases [
4,
5]. Il existe seulement une vingtaine de Rho GTPases, mais leurs régulateurs sont, eux, bien plus nombreux : environ 80 GEF et 70 GAP. Une même Rho GTPase peut donc interagir avec différentes protéines régulatrices, et c’est donc GEF et GAP qui assurent ainsi sélectivité et spécificité signalétiques. |
GEF et GAP sont les vrais « sélectionneurs » Dans ce contexte, une découverte majeure dans la compréhension de la migration cellulaire a récemment été faite dans le laboratoire du Pr Christopher Marshall à Londres. Le Dr Victoria Sanz-Moreno et ses collègues ont identifié un niveau supplémentaire de complexité dans la régulation des Rho GTPases et la détermination du mode de migration adopté par les cellules tumorales [
6]. En illustrant l’importance jouée par les GEF et les GAP dans un modèle de mélanome humain, les travaux du Dr Victoria Sanz-Moreno ont permis d’établir les bases moléculaires des mécanismes de plasticité cellulaire et ainsi d’expliciter comment la cellule peut choisir un mode de migration particulier. En effet, l’activation spécifique de Rac par son facteur d’échange DOCK3 en aval de NEDD9 (neural precursor cell expressed, developmentally down-regulated 9), reconnu pour son rôle dams la formation des métastases, favorise la mise en place d’une migration mésenchymateuse. L’activation consécutive de WAVE2, molécule impliquée dans la polymérisation de l’actine et membre de la famille des protéines WASP (Wiskott-Aldrich syndrome protein) a pour conséquence d’inactiver la voie de signalisation RhoA. Dans ces conditions, la cellule tumorale se retrouve dans l’incapacité de générer un mouvement de type amiboïde. À l’inverse, l’activation de la voie de signalisation RhoA-ROCK conduit à l’activation d’un régulateur négatif de l’activité de Rac : la GAP ARH-GAP22 (Rho GTPase activating protein 22) et donc à l’inhibition de la migration mésenchymateuse. Ainsi, sous l’impulsion de diverses stimulations notamment environnementales, le jeu coordonné des GEF et des GAP va permettre l’activation exclusive de Rho ou de Rac et la mise en place d’une voie de signalisation spécifique entraînant obligatoirement l’inhibition de la voie antagoniste. |
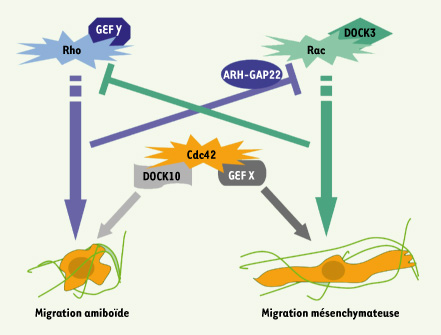
Un troisième larron : la Rho GTPase Cdc42 Nous avons également démontré pour la première fois l’importance pour la migration 3D d’une troisième Rho GTPase : Cdc42 (cell division cycle 42). Cette dernière est remarquable parce qu’elle est impliquée dans les deux types de migration [
7]. La hiérarchie des évènements est la suivante : le facteur d’échange DOCK10 va déclencher l’activation de Cdc42 ainsi qu’une cascade réactionnelle impliquant notamment les molécules effectrices PAK2 (p21 protein (Cdc42/Rac)-activated kinase 2) et N-WASP (neural Wiskott-Aldrich syndrome protein). L’association du GEF de Cdc42 DOCK10 avec ses effecteurs PAK2 et N-WASP constitue un module favorable à la mise en place de la migration amiboïde. En complément, nos travaux démontrent également que, sous l’impulsion de facteurs d’échange encore inconnus, Cdc42 est aussi impliquée dans la migration de type mésenchymateux, rôle qui était jusqu’alors l’apanage de Rac. L’identification de la voie de signalisation DOCK10-Cdc42-N-WASP/Pak2 comme une composante majeure de la migration tumorale amiboïde est une découverte primordiale. Cette voie est en effet utilisée par les cellules invasives pour produire des mouvements amiboïdes, rôle dévolu jusqu’à maintenant à la seule voie RhoA/ROCK. Ainsi, de façon schématique, les cellules peuvent utiliser deux stratégies différentes pour décider de leur mode de migration. La première repose sur le choix de la GTPase : Rac pour la migration mésenchymateuse ou RhoA pour la migration amiboïde. Dans la seconde, une même GTPase, Cdc42, est en cause, et c’est l’activateur qui diffère, et qui va être responsable de la spécification du type de migration utilisé (Figure 1).
 | Figure 1.
Stratégies de mise en place des différents modes de migration tridimensionnelle. Deux modes de migration antagonistes ont été décrits dans un environnement tridimensionnel : la migration amiboïde et la migration mésenchymateuse. L’établissement de la migration amiboïde résulte soit de l’activation de la GTPase RhoA par un GEF Y dont l’identité reste à déterminer soit de l’activation de la GTPase Cdc42 par son facteur d’échange DOCK10. Par ailleurs, la migration mésenchymateuse fait intervenir l’activation de la GTPase Rac par son facteur d’échange DOCK3 ou bien encore la GTPase Cdc42 sous le contrôle d’un GEF X différent de celui qui est engagé dans la migration amiboïde et qui reste également à identifier. De plus, l’activation de RhoA ou de Rac conduit à l’inhibition de la voie antagoniste, notamment par l’activation de GAP, ARH-GAP22 dans le cas de la migration mésenchymateuse. En revanche, Cdc42 se trouve à une place centrale qui lui permet selon le jeu des GEF (DOCK10 ou X) de sélectionner l’un des deux types de migration. |
|
Comme l’illustrent ces travaux sur la signalisation des petites GTPases de la famille Rho au cours des mécanismes de migration et d’invasion, le rôle joué par les GEF et les GAP est d’une importance capitale car ces adaptateurs déterminent la sélectivité et la spécificité de la migration. Les GEF et GAP véhiculent ainsi un fort potentiel thérapeutique [8]. Envisager leur inhibition spécifique permettrait de limiter la diffusion du signal et les effets secondaires ainsi que la mise en place d’une thérapie anti-métastatique enfin efficace. |
1. Wolf K, Mazo I, Leung H, et al. Compensation mechanism in tumor cell migration: mesenchymal-amoeboid transition after blocking of pericellular proteolysis. J Cell Biol 2003; 160 : 267–77. 2. De Wever O, Nguyen QD, Van Hoorde L, et al. Tenascin-C and SF/HGF produced by myofibroblasts in vitro provide convergent pro-invasive signals to human colon cancer cells through RhoA and Rac. FASEB J 2004; 18 : 1016–8. 3. Sahai E, Marshall CJ. Differing modes of tumour cell invasion have distinct requirements for Rho/ROCK signalling and extracellular proteolysis. Nat Cell Biol 2003; 5 : 711–9. 4. Rossman KL, Der CJ, Sondek J. GEF means go: turning on RHO GTPases with guanine nucleotide-exchange factors. Nat Rev Mol Cell Biol 2005; 6 : 167–80. 5. Peck J, Douglas G 4th, Wu CH, Burbelo PD. Human RhoGAP domain-containing proteins: structure, function and evolutionary relationships. FEBS Lett 2002; 528 : 27–34. 6. Sanz-Moreno V, Gadea G, Ahn J, et al. Rac activation and inactivation control plasticity of tumor cell movement. Cell 2008; 135 : 510–23. 7. Gadea G, Sanz-Moreno V, Self A, et al. DOCK10-mediated Cdc42 activation is necessary for amoeboid invasion of melanoma cells. Curr Biol 2008; 18 : 1456–65. 8. Renault L, Guibert B, Cherfils J. Structural snapshots of the mechanism and inhibition of a guanine nucleotide exchange factor. Nature 203; 426 : 525–30. 9. Ménager C, Kaibuchi K. Les protéines Rho : leur rôle dans les neurones. Med Sci
(Paris) 2003; 19 : 358–63. 10. Primeau M, Lamarche-Vane N. Coup d’œil sur les petites GTPases Rho. Med Sci (Paris) 2008; 24 : 157–62. |