| |
| Med Sci (Paris). 2009 June; 25(6-7): 551–553. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7551.Métabolisme du NAD et contrôle de la réponse inflammatoire Frédéric Van Gool, Mara Galli, Anthony Rongvaux, Fabienne Andris, and Oberdan Leo* Laboratoire de physiologie animale, Université Libre de Bruxelles, rue des Professeurs Jeener et Brachet 12, B-6041 Gosselies, Belgique MeSH keywords: Humains, Inflammation, NAD, Sirtuines |
Une série de travaux publiés récemment semble indiquer un rôle important pour une protéine impliquée dans la biosynthèse du NAD (nicotinamide adénine dinucléotide), la nicotinamide phosphoribosyltransférase (ou Nampt), dans le contrôle des réponses immunes inflammatoires. L’étude de cette protéine pourrait conduire à une meilleure compréhension des liens fonctionnels récemment établis entre métabolisme et inflammation. |
La Nampt/PBEF/visfatine, une protéine aux multiples fonctions Fait plutôt rare dans la brève histoire du décryptage fonctionnel de notre génome, la Nampt a été identifiée de manière indépendante par trois équipes de chercheurs qui lui ont attribué trois fonctions distinctes. Tout d’abord décrite en 1994 comme une cytokine sécrétée par les cellules du système immunitaire, cette protéine, dénommée PBEF (pre-B cell colony enhancing factor) régule la croissance et la survie de cellules hématopoïétiques [
1]. Son rôle extracellulaire a été confirmé en 2005 par une équipe japonaise qui l’identifie comme une nouvelle adipokine (visfatine), une hormone produite par le tissu adipeux viscéral et impliquée dans le métabolisme du glucose [
2]. C’est en étudiant l’homologue murin de cette protéine en 2002 que notre équipe l’a formellement identifiée comme étant la nicotinamide phosphoribosyltranférase, une enzyme cytoplasmique impliquée dans la biosynthèse du NAD [
3]. La Nampt catalyse la première réaction enzymatique qui permet la biosynthèse du NAD à partir du nicotinamide, l’un des constituants de la vitamine B3 [
4]. La fonction enzymatique de cette protéine a été depuis confirmée par plusieurs groupes et la protéine est maintenant officiellement reconnue sous le nom de Nampt [
5]. |
Métabolisme et inflammation De nombreuses observations, dont les nôtres, ont confirmé l’expression élevée de la Nampt par les cellules du système immunitaire, suggérant une augmentation des besoins en NAD au cours d’une réponse inflammatoire. Afin d’identifier le rôle possible du NAD dans le contrôle d’une réponse immune, nous avons utilisé une approche pharmacologique nous permettant de moduler le taux intracellulaire en NAD [
6,
7]. Ces expériences nous ont permis d’établir une forte corrélation entre le taux de NAD intracellulaire et la capacité de production de cytokines proinflammatoires. La réduction du taux intracellulaire de NAD, obtenue grâce à un puissant inhibiteur de la Nampt (APO866, également connu sous le nom de FK866), conduit à une diminution importante du taux des cytokines IL(interleukine)-1β, IL-6 et TNF (tumor necrosis factor). De manière remarquable, l’injection de APO866 inhibe une réaction inflammatoire in vivo, comme on l’observe dans des modèles animaux d’arthrite rhumatoïde ou de péritonite aiguë [6]. Il faut souligner que le contrôle exercé par la Nampt sur la production d’une cytokine comme le TNF apparaît spécifique, puisque la production d’autres médiateurs inflammatoires (comme la chimiokine RANTES, regulated upon activation, normal T cell expressed and secreted) n’est pas affectée par les taux intracellulaires de NAD [7]. Outre le rôle bien connu du NAD comme coenzyme intervenant dans de nombreuses réactions d’oxydoréduction, ce dinucléotide constitue également un substrat pour plusieurs familles d’enzymes. Parmi ces protéines, les sirtuines sont aujourd’hui considérées comme de véritables « senseurs » de NAD intracellulaire, tant chez la levure que chez le mammifère [
8]. Les sirtuines catalysent une réaction enzymatique qui couple la dégradation d’une molécule de NAD à un événement de désacétylation. Contrairement aux désacétylases classiques de la famille des HDAC (histone deacetylase) I et II, l’activité catalytique des sirtuines requiert donc un taux adéquat de NAD intracellulaire. L’étude approfondie de la production de TNF, l’une des principales cytokines produites par les macrophages activés et une cible privilégiée de nombreux agents anti-inflammatoires, a largement confirmé le rôle des sirtuines dans le contrôle d’une réponse immune. En effet, par des approches pharmacologiques et de génétique moléculaire, nous avons pu démontrer qu’une sirtuine, SIRT6, régule la production de TNF dans les cellules immunes. De manière inattendue, ce contrôle s’opère au niveau post-transcriptionnel, probablement en régulant l’efficacité de traduction de l’ARNm du TNF en protéine [7]. |
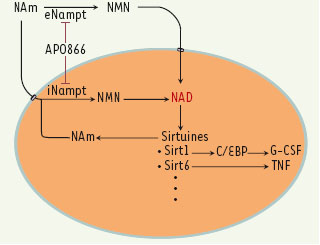
NAD, sirtuines et inflammation : une nouvelle piste pour de nouvelles thérapies anti-inflammatoires ? Plusieurs auteurs ont aujourd’hui démontré le lien fonctionnel qui existe entre le niveau d’expression de la Nampt, le taux du NAD intracellulaire et l’activité des sirtuines [8]. Outre nos propres travaux sur SIRT6, de nombreuses expériences ont souligné le rôle important de SIRT1, le membre le plus étudié de la famille des sirtuines, dans le contrôle de l’expression de plusieurs gènes cellulaires. SIRT1 semble exercer son activité de régulation en contrôlant le niveau d’acétylation de facteurs de transcription. Une étude récente a par exemple démontré le rôle important de la Nampt, du NAD et de SIRT1 dans le contrôle de l’activité des facteurs de transcription de la famille C/EBP (CAAT enhancing binding protein). Ces protéines régulent positivement la production de facteurs de croissance comme le G-CSF (granulocyte colony-stimulating factor), et une activité accrue de SIRT1, soutenue par une concentration élevée en Nampt et NAD, favorise par exemple la granulopoïèse in vivo [
9]. La Nampt posséderait donc des fonctions à la fois intracellulaires et extracellulaires susceptibles d’exercer un contrôle positif sur la réponse inflammatoire. Sous sa forme extracellulaire, la Nampt augmente le nombre et/ou la survie de cellules immunes et induit la synthèse de cytokines pro-inflammatoires. Au niveau intracellulaire, cette protéine contribue à la biosynthèse du NAD, permettant une meilleure activité des enzymes de la famille des sirtuines. Récemment, S. Imai et ses collaborateurs ont proposé une nouvelle explication permettant de réconcilier une grande partie des observations publiées à ce jour [
10] (Figure 1). Bien que le mécanisme de sécrétion de la Nampt ne soit pas encore élucidé, ces auteurs suggèrent que la Nampt existe bien sous deux formes : une forme intracellulaire (iNampt) et une forme sécrétée (eNampt). Sous sa forme sécrétée, la eNampt permet la conversion du nicotinamide en NMN (nicotinamide mononucléotide) dans le milieu extracellulaire. Ce métabolite peut alors servir de précurseur et permettre aux cellules exprimant de faibles taux de iNampt d’accumuler du NAD. Indépendamment de sa localisation donc, la Nampt permettrait le maintien d’un taux élevé de NAD, indispensable à l’activité d’un ou plusieurs membre(s) de la famille des sirtuines. Les cellules capables de sécréter l’eNampt pourraient influencer les taux de NAD des cellules voisines et promouvoir la production soutenue de TNF. Bien que ces observations suggèrent un nouveau mode de dialogue entre cellules inflammatoires et tissus impliqués dans le métabolisme, la très grande diversité des substrats des sirtuines ne permet pas à ce jour de prédire avec certitude les effets biologiques d’une diminution du taux de NAD dans les tissus sains. Les nombreuses observations décrivant un lien fonctionnel entre métabolisme du NAD et contrôle de la réponse immune semblent cependant constituer de nouvelles pistes thérapeutiques pour le contrôle des pathologies inflammatoires.  | Figure 1
Interactions et fonctions principales des formes extracellulaire et intracellulaire de Nampt. Nampt : nicotinamide phosphoribosyltransférase ; NAD : nicotinamide adénine dinucléotide ; NMN : nicotinamide mononucléotide ; C/EBP : CAAT enhancing binding protein ; G-CSF : granulocyte colony-stimulating factor ; TNF : tumor necrosis factor. |
|
1. Samal B, Sun Y, Stearns G, et al. Cloning and characterization of the cDNA encoding a novel human pre-B-cell colony-enhancing factor. Mol Cell Biol 1994; 14 : 1431–7. 2. Sommer G, Garten A, Petzold S, et al. Visfatin/PBEF/Nampt: structure, regulation and potential function of a novel adipokine. Clin Sci (Lond) 2008; 115 : 13–23. 3. Rongvaux A, Shea RJ, Mulks MH, et al. Pre-B-cell colony-enhancing factor, whose expression is upregulated in activated lymphocytes, is a nicotinamide phosphoribosyltransferase, a cytosolic enzyme involved in NAD biosynthesis. Eur J Immunol 2002; 32 : 3225–34. 4. Rongvaux A, Andris F, Van Gool F, Leo O. Reconstructing eukaryotic NAD metabolism. Bioessays 2003; 25 : 683–90. 5. Imai S. Nicotinamide phosphoribosyltransferase (Nampt): a link between NAD biology, metabolism, and diseases. Curr Pharm Des 2009; 15 : 20–8. 6. Busso N, Karababa M, Nobile M, et al. Pharmacological inhibition of nicotinamide phosphoribosyltransferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD. PLoS One2008; 3 : e2267. 7. Van Gool F, Gallí M, Gueydan C, et al. Intracellular NAD levels regulate tumor necrosis factor protein synthesis in a sirtuin-dependent manner. Nat Med 2009; 15 : 206–10. 8. Taylor DM, Maxwell MM, Luthi-Carter R, Kazantsev AG. Biological and potential therapeutic roles of sirtuin deacetylases. Cell Mol Life Sci 2008; 65 : 4000–18. 9. Skokowa J, Lan D, Thakur BK, et al. NAMPT is essential for the G-CSF-induced myeloid differentiation via a NAD+-sirtuin-1-dependent pathway. Nat Med 2009; 15 : 151–8. 10. Revollo JR, Körner A, Mills KF, et al. Nampt/PBEF/Visfatin regulates insulin secretion in beta cells as a systemic NAD biosynthetic enzyme. Cell Metab 2007; 6 : 363–75. |