| |
| Med Sci (Paris). 2009 June; 25(6-7): 559–562. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7559.Rencontre avec un pathogène : les cellules natural killer se souviennent-elles ? Nadège Bercovici* and Anne Caignard* Institut Cochin, Université Paris Descartes, CNRS (UMR 8104), Inserm U567, 27, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Lymphocytes B, Cytokines, Humains, Mémoire immunologique, Cellules tueuses naturelles, Récepteurs aux antigènes des cellules T, Lymphocytes T, Maladies virales |
Rencontre avec un pathogène : rôle connu des cellules NK et des cellules T Classiquement, les cellules natural killer (NK) sont des cellules de l’immunité naturelle. Ces cellules portent des récepteurs qui reconnaissent des ligands fortement exprimés par des cellules infectées par des virus ou des bactéries ou par des cellules transformées. Elles acquièrent ces récepteurs et la capacité de tuer très tôt au cours de leur différenciation dans la moelle osseuse. Ainsi, les cellules NK « matures » circulantes sont prêtes à éliminer des cellules infectées et peuvent rapidement être mobilisées lors d’une inflammation. Elles constituent une première ligne de défense et facilitent la mise en place d’une réponse immune dite « adaptative », plus longue à se mettre en place et qui fait intervenir des lymphocytes T et B. Les lymphocytes T notamment portent un récepteur à l’antigène (TCR, T cell receptor), dont la spécificité de reconnaissance de l’antigène est unique à chaque lymphocyte, qui leur permet de s’activer sélectivement au contact d’une cellule exprimant un antigène donné. Á la différence d’une cellule NK, ces lymphocytes T naïfs ne sont pas armés naturellement pour détruire une cellule infectée mais ils s’activent et se différencient lors de la première infection. Une caractéristique majeure de cette réponse adaptative est la persistance de lymphocytes mémoires après la résolution de l’infection. Ces lymphocytes mémoires sont capables de répondre plus rapidement et plus efficacement lors d’une réponse secondaire, ce qui constitue la mémoire immunologique [
1].  | Figure 1.
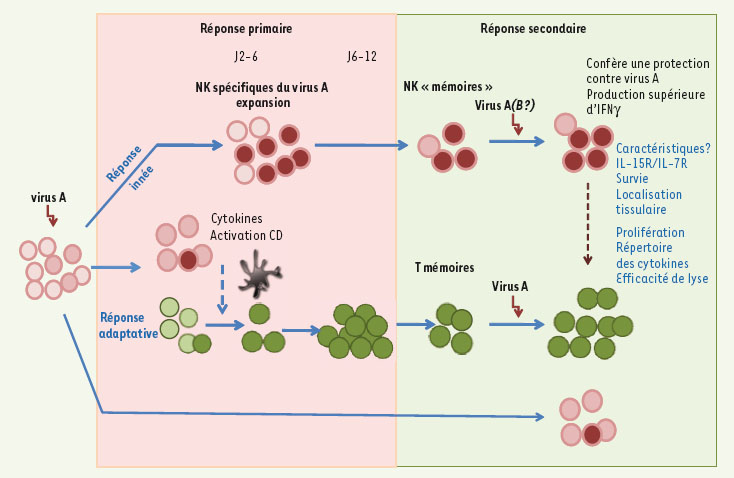
Réponse T et NK au cours d’une réponse antivirale. La réponse immune antivirale mobilise rapidement les cellules natural killer (NK) (en rose), des effecteurs de l’immunité naturellement armés pour lyser les cellules infectées. Ces cellules NK facilitent l’induction de la réponse immune adaptative qui implique l’activation et l’expansion de lymphocytes T spécifiques (en vert). Lorsque l’infection est résorbée, des lymphocytes T mémoires persistent et sont rapidement activés lors d’une réponse secondaire contre le même pathogène. Des données récentes indiquent que des cellules NK ayant été activées lors de la primo-infection pourraient persister in vivo, notamment au niveau du site de l’infection et présenter certaines des propriétés propres aux lymphocytes T mémoires. |
Or, des résultats récents obtenus par le groupe de L. Lanier et publiés dans Nature [
2] suggèrent que les cellules NK seraient dotées d’une mémoire immunologique. Dans les souris C57BL/6, 50 % des cellules NK expriment le récepteur Ly49H, qui reconnaît spécifiquement la protéine (m157) du cytomégalovirus murin (MCMV) [
3]. Sun et al. ont réduit expérimentalement le nombre initial de ces cellules NK Ly49H et montrent que ces cellules sont capables de se multiplier activement dans le foie en réponse au CMV murin (environ 1 000 fois) mimant ainsi l’amplitude des expansions observées pour des lymphocytes T spécifiques. Quand l’infection est résorbée, le nombre de cellules NK Ly49H+ s’est effondré mais une fraction de cellules Ly49H+ survit plusieurs mois dans le foie et dans la rate. Les NK Ly49H+ qui persistent sont plus activées et exercent des fonctions supérieures par rapport à des cellules NK de souris non infectées. Le transfert adoptif de ces cellules est capable de prévenir une infection par le CMV chez des souriceaux nouveau-nés. Par analogie avec la réponse immune des cellules T, les auteurs décrivent ces cellules comme des cellules NK « mémoires ». En se plaçant après la résolution d’une première infection et dans un système où les NK peuvent reconnaître directement une protéine virale, Sun et al. posent plus ouvertement la question du potentiel d’adaptation de la réponse immune des cellules NK. |
Des cellules NK qui persistent après une première infection… Plusieurs études antérieures avaient montré une expansion suivie d’une contraction sélective des cellules NK matures engagées dans la réponse à l’infection MCMV [3–
5] ou lors d’une stimulation par des haptènes [
6]. L’expansion des cellules NK peut avoir deux origines : elle est induite en réponse à un environnement cytokinique puis à la reconnaissance spécifique du pathogène [3,
7]. Ces études ont mis en évidence une expansion importante de NK spécifiques du pathogène au site d’infection. Des cellules plus activées persistaient quelques semaines alors que l’infection était progressivement résolue. Dans le cas des cellules T, les clones spécifiques d’un antigène correspondent à des petits nombres de cellules [
8] capables de se multiplier d’une façon très importante en réponse à une infection. Sun et al. ont réduit expérimentalement la fréquence initiale des NK LY49H pour mettre en évidence l’expansion de NK spécifiques du MCMV. Dans ces conditions expérimentales, les cellules NK LY49H qui persistent après l’infection protègent plus efficacement d’une réinfection par le MCMV que des NK « inexpérimentées ». On peut se demander si cette meilleure protection serait également observée dans des conditions plus physiologiques où les NK Ly49H+ sont présentes en nombre plus important et répondent à l’infection par une expansion beaucoup plus modeste (3-10 fois) [3]. Dans le cas des cellules T par exemple, le nombre de cellules mémoires est généralement proportionnel au pic d’expansion pendant la primo-infection et surtout, la génération de cellules T CD8 mémoires est perturbée si la fréquence initiale de CD8 naïfs est trop élevée [
9]. Ainsi, il serait intéressant d’étendre ces observations à d’autres systèmes expérimentaux où la fréquence des sous-populations NK qui peuvent reconnaître des antigènes dérivés du pathogène est variable. Sun et al. montrent que les NK LY49H+ qui persistent dans la rate après l’infection par MCMV prolifèrent de façon similaire aux NK de souris naïves. C’est là une différence importante avec les cellules T mémoires qui sont connues pour se multiplier plus rapidement lors d’un second contact avec un agent infectieux (réponse secondaire). On peut concevoir qu’une prolifération active ne soit pas indispensable pour des NK LY49H présentes en grand nombre dans le compartiment NK, à la différence des cellules T mémoires dont l’expansion plus rapide en réponse secondaire est décisive pour augmenter efficacement la fréquence des rares clones T spécifiques d’un antigène. En revanche, la capacité de cellules T mémoires à se multiplier rapidement est le reflet de propriétés fonctionnelles particulières à ces cellules, et en ce sens, la caractérisation des NK qui persistent après une infection MCMV mériterait d’être davantage documentée. La persistance de cellules mémoires CD8 est associée à leur sensibilité à l’IL (interleukine)-15 et à l’IL-7. Il serait intéressant de déterminer par exemple si le phénotype des cellules NK Ly49H+ persistantes est plutôt celui de cellules T mémoires (exprimant la chaîne α du récepteur de l’IL-7, IL7Rα, et de l’IL-15, IL15Rα) ou effectrices (IL7Rα-) [
10]. La phase d’expansion des lymphocytes T lors d’une primo-infection est étroitement associée à l’émergence de lymphocytes différenciés en cellules effectrices et mémoires. En particulier, les cellules CD8 mémoires produisent davantage de cytokines et leur niveau de production d’IFNγ reflète leur capacité à produire plusieurs cytokines [
11] et à protéger contre une seconde infection. Dans l’article de Sun et al., les NK Ly49H+ qui persistent plusieurs mois après l’infection expriment des niveaux plus élevés d’IFNγ que les NK de souris non infectées. Comme les cellules NK sont naturellement « armées », il pourrait s’agir d’un état d’activation supérieur plutôt que de l’acquisition de propriétés fonctionnelles différentes. L’étude plus complète du profil cytokinique de NK persistantes au site d’infection permettrait de préciser le potentiel de ces cellules par rapport aux NK de souris non infectées. |
Les NK gardent-elles une mémoire ou une empreinte d’une primo-infection ? La mémoire attribuée à l’immunité adaptative reste avant tout définie comme la capacité de répondre vite et mieux à un agent infectieux que l’organisme a déjà contracté, impliquant la notion de spécificité de reconnaissance. La réactivité plus forte des NK « mémoires » dans le modèle de Sun et al. est observée après une stimulation in vitro par le récepteur NK1.1, donc indépendante de l’antigène (ligand de LY49H). Le groupe de U. von Adrian [5] suggère cependant que les NK qui persistent in situ pourraient être sensibilisées avec une certaine spécificité chez des souris déficientes en cellules T et B. D’autres études seront donc nécessaires pour préciser le degré de spécificité de cette sensibilisation des cellules NK. L’ensemble de ces données indique qu’une première stimulation des cellules NK (spécifique ou non) laisse une « trace » (activation de certaines voies de signalisation) et de telles cellules persistent in vivo et sont capables de répondre plus fortement lors d’une stimulation ultérieure même tardive : les cellules NK semblent garder une empreinte de l’activation mais ne pas se souvenir du pathogène précis. On peut aussi s’interroger sur la durée de cette « trace ». La mémoire T et B persiste plusieurs dizaines d’années, même chez des hôtes qui contractent plusieurs infections. Rien ne permet encore d’étayer une telle propriété pour les cellules NK. En revanche, ces cellules NK sensibilisées lors de la première infection persistent au niveau du site d’infection (dans le foie). C’est peut-être cette localisation tissulaire et cet environnement particulier qui leur confèrent un avantage par rapport à des NK naïves et les rapprochent des lymphocytes T effecteurs mémoires. Ces résultats font écho aux données récentes de la littérature qui mettent en évidence des sous-populations diverses de NK dans les organes lymphoïdes secondaires et les tissus. Ainsi, la rétention de cellules NK au niveau du site de l’infection après élimination du pathogène pourrait refléter une certaine adaptation de la réponse des NK aux agents infectieux déjà contractés par un organisme. Les travaux de Sun et al. soulèvent donc de nouvelles questions quant au rôle potentiel de cellules NK persistantes après une première infection. D’autres études permettront de mieux comprendre comment s’articule cette sensibilisation du compartiment NK avec la réponse immune des cellules T et B. |
1. Harty JT, Badovinac VP. Shaping and reshaping CD8+ T-cell memory. Nat Rev Immunol 2008; 8 : 107–19. 2. Sun JC, Beilke JN, Lanier LL. Adaptive immune features of natural killer cells. Nature 2009; 457 : 557–61. 3. Dokun AO, Kim S, Smith HR, et al. Specific and nonspecific NK cell activation during virus infection. Nat Immunol 2001; 2 : 951–6. 4. Robbins SH, Tessmer MS, Mikayama T, Brossay L. Expansion and contraction of the NK cell compartment in response to murine cytomegalovirus infection. J Immunol 2004; 173 : 259–66. 5. Bekiaris V, Timoshenko O, Hou TZ, et al. Ly49H+ NK cells migrate to and protect splenic white pulp stroma from murine cytomegalovirus infection. J Immunol 2008; 180 : 6768–76. 6. O’Leary JG, Goodarzi M, Drayton DL, von Andrian UH. T cell- and B cell-independent adaptive immunity mediated by natural killer cells. Nat Immunol 2006; 7 : 507–16. 7. Cooper MA, Elliott JM, Keyel PA, et al. Cytokine-induced memory-like natural killer cells. Proc Natl Acad Sci USA 2009; 106 : 1915–9. 8. Arstila TP, Casrouge A, Baron V, et al. Diversity of human alpha beta T cell receptors. Science 2000; 288 : 1135. 9. Badovinac VP, Haring JS, Harty JT. Initial T cell receptor transgenic cell precursor frequency dictates critical aspects of the CD8+ T cell response to infection. Immunity 2007; 26 : 827–41. 10. Kaech SM, Tan JT, Wherry EJ, et al. Selective expression of the interleukin 7 receptor identifies effector CD8 T cells that give rise to long-lived memory cells. Nat Immunol 2003; 4 : 1191–8. 11. Almeida JR, Price DA, Papagno L, et al. Superior control of HIV-1 replication by CD8+ T cells is reflected by their avidity, polyfunctionality, and clonal turnover. J Exp Med 2007; 204 : 2473–85. |