| |
| Med Sci (Paris). 2009 June; 25(6-7): 633–636. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7633.La cartographie antigénique : un nouvel outil pour la santé publique Catherine Mary* 56G rue de Margnolles, 69300 Caluire, France MeSH keywords: Antigènes viraux, Hémagglutinines virales, Humains, Sous-type H3N2 du virus de la grippe A, Grippe humaine, Orthomyxoviridae, Protéines virales |
Chaque année, l’Organisation mondiale de la santé (OMS) actualise ses recommandations pour la composition du vaccin contre la grippe saisonnière. Un processus d’expertise éprouvé depuis plus de 60 ans s’engage alors, dont le but est d’analyser les variations des virus grippaux en circulation. Récemment, un outil d’un nouveau genre est venu enrichir l’arsenal des outils déjà couramment utilisés pour cette analyse : la cartographie antigénique. Le virus grippal ne cesse d’évoluer et si le vaccin grippal n’était pas régulièrement mis à jour, il perdrait peu à peu de son efficacité. Au cœur du mécanisme de persistance du virus, se trouvent en effet les variations progressives de sa protéine de surface, l’hémagglutinine (HA). Ce mécanisme de variation connu sous le nom de « glissement antigénique » permet au virus d’échapper à l’immunité des populations. Pour surveiller cette évolution, l’OMS s’est dotée, dès 1952, d’un Réseau mondial de surveillance de la grippe. Tout au long de l’année, les 126 Centres nationaux de référence dont ce Réseau est aujourd’hui constitué, traquent les variations des virus en circulation. Ils utilisent pour cela un essai de référence : le test d’inhibition de l’hémagglutination (HI). Plus deux souches virales sont « antigéniquement distantes », moins les anticorps dirigés contre l’une sont efficaces contre l’autre. On mesure ainsi des titres HI, dont les valeurs sont rassemblées dans des tables de distances antigéniques dites « tables HI », comparables aux tables kilométriques des atlas routiers. Il est aussi difficile de se représenter ces distances à partir de ces tables qu’il le serait de se représenter la carte de France sur la seule base des tables kilométriques. C’est pour pallier cette limite que la cartographie antigénique a vu le jour [
1]. |
Visualisation des distances antigéniques Lorsqu’en 1998 le virologiste Ron Fouchier intègre le centre néerlandais sur la grippe à l’Erasmus Medical Center de Rotterdam (Pays-Bas), il se heurte vite à l’opacité des tables HI. « J’ai commencé à chercher une méthode quantitative d’interprétation de ces tables, explique t-il. Une telle quantité de données s’y était accumulée depuis les années 1940 qu’elles offraient aussi une occasion unique pour étudier l’évolution du virus grippal ». Il entre en contact avec Alan Lapedes, un mathématicien du Laboratoire national Los Alamos (Nouveau-Mexique) aux États-Unis, puis avec un autre mathématicien, Derek Smith du Santa Fe Institute. Ensemble, ils reprennent les travaux qu’ils avaient déjà initiés indépendamment les uns des autres. L’idée ? Élaborer une méthode de visualisation des tables HI, de la même manière que les arbres philogénétiques permettent de visualiser les données du séquençage génétique. Durant quatre années, plusieurs méthodes sont évaluées. « Nous sentions que ces tables pouvaient être représentées sous forme de cartes, raconte Derek Smith. Mais la difficulté résidait dans la validation de cette représentation ». En 2003, les scientifiques finissent par identifier la méthode fiable qu’ils recherchaient : ils placent sur une même carte environ 300 souches de virus grippaux à partir de données de tables HI incomplètes. Les titres HI manquants sont ensuite mesurés : ils correspondent aux distances relevées sur la carte. |
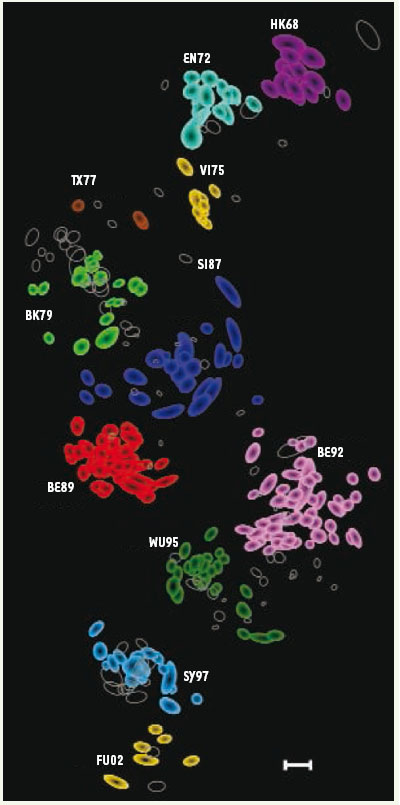
Les virus grippaux : un archipel En 2004, la cartographie antigénique des souches du virus grippal influenza A(H3N2) en circulation depuis 1968 est publiée dans la revue Science (Figure 1) [
2]. Sur la carte, les souches se regroupent (clusters) selon une configuration évocatrice d’archipels. On y visualise au premier coup d’œil les distances entre les souches, avec une définition supérieure à celle des tables (Figure 1). Le travail intéresse suffisamment l’OMS pour que la cartographie antigénique s’intègre au processus d’analyse des virus grippaux comme un outil supplémentaire. « Elle permet de visualiser une grande quantité de données par une image très simple » commente Ian Barr, directeur du Centre collaborateur de l’OMS de référence et de recherche sur la grippe situé à Melbourne (Australie). Elle sert aussi de support pour justifier le choix du comité auprès des producteurs de vaccins ou des responsables des centres nationaux de référence. « Les cartes sont une valeur ajoutée. Elles permettent de mieux représenter les différences » ajoute Bruno Lina, du Centre français de la grippe pour la zone sud, situé à Lyon.  | Figure 1.
Cartographie antigénique des virus influenza A isolés entre 1968 et 2003. Chaque souche virale est représentée par un cercle. Elles se groupent en clusters de couleur différente. L’échelle correspond à une unité antigénique et permet de mesurer la distance entre les souches (© Science 2008 [ 1]). |
|
Un film sur l’évolution des virus En 2005, Derek Smith reçoit le prix « NIH’s Director Pioneer Award » du National Institutes of Health (NIH), soit une somme de 2,5 millions de dollars pour développer librement son travail. Il recrute de nouveaux collaborateurs au sein de son groupe à l’université de Cambridge (Royaume-Uni) parmi lesquels l’épidémiologiste Colin Russel. Ensemble et avec l’équipe de Ron Fouchier, ils entreprennent d’étudier de manière combinée les changements épidémiologiques du virus de la grippe et son évolution. « L’OMS s’est intéressée bien avant nous à la circulation globale du virus, précise Derek Smith. La question peut être aussi bien abordée du point de vue de la santé publique que de la recherche fondamentale ». Dans le même temps, Eugene Skepner, un informaticien du groupe, développe un système d’échange et de centralisation des données HI qui permet de les cartographier à mesure qu’elles sont produites par les centres de référence du réseau de l’OMS. « La cartographie est aussi une méthode d’unification, explique Ron Fouchier, c’est comme si on filmait l’évolution des virus. » Fruit de ce travail collaboratif, l’analyse par cartographie de plus de 13 000 souches de virus grippaux collectées à travers le monde est publiée dans Science en 2008 [1,
3]. Les résultats révèlent que, chaque année, les épidémies de grippe saisonnière sont dues à des virus essaimés depuis une source extérieure, en l’occurrence l’Asie du Sud-Est. La surveillance des virus dans cette région du monde est donc cruciale pour la prédiction des virus épidémiques. |
Le grippe est loin d’être le seul champ d’application de la cartographie antigénique. « On peut l’appliquer à n’importe quel pathogène, dès lors que l’on peut quantifier une relation d’affinité entre un ligand et un récepteur », précise Ron Fouchier. Dans le cas du virus rabique, la cartographie a permis de montrer qu’un variant, récemment isolé chez la chauve-souris en Europe, n’était pas couvert par le vaccin. « C’est un outil puissant de lutte contre les maladies infectieuses » commente Antony Fooks, du laboratoire britannique de référence sur la rage pour l’OMS et l’OIE (Office international des épizooties). « Si jamais ce variant s’adaptait à des mammifères terrestres tels que le renard ou le chien, on sait qu’il faudra l’intégrer à la composition du vaccin ». Un projet coordonné par l’OMS vise aussi à utiliser la cartographie pour sélectionner des anticorps produits chez la plante ou chez l’animal pour pallier la pénurie d’immunoglobulines humaines dans le traitement prophylactique contre la rage. D’autres projets ont été initiés avec le VIH, l’entérovirus EV71 ou le paludisme. La prochaine étape consistera à accroître les capacités de la cartographie et ses applications. « Pour l’instant, nous avons plus de demandes que nous ne pouvons en traiter » explique Derek Smith. Dans quelques temps, le logiciel pourra être téléchargé librement en open source, sous une licence GPL (general public license), et deviendra ainsi accessible à tous ceux qui souhaitent l’utiliser. |
1. Enserink M. Mapmaker for the world of influenza. Science 2008;320 : 310–1. 2. Derek J, Smith Lapedes AS, de Jong JC, et al. Mapping the antigenic and genetic evolution of influenza virus. Science 2004; 305 : 371–6. 3. Russell CA, Jones TC, Barr IG, et al. The global circulation of seasonal influenza A (H3N2) viruses. Science 2008; 320 : 340–6. |