| |
| Med Sci (Paris). 2009 December; 25(12): 1046–1052. Published online 2009 December 15. doi: 10.1051/medsci/200925121046.Les immunoconjugués, anticorps « armés » pour combattre le cancer Jean-François Haeuw,* Véronique Caussanel, and Alain Beck Centre d’immunologie Pierre Fabre, 5, avenue Napoléon III, BP 60497, 74160 Saint-Julien-en-Genevois, France |
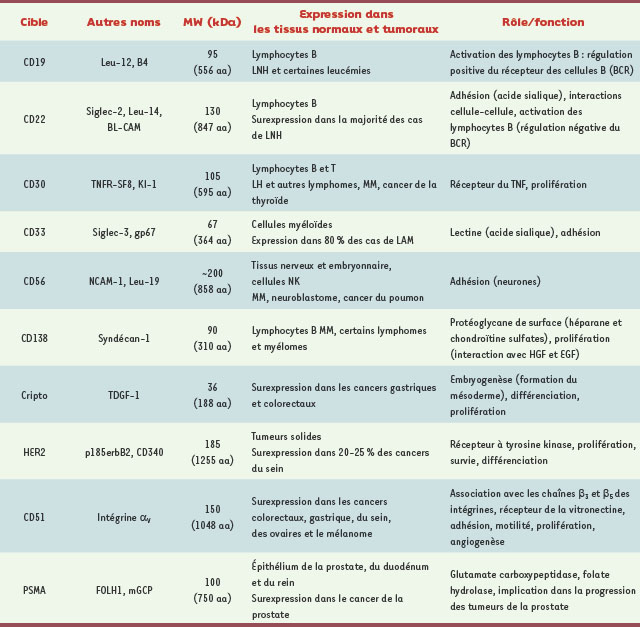
Les anticorps armés d’une drogue de chimiothérapie (antibody-drug conjugates ou ADC en anglais) composent, avec les radio-immunoconjugués et les immunotoxines, la classe d’agents thérapeutiques très prometteuse des immunoconjugués [
1,
2] (→). Dans les trois cas, l’objectif est identique : il s’agit d’utiliser la spécificité d’un anticorps pour cibler la cellule tumorale et libérer à l’intérieur ou à proximité de celle-ci, un composé hautement toxique qui lui est couplé, comme un agent cytotoxique, un agent radioactif ou une toxine (Figure 1). Si les premiers essais chez l’animal dans le domaine du cancer datent de la fin des années 1950, l’unique immunoconjugué de type ADC disponible sur le marché, gemtuzumab ozogamicin (GO), a obtenu un premier enregistrement aux États-Unis dès 2000 (Tableau I). Entre ces deux dates, et notamment à partir de la découverte des anticorps monoclonaux (Acm) en 1975, de nombreux immunoconjugués qui utilisent des drogues appartenant aux grandes classes d’agents cytotoxiques (inhibiteurs de polymérisation de la tubuline, agents alkylants, intercalants, etc.) ont été décrits et certains ont été évalués chez l’homme, malheureusement sans succès. À titre d’exemple, on peut citer un essai clinique de phase II dans le cancer du sein métastatique avec un immunoconjugué BR96-doxorubicine ciblant l’antigène Ley ; il démontra un manque d’efficacité du conjugué par rapport à la doxorubicine seule et une forte toxicité gastro-intestinale due à l’expression de l’antigène Ley par certains tissus sains [
3]. Les échecs de ces immunoconjugués de première génération étaient principalement liés à l’instabilité du conjugué, à l’absence de libération de la drogue dans la cellule ou à la libération d’une forme inactive, ainsi qu’à la faible efficacité des agents cytostatiques utilisés nécessitant le couplage d’un nombre trop important de molécules par anticorps. Depuis le début des années 2000, l’utilisation de composés 100 à 1 000 fois plus toxiques que ceux testés précédemment et l’optimisation des méthodes de conjugaison et des agents de liaison ont permis d’élaborer des immunoconjugués de seconde génération beaucoup plus stables et efficaces [
4,
5] dont certains sont actuellement à des stades très avancés de développement clinique pour le traitement non seulement des tumeurs solides mais aussi des lymphomes ou des leucémies (Tableau I). 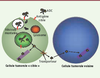 | Figure 1.
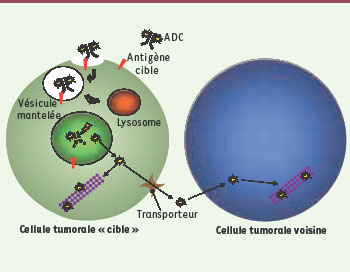
Mécanisme d’action des immunoconjugués de type ADC. Après fixation sur son antigène cible à la surface de la cellule, l’immunoconjugué est internalisé par un mécanisme d’endocytose. La fusion des vésicules avec les lysosomes permet ensuite la dégradation de l’immunoconjugué et la libération à l’intérieur de la cellule de l’agent cytotoxique couplé. Certains composés peuvent agir sur les cellules voisines après transport ou diffusion à travers la membrane plasmique. |
 | Tableau I.
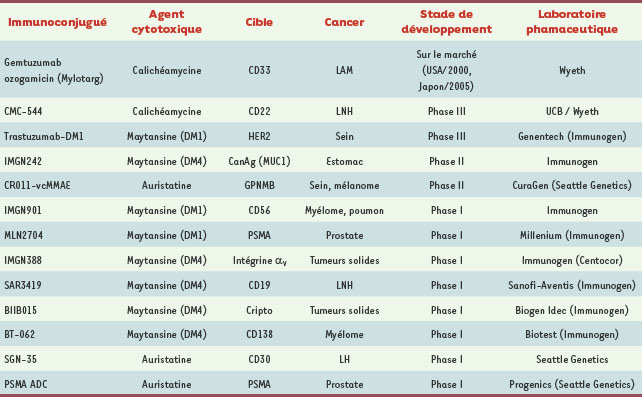
Les immunoconjugués disponibles sur le marché et en développement clinique. LAM : leucémie aiguë myéloïde ; LNH : lymphome non hodgkinien ; LH : lymphome hodgkinien ; PSMA : prostate specific membrane antigen ; GPNMB : glycoprotein (transmembrane) NMB. Sources : Pharmaproject, PubMed, www.clinicaltrials.gov, sites internet des sociétés pharmaceutiques citées. |
(→) voir J. Barbet et al., p. 1039
|
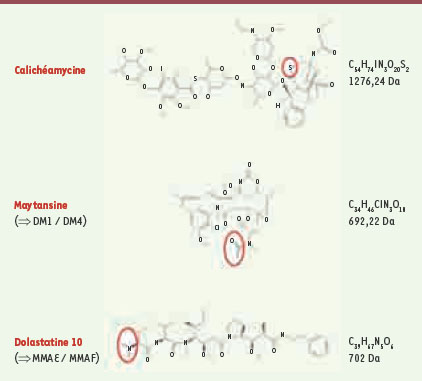
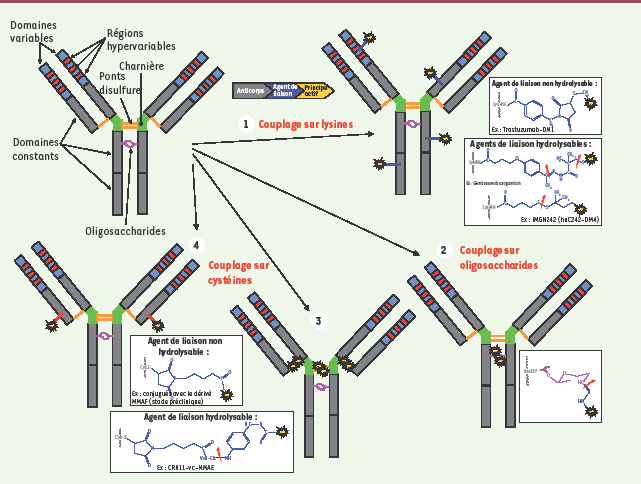
Un seul immunoconjugué sur le marché depuis 2000… Gemtuzumab ozogamicin (Mylotarg®) est enregistré aux États-Unis (2000) et au Japon (2005), mais pas en Europe, pour le traitement des leucémies aiguës myéloïdes (LAM) en rechute chez les personnes âgées de plus de 60 ans [
6,
7]. La LAM est une maladie hématologique maligne qui représente 80 % des leucémies aiguës et se caractérise par une prolifération de cellules myéloïdes blastiques. L’incidence des LAM est de 3,5 cas pour 100 000 individus dans les pays développés, et elle augmente avec l’âge. Gentuzumab Ozogamicin (GO) est constitué d’un anticorps humanisé (IgG4) anti-CD33 (CD33 est exprimé dans 90 % des cas de LAM) (Tableau II) qui est couplé avec un dérivé semi-synthétique de la calichéamycine γ (Tableau I, Figure 2), antibiotique puissant de la classe des ènediynes qui se fixe à la double hélice d’ADN et provoque sa cassure. Un dérivé hydrazide est couplé sur les résidus lysine de l’anticorps (Figure 3) à l’aide d’un agent de liaison bifonctionnel, l’acide 4-(4-acétylphénoxy)butanoïque. Le conjugué obtenu est stable dans les conditions physiologiques et comporte en fait deux liaisons permettant la libération de la calichéamycine après internalisation : une liaison hydrazone labile à pH acide (dans les lysosomes) et un pont disulfure (Figure 3). GO est en fait constitué d’un mélange d’anticorps nus (50 %) et comportant 4 à 6 moles de calichéamycine par mole d’anticorps (50 %). Plusieurs études cliniques ont permis de définir la dose maximale tolérée, 9 mg/m2 et le schéma d’administration, consistant en deux administrations par voie intraveineuse à 14 jours d’intervalle. Ces études ont montré un taux de réponse globale de 30 % avec une médiane de survie sans récidive de 6,8 mois pour l’ensemble des patients répondeurs [7]. Les effets secondaires de grades 3 ou 4 durant la période de traitement sont la neutropénie (97 %), la thrombocytopénie (99 %) et l’anémie (47 %). Les toxicités les plus problématiques demeurent l’hépatotoxicité et la maladie veino-occlusive du foie qui, bien qu’étant transitoires, touchent particulièrement les patients qui reçoivent une greffe de cellules souches hématopoïétiques. Le profil de toxicité observé est toutefois différent de celui de la chimiothérapie conventionnelle car il n’y a ni alopécie ni cardiotoxicité. La résistance au traitement a pu être corrélée, chez certains patients, à une activité supérieure de la P-glycoprotéine, transporteur membranaire responsable du rejet de la calichéamycine libérée dans la cellule, et à une expression plus faible de CD33 dans les blastes [
8]. GO a aussi fait l’objet d’évaluations cliniques pour le traitement de la LAM chez l’enfant et de la leucémie aiguë promyélocytaire, une forme particulière de LAM.  | Figure 2.
Principaux agents cytotoxiques utilisés pour la synthèse des immunoconjugués de type ADC (antibody drug conjugate). Les sites utilisés pour la liaison à l’anticorps sont entourés en rouge. |
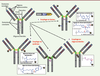 | Figure 3.
Les différentes méthodes de couplage utilisées pour la synthèse des immunoconjugués. 1. Couplage sur les résidus lysine de l’anticorps. C’est la méthode utilisée pour gemtuzumab ozogamicin (Mylotarg), seul immunoconjugué disponible sur le marché à l’heure actuelle, ou pour coupler les dérivés de la maytansine. 2. Couplage sur les oligosaccharides portés par les chaînes lourdes de l’anticorps, après oxydation périodique ménagée par exemple. Cette méthode n’est plus utilisée actuellement. 3. Couplage sur les résidus cystéine de l’anticorps après réduction ménagée. Cette méthode est utilisée pour les dérivés de l’auristatine. 4. Couplage sur des résidus cystéine introduits par ingénierie moléculaire au niveau de la chaîne légère des anticorps. Cette méthode a été décrite récemment par la société pharmaceutique Genentech (Thiomabs). Pour les méthodes basées sur des agents de liaison hydrolysables, les sites d’hydrolyse sont indiqués par une flèche rouge. |
 | Tableau II.
Expression et fonction de quelques antigènes cibles d’immunoconjugués. LNH : lymphome non hodgkinien ; LH : lymphome hodgkinien ; MM : myélome multiple ; LAM : leucémie aiguë myéloïde ; NK : natural killer ; TNFR : tumor necrosis factor receptor ; NCAM-1 : neural cell adhesion molecule ; PSMA : prostate specific membrane antigen ; FOLH1 : folate hydrolase ; BCR : B cell receptor ; HGF : hepatocyte growth factor ; EGF : epidermal growth factor ; GCP : glutamate carboxypeptidase.
|
|
…Mais plusieurs immunoconjugués prometteurs actuellement en développement clinique La méthode de couplage développée pour le GO a ensuite été utilisée avec succès par la société pharmaceutique Wyeth pour générer l’immunoconjugué CMC-544 (inotuzumab ozogamicin). Celui-ci comporte un anticorps humanisé (IgG4) dirigé contre la protéine CD22 exprimée sur les lymphocytes B (Tableau II), auquel est conjugué le dérivé hydrazide de la calichéamycine décrit précédemment. CMC-544 s’est avéré très efficace dans des modèles précliniques de lymphome B [
9], et il est actuellement en phase clinique III pour le traitement des lymphomes non hodgkiniens (Tableau I). D’autres immunoconjugués qui utilisent la calichéamycine, pourtant couplée par une liaison plus stable, n’ont malheureusement pas eu le même succès. C’est le cas par exemple du CMB-401, ciblant MUC1, dont l’inefficacité dans un essai clinique de phase II dans le cancer de l’ovaire a été attribuée à la liaison amide introduite en lieu et place de la liaison hydrazone [
10]. Les sociétés Immunogen et Seattle Genetics ont récemment développé des méthodes de couplage et agents de liaison propriétaires permettant de générer des immunoconjugués qui utilisent respectivement des dérivés de la maytansine et de l’auristatine (Tableau I, Figure 2). Ces sociétés accordent maintenant des licences à d’autres sociétés pharmaceutiques pour utiliser leur technologie. La société Genentech a par exemple acquis en 2005 plusieurs licences auprès d’Immunogen afin de développer des immunoconjugués à partir de ses propres anticorps. Ainsi, l’immunoconjugué T-DM1 utilise l’anticorps humanisé anti-HER2/neu trastuzumab (herceptine) enregistré en 1998 dans le traitement du cancer du sein métastatique (Tableaux I et II). Le DM1 est un dérivé thiolé de la maytansine (Figure 2), produit naturel de structure macrocyclique qui est un agent antimitotique très puissant agissant par inhibition de la polymérisation de la tubuline. Plusieurs versions de T-DM1 ont été synthétisées et comparées chez l’animal. La version T-MCC-DM1 (Figure 3), présentant une liaison thioéther (couplage sur les résidus lysine de l’anticorps), a été sélectionnée pour une évaluation chez l’homme sur la base d’une stabilité et d’une efficacité supérieures, dans différents modèles animaux de cancer du sein, aux versions liées par pont disulfure [
11]. Cet immunoconjugué est actuellement en phase clinique II pour le traitement du cancer du sein. Un autre dérivé de la maytansine développé par Immunogen, le DM4, peut aussi être utilisé [5]. L’immunoconjugué IMGN242 ciblant l’antigène CanAg (Tableau II), initialement évalué chez l’homme avec le dérivé DM1, est actuellement en phase II avec le dérivé DM4 (Tableau I), la version incorporant le DM4 s’étant avérée beaucoup plus active [
12]. Ces deux dérivés sont en cours d’évaluation clinique et préclinique, par plusieurs autres sociétés pharmaceutiques. La société Seattle Genetics mise quant à elle sur les composés monométhyl auristatine E et F (MMAE et MMAF) qui sont des analogues synthétiques d’un pentapeptide marin naturel, la dolastatine 10 (Figure 2), autre inhibiteur puissant de la polymérisation de la tubuline. Ces dérivés sont couplés sur les résidus cystéine de l’anticorps (Figure 3) après réduction ménagée. L’introduction d’un agent de liaison de type peptidique, valine-citrulline par exemple, confère une stabilité supérieure aux liaisons hydrazone et disulfure précédemment citées [
13]. Après internalisation, ce dipeptide est hydrolysé spécifiquement par l’enzyme cathepsine B dans les lysosomes. Comme pour les dérivés de la maytansine, la société CuraGen a acquis les droits pour utiliser cette technologie et développer différents immunoconjugués, dont un avec l’anticorps CR011 dirigé contre la glycoprotéine GPNMB (glycoprotein non-metastatic melanoma protein B) exprimée spécifiquement dans différents cancers comme le cancer du sein ou le mélanome [
14]. Le conjugué correspondant, CR011-vcMMAE, est le plus avancé avec cette technologie et est actuellement testé dans des essais de phase II dans le cancer du sein et le mélanome (Tableau I). D’autres immunoconjugués qui utilisent les deux dérivés MMAE et MMAF sont aux stades clinique et préclinique. |
Quels sont les éléments essentiels à l’efficacité d’un immunoconjugué ? Outre l’agent cytotoxique, plusieurs autres éléments peuvent influencer l’activité d’un immunoconjugué de type ADC. En fait, si l’on considère que les agents cytotoxiques présentés ci-dessus possèdent, indépendamment de leur mécanisme d’action, des activités antitumorales quasi équivalentes, l’efficacité d’un ADC dépendra principalement de l’antigène cible, de la méthode de couplage de l’agent cytotoxique et de l’agent de liaison. Comme pour toutes les immunothérapies ciblées, la sélection de la cible est une étape cruciale pour élaborer un immunoconjugué de type ADC : il est maintenant admis que l’antigène cible doit présenter une expression restreinte dans les tissus normaux et que, dans le cas contraire, celui-ci doit être surexprimé dans les tissus tumoraux. De plus, bien qu’un large éventail de méthodes de couplage soit disponible, principalement sur les résidus lysine ou cystéine de l’anticorps (Figure 3), on s’aperçoit aujourd’hui que le choix de l’agent de liaison peut aussi dépendre de la « biologie » de l’antigène cible : internalisation, trafic intracellulaire, etc. [
15]. Alors que la réduction de toxicité et l’augmentation de la stabilité confèrent un avantage indéniable aux ADC basés sur des liaisons non hydrolysables, l’efficacité des ADC utilisant des agents de liaison hydrolysables dépend moins fortement de l’antigène ciblé par l’anticorps. Une étude récente a montré en effet que des ADC à liaison hydrolysable (pont disulfure) dirigés contre sept antigènes différents exprimés dans les cas de LNH étaient tous actifs in vivo dans différents modèles animaux de LNH, alors que seulement deux ADC à liaison non hydrolysable (MCC), ciblant CD22 et CD79b, deux antigènes exprimés spécifiquement par les lymphocytes B, possédaient une activité antitumorale dans les mêmes modèles [
16]. Ainsi, la capacité d’un anticorps à induire l’endocytose du complexe que forme l’ADC avec sa cible peut aussi constituer un critère essentiel de sélection. Alors que l’anticorps anti-CD20 rituximab n’induit pas l’endocytose in vitro, des immunoconjugués rituximab-vcMMAE/Dox sont efficacement internalisés par différentes lignées exprimant CD20 puis dirigés vers les lysosomes [
17]. La fixation des immunoconjugués pourrait en fait provoquer la redistribution des molécules CD20 à la surface cellulaire, et notamment leur migration des radeaux lipidiques vers les puits recouverts de clathrine. L’efficacité de la dernière génération d’ADC incorporant des liaisons stables de type peptidique (valine-citrulline) ou chimique (MCC) dépend donc de leur internalisation dans la cellule, principalement par les mécanismes d’endocytose (Figure 1). Ceux-ci peuvent être favorisés par la présence de séquences peptidiques contribuant à la migration de certaines protéines vers les puits recouverts de clathrine, comme le motif ITIM (immunoreceptor tyrosine-based inhibition motif) identifié au niveau du domaine cytoplasmique de CD22 ou CD33. D’autres protéines, telles que HER2 ou EGFR (epidermal growth factor receptor), se répartissent aléatoirement à la surface des cellules, mais se concentrent dans les puits recouverts de clathrine dès la fixation d’un anticorps. Les protéines capables de s’associer à la cible peuvent aussi limiter l’action d’un immunoconjugué. Par exemple, l’expression de CD21 inhibe l’internalisation in vitro d’anticorps anti-CD19 et par conséquent diminue fortement la cytotoxicité d’un ADC anti-CD19-DM1 [
18]. Enfin, le choix de l’agent de liaison revêt une importance capitale car celui-ci doit permettre la libération d’une forme active de l’agent cytotoxique couplé. Dans le cas des dérivés de la maytansine, la structure des composés actifs libérés a pu être déterminée : S-méthyl-DM4 ou lysine-MCC-DM1, respectivement pour des ADC à liaison hydrolysable ou non hydrolysable [5]. De plus, il s’avère que le composé S-méthyl-DM4, non chargé, peut aussi diffuser à l’extérieur de la cellule et agir sur une cellule voisine (Figure 1), alors que cette diffusion n’est pas observée pour le dérivé chargé lysine-MCC-DM1 [5,
19]. La structure des composés générés après internalisation et dégradation des ADC basés sur l’auristatine a aussi été déterminée [
20,
21]. Les composés de type MMAE, non chargés, pourraient eux aussi traverser la membrane et agir sur les cellules voisines alors que ceux de type MMAF, étant chargés, en seraient incapables. Ce mécanisme d’action, appelé bystander effect en anglais, peut présenter un intérêt surtout dans le cas de cibles dont l’expression sur les cellules tumorales serait hétérogène. Les agents de liaison stables seraient mieux adaptés au traitement des cancers présentant une expression homogène de la cible. |
Si l’on considère les résultats très encourageants obtenus récemment lors d’études cliniques pour plusieurs immunoconjugués basés sur des agents cytotoxiques et des méthodes de couplage différents, on peut sans conteste affirmer que la technologie a aujourd’hui quasiment atteint sa pleine maturité. Le « pionnier » gemtuzumab ozogamicin, enregistré en 2000 pour le traitement de la LAM, ne devrait plus demeurer le seul immunoconjugué disponible sur le marché encore bien longtemps, et cette classe d’agents thérapeutiques devrait prochainement s’enrichir de plusieurs composés pour traiter non seulement les cancers hématologiques mais aussi les tumeurs solides. De plus, de nombreux autres immunoconjugués sont actuellement au stade préclinique et utilisent de nouveaux agents très cytotoxiques comme des analogues de la duocarmycine et de l’antibiotique CC-1065 ou encore des taxanes de seconde génération [4,
22], ainsi que les technologies décrites dans cette revue. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Schrama D, Reisfeld RA, Becker JC. Antibody targeted drugs as cancer therapeutics. Nat Rev Drug Discovery 2006; 5 : 147–59. 2. Wu AM, Senter PD. Arming antibodies : prospects and challenges for immunoconjugates. Nat Biotech 2005; 23 : 1137–46. 3. Tolcher AW, Sugarman S, Gelmon KA, et al. Randomized phase II study of BR96-doxorubicin conjugate in patients with metastatic breast cancer. J Clin Oncol 1999; 17 : 478–84. 4. Lambert JM. Drug-conjugated monoclonal antibodies for the treatment of cancer. Curr Opin Pharm 2005; 5 : 543–9. 5. Chari RVJ. Targeted cancer therapy : conferring specificity to cytotoxic drugs. Acc Chem Res 2008; 41 : 98–107. 6. Amadori S, Stasi R. Integration of monoclonal antibodies and immunoconjugates into the treatment of acute myeloid leukaemia. Curr Opin Hematol 2008; 15 : 95–100. 7. Stasi R. Gemtuzumab ozogamicin : an anti-CD33 immunoconjugate for the treatment of acute myeloid leukaemia. Expert Opin Biol Ther 2008; 8 : 527–40. 8. Walters RB, Gooley TA, Van Der Velden VH, et al. CD33 expression and P-glycoprotein-mediated drug efflux inversely correlate and predict clinical outcome in patients with acute myeloid leukaemia treated with gemtuzumab ozogamicin monotherapy. Blood 2007; 109 : 4168–70. 9. Di Joseph JF, Armellino DC, Boghaert ER, et al. Antibody-targeted chemotherapy with CMC-544 : a CD22-targeted immunoconjugate of calicheamicin for the treatment of B-lymphoid malignancies. Blood 2004; 103 : 1807–14. 10. Chan SY, Gordon AN, Coleman RE, et al. A phase 2 study of the cytotoxic immunoconjugate CMB-401 (hctM01-calicheamicin) in patient with platinum-sensitive recurrent epithelial ovarian carcinoma. Cancer Immunol Immunother 2003; 52 : 243–8. 11. Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjuguate. Cancer Res 2008; 68 : 9280–90. 12. Erickson HK, Park PU, Widdison WC, et al. Antibody-maytansinoid conjugates are activated in targeted cancer cells by lysosomal degradation and linker-dependent intracellular processing.Cancer Res 2006; 66 : 4426–33 13. Sanderson RJ, Hering MA, James SF, et al. In vivo drug-linker stability of an anti-CD30 dipeptide-linked auristatin immunoconjugate. Clin Cancer Res 2005; 11 : 843–52. 14. Tse KF, Jeffers M, Pollack VA, et al. CR011, a fully human monoclonal antibody-auristatin E conjugate, for the treatment of melanoma. Clin Cancer Res 2006; 12 : 1373–82. 15. Kovtun YV, Goldmacher VS. Cell killing by antibody-drug conjugates.Cancer Lett 2007; 255 : 232–40. 16. Polson AG, Calemine-Fenaux J, Chan P, et al. Antibody-drug conjugates for the treatment of non-Hodgkin’s lymphoma : target and linker-drug selection. Cancer Res 2009; 69 : 2358–64. 17. Law CH, Cerveny CG, Gordon KA, et al. Efficient elimination of B-lineage lymphomas by anti-CD20-auristatin conjugates. Clin Cancer Res 2004; 10 : 7842–51. 18. Ingle GS, Chan P, Elliott JM, et al. High CD21 expression inhibits internalization of anti-CD19 antibodies and cytotoxicity of antiCD19-drug conjugate. Br J Haematol 2007; 140 : 46–58. 19. Kovtun YV, Audette CA, Ye Y, et al. Antibody-drug conjugates designed to eradicate tumors with homogeneous and heterogeneous expression of the target antigen. Cancer Res 2006; 66 : 3214–21. 20. Doronina SO, Toki BE, Torgov MY, et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nat Biotechnol 2003; 21 : 778–84. 21. Doronina SO, Mendelsohn BA, Bovee TD, et al. Enhanced activity of monomethylauristatin F through monoclonal antibody delivery : effect of linker technology on efficacy and toxicity. Bioconjug Chem 2006; 17 : 114–24. 22. Ojima I. Guided molecular missiles for tumor-targeting chemotherapy : case studies using the second generation taxoids as warheads. Acc Chem Res 2008; 41 : 108–19. |