| |
| Med Sci (Paris). 2009 December; 25(12): 1057–1062. Published online 2009 December 15. doi: 10.1051/medsci/200925121057.Pharmacocinétique des anticorps monoclonaux Gilles Paintaud* Université François Rabelais de Tours, « Génétique, immunothérapie, chimie et cancer », France CNRS, UMR 6239, France ; Laboratoire de pharmacologie-toxicologie, pôle de biologie, CHRU de Tours, 2 boulevard Tonnellé, F-37044 Tours Cedex 9, France |
Comme pour les médicaments « classiques », la pharmacocinétique (PK) des Acm est étudiée lors des phases initiales de leur développement clinique (phases I et II). Cependant, pour de nombreux Acm actuellement sur le marché, la relation entre la concentration et l’effet in vivo est mal connue et les données de PK sont insuffisamment utilisées lors du choix des doses à administrer. Une meilleure connaissance de la PK est donc une étape indispensable de l’optimisation de l’utilisation thérapeutique des Acm. Ce besoin d’amélioration du schéma posologique est particulièrement net en cancérologie. Il y a au moins deux raisons à cela : d’une part, au moment de la mise sur le marché, la connaissance de l’Acm est souvent incomplète car son développement clinique a été accéléré compte tenu de la gravité de la pathologie. D’autre part, une influence de la masse tumorale sur la PK des Acm a été décrite. Si ces données sont confirmées, ce facteur pourra être pris en compte pour améliorer l’adaptation posologique individuelle. |
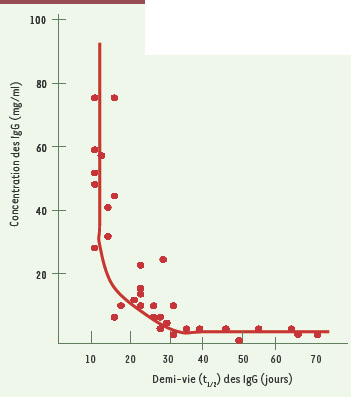
La demi-vie (t½) des IgG1, IgG2 et IgG4 chez l’homme est d’environ 21 jours alors que celle des autres immunoglobulines est comprise entre 2,5 à 7 jours. Aux doses élevées d’immunoglobulines humaines « normales » (polyclonales) utilisées en thérapeutique, l’élimination des IgG est dose-dépendante : leur t½ raccourcit lorsque leur concentration augmente (Figure 1) [
1]. Ceci s’explique par l’existence d’un récepteur spécifique et saturable les protégeant de la dégradation : le FcRn (n pour néonatal car il a initialement été mis en évidence dans l’intestin de rats nouveau-nés) (→). Chez le rat, le FcRn est présent dans les cellules épithéliales de l’intestin grêle proximal et permet l’absorption des IgG présentes dans le lait maternel. Chez la femme enceinte, le FcRn est exprimé par le syncytiotrophoblaste et transporte les IgG de la circulation maternelle aux capillaires fœtaux des villosités placentaires [
2]. Dans ces deux systèmes, le FcRn permet une transcytose à travers une couche cellulaire polarisée.
(→) voir C. Magdelaine-Beuzelin et al., page 1053
Le FcRn est présent dans les cellules endothéliales vasculaires ainsi que dans les cellules présentatrices d’antigène où il protège les IgG contre le catabolisme : les souris invalidées pour le FcRn éliminent les IgG1 plus rapidement que les souris non mutées [
3]. Un modèle PK mécanistique a permis d’estimer que, chez l’homme, le recyclage des IgG lié au FcRn est supérieur de 42 % à la production par l’organisme [
4]. La fixation des IgG au FcRn présent dans l’endothélium vasculaire permet également leur transcytose vers les tissus [2]. Le FcRn de souris est peu spécifique puisqu’il fixe les IgG de différentes espèces, alors que le FcRn humain est plus sélectif car il ne fixe que les IgG humaines, de lapin et de cochon d’inde [
5]. Ceci explique pourquoi les IgG murines comme l’Acm muromonab-CD3 ont une t½ d’environ 1 jour chez les patients traités.  | Figure 1.
Relation entre la concentration sérique des immunoglobulines G et leur demi-vie (adapté d’après [
41]). |
|
Devenir des Acm dans l’organisme Les Acm sont des protéines de haut poids moléculaire, caractérisées par leur hydrophilie. Bien que leur devenir dans l’organisme soit différent de celui des médicaments classiques, on peut décrire des phases d’absorption, de distribution et d’élimination. Absorption La majorité des Acm est administrée par voie intraveineuse (IV), ce qui permet l’injection de larges volumes et une exposition systémique rapide et complète. Cependant, certains d’entre eux tels que l’adalimumab, l’omalizumab et le palivizumab sont administrés par voie sous-cutanée (SC) ou intramusculaire (IM). En général, après administration SC, les macromolécules d’une taille supérieure à 16 kDa sont majoritairement absorbées par le système lymphatique alors que celles d’une taille inférieure à 2 kDa sont majoritairement absorbées par les vaisseaux sanguins [
6]. Cependant, le mécanisme d’absorption des IgG après administration SC est encore incertain car il n’a jamais été directement étudié [
7]. Le FcRn pourrait jouer un rôle dans l’absorption SC des Acm car, dans un modèle de souris invalidée pour le FcRn, la fraction absorbée était beaucoup plus faible (28 %) que chez les souris non mutées (83 %) [ 7]. Après administration SC chez l’homme, l’absorption des Acm est lente, avec un pic de concentration survenant cinq à dix jours après l’injection, et la fraction absorbée représente en moyenne de 50 à 100 % de la dose injectée. Un des inconvénients de ces voies, SC ou IM, est qu’elles ajoutent une source supplémentaire de variabilité PK. Le ranibizumab est un fragment Fab d’anticorps humanisé anti-VEGF (vascular endothelial growth factor) qui est administré directement dans le vitré de l’œil dans le traitement de la forme néovasculaire (humide) de la dégénérescence maculaire liée à l’âge (→). Le ranibizumab passe dans la circulation systémique, bien que ses concentrations sériques soient faibles [
8]. Le bévacizumab, une IgG1κ anti-VEGF, est également utilisé dans la même indication hors autorisation de mise sur le marché. L’évaluation de cet Acm « complet » dans les modèles animaux a montré que, comme l’Acm Fab ranibizumab, il pénètre dans la rétine après injection intravitréenne [
9] et qu’il peut être mesuré dans le sérum [
10], ce qui est compatible avec la présence du FcRn dans les tissus de l’œil, rapportée chez le rongeur [
11].
(→) voir N. Leveziel et al., page 1105 ; J. Biot et al., page 1177
La voie inhalée a également été testée car le FcRn est exprimé dans les poumons [2,
12]. Après administration d’omalizumab par aérosol chez des patients asthmatiques, des concentrations sériques ont pu être mesurées mais l’effet thérapeutique était insuffisant [
13]. La voie pulmonaire a également été testée pour l’administration de protéines de fusion comportant une portion Fc, telles que l’érythropoïétine-Fc [
14]. Distribution Les études de distribution (souvent appelée biodistribution) des Acm ont pour objectifs d’analyser la spécificité de leur ciblage tissulaire ainsi que d’identifier les principaux organes d’élimination. •Échanges tissus-plasma Par leur grande taille et leur caractère hydrophile, les IgG ont une faible pénétration tissulaire et sont essentiellement confinées dans la circulation sanguine et les liquides extracellulaires [ 6]. Dans beaucoup de tissus, les concentrations d’IgG libres sont environ dix fois plus faibles que celles qui sont mesurées dans le plasma. Cependant, des concentrations plus élevées sont observées dans les tissus ayant une vascularisation fenestrée 1, comme la moelle osseuse et la rate [ 7]. Comme nous l’avons décrit plus haut, le FcRn permet le passage des Acm à travers le placenta. Ceci a été confirmé par le cas clinique d’une mère atteinte d’un lymphome et traitée par rituximab (Acm anti-CD20) associé à une chimiothérapie pendant sa grossesse : à la naissance, les concentrations sériques de rituximab étaient similaires chez la mère (20 mg/l) et chez le nouveau-né (30 mg/l) [
15]. Le FcRn est fortement exprimé par l’endothélium du système nerveux central (SNC) et par les plexus choroïdes. Plutôt que de transporter les IgG vers le SNC, le FcRn est probablement responsable d’une transcytose des IgG du SNC vers la circulation [2]. Une étude chez le singe a montré qu’après administration IV, le rituximab était mesuré dans le liquide céphalo-rachidien à des concentrations mille fois plus faibles que celles mesurées dans le sang [
16]. Dans la même étude, le rituximab administré par voie intrathécale était rapidement éliminé du liquide céphalorachidien et mesurable dans le sérum [16]. Le rôle du FcRn dans cet efflux des IgG reste cependant à confirmer [7]. •Ciblage tissulaire Dans le traitement du cancer, le ciblage thérapeutique est particulièrement important. On étudie souvent la distribution dans les tumeurs et dans les tissus sains en utilisant des Acm marqués par un radio-isotope. Ces études sont cependant peu informatives car la dégradation par les protéases de l’anticorps marqué complique l’interprétation des résultats. La méthode de référence pour étudier la distribution tissulaire est l’étude de la réactivité tissulaire croisée dans laquelle la fixation de l’Acm sur différents tissus humains et animaux est analysée [
17]. La relation entre l’affinité d’un Acm pour son antigène et sa concentration dans la tumeur est complexe : en effet, l’intensité de la captation tumorale peut être inversement proportionnelle à l’affinité de l’Acm pour son antigène cible [
18]. Ce phénomène appelé « barrière du site de fixation » s’explique par la rétention de l’Acm par les antigènes cibles présents en périphérie, avec pour conséquence une mauvaise pénétration de l’Acm dans le tissu [ 7]. Cependant, ce phénomène peut en théorie être surmonté par une augmentation de la dose d’Acm. Les Fab et les fragments simple chaîne Fv d’anticorps (ScFv) pénètreraient mieux dans les tissus que les Acm complets mais leur rapide élimination de l’organisme (voir ci-dessous) pourrait contrebalancer cette meilleure distribution (→).
(→) voir P. Chames et D. Baty, page 1159
Après administration IV, les concentrations sériques d’Acm décroissent généralement de façon bi-exponentielle : une phase de décroissance rapide (correspondant à la distribution) précédant une phase de décroissance plus lente (correspondant à l’élimination). Dans ce cas, les concentrations d’Acm peuvent être décrites à l’aide d’un modèle PK à deux « compartiments » : un compartiment central, correspondant habituellement au sang circulant et aux milieux dans lesquels la concentration s’équilibre rapidement avec celle du sang, et un compartiment périphérique, correspondant aux milieux dans lesquels la concentration s’équilibre plus lentement. Cependant, lorsque l’Acm est éliminé de façon significative par la fixation sur sa cible (voir plus bas), son volume de distribution est difficile à estimer par les méthodes conventionnelles [7]. Élimination L’élimination des IgG se fait essentiellement par catabolisme intracellulaire, une fois qu’elles ont été captées dans la cellule par pinocytose (endocytose de phase liquide) ou endocytose secondaire à leur fixation sur leur cible ou sur un récepteur. •Pinocytose Comme les autres protéines circulantes ou présentes dans le liquide interstitiel, les IgG sont captées par pinocytose ( cell drinking) mais le FcRn les protège contre la dégradation (→). Lorsque les concentrations d’IgG sont élevées, le FcRn peut être saturé : chez des patients ayant un myélome, qui ont des concentrations sériques d’IgG pouvant approcher 100 mg/ml, la t ½ de ces IgG est raccourcie à 8-10 jours au lieu des 21 jours dans le cas d’une concentration normale d’IgG. Inversement, chez les patients ayant des concentrations très faibles d’IgG, cette t ½ peut atteindre 70 jours ou plus [ 7]. La portion Fc des IgG est impliquée dans leur fixation au FcRn et donc dans leur t ½ prolongée. Les fragments d’anticorps tels que les Fab ou les F(ab) 2 ont une t ½ plus courte et une clairance plus élevée que les anticorps complets correspondants [
19]. L’abciximab, qui est un fragment Fab d’un Acm chimérique anti-CD41, a une très courte t ½ de 20-30 minutes dans le sérum et de 4 heures dans les plaquettes. Les t ½ des fragments Fc sont similaires à celles des IgG complètes [
20].
(→) voir C. Magdelaine-Beuzelin et al., page 1053
• Élimination après fixation sur leur cible ou sur un récepteur L’endocytose de l’Acm peut être l’étape suivant sa fixation, par ses domaines Fab, sur son antigène cible à la surface d’une cellule. Lorsque ce phénomène est prépondérant, on parle d’élimination cible dépendante ( target-mediated drug disposition). L’élimination cible dépendante est, par définition, saturable, puisqu’il y a un nombre fini de cibles. La PK devient alors dose-dépendante, ce qui s’exprime par une élimination plus rapide pour les faibles doses (clairance plus élevée et t ½ plus courte). Cette dose-dépendance a été décrite pour le bévacizumab [
21], le cétuximab [
22] et plusieurs autres Acm anticancéreux [ 7] mais elle n’est pas toujours pertinente aux doses thérapeutiques utilisées. L’analyse des concentrations sériques au cours du temps montre une accélération de leur décroissance lorsque celles-ci deviennent proches de la quantité de cibles disponibles : la pente de décroissance log-linéaire des concentrations est alors remplacée par une courbe convexe vers le haut. Ces phénomènes ont été décrits par modélisation compartimentale en ajoutant un phénomène d’élimination saturable (équation de Michaelis-Menten) au modèle bi-compartimental classique [
23]. Les Acm pourraient également être internalisés après fixation de leur portion Fc sur un récepteur Fcγ présent à la surface de la cellule. Cependant, ce mécanisme concernerait principalement les complexes immuns [7]. |
Extrapolation interespèces Comme pour les petites molécules, une première estimation des paramètres PK des Acm chez l’homme peut être réalisée à partir des données obtenues chez l’animal et par calcul allométrique [7]. Cependant, il existe de nombreuses sources de discordance, notamment des différences interespèces en ce qui concerne l’expression ou le renouvellement de la cible, l’affinité de l’Acm pour la cible, la fixation de l’Acm sur le FcRn, les concentrations d’IgG endogènes et l’apparition d’anticorps induits [7]. |
Variabilité PK interindividuelle Conséquences de la variabilité PK Une partie de la variabilité interindividuelle de réponse thérapeutique aux Acm est expliquée par la variabilité de l’exposition individuelle [
24]. Cette variabilité PK, observée pour tous les Acm, est pertinente en clinique puisque les concentrations sériques d’anticorps influencent la réponse thérapeutique : c’est le cas pour les Acm suivants : adalimumab [
25], alemtuzumab [
26], cétuximab [
27], infliximab [
28], rituximab [
29] et trastuzumab [
30]. Influence des facteurs démographiques L’influence du poids du patient sur la PK des Acm a été décrite pour de nombreux anticorps mais d’autres facteurs démographiques ou biologiques ont été identifiés : la surface corporelle influence la PK du rituximab [
31] et le sexe influence celle du bévacizumab [ 8], de l’infliximab [
32] et du rituximab [ 31]. Chez les patients dont l’albuminémie est basse et les phosphatases alcalines élevées (deux indicateurs de sévérité de la maladie dans le cancer colorectal métastatique), la clairance du bévacizumab est augmentée par rapport aux patients ayant des valeurs biologiques médianes [ 8]. Influence de la masse antigénique Comme une partie de l’élimination des Acm est liée à leur fixation sur un antigène cible, la variation interindividuelle et intra-individuelle (au cours du temps) de la maladie, et donc de la masse antigénique, peut influencer la PK des Acm. Ceci est bien démontré pour l’omalizumab, un anticorps anti-IgE, puisque la dose à administrer doit être adaptée au poids des patients et à la concentration en IgE [
33]. Chez des patients atteints de polyarthrite rhumatoïde et traités par infliximab, la CRP ( C reactive protein) pré-thérapeutique a été utilisée comme marqueur indirect de la production de TNF-α ( tumor necrosis factor) [
34]. Les auteurs ont observé des concentrations d’Acm significativement plus faibles chez les patients ayant des concentrations pré-thérapeutiques de CRP élevées. De nombreux antigènes cibles membranaires existent aussi sous forme soluble. C’est notamment le cas de HER2 ( human epidermal growth factor receptor 2), l’antigène cible du trastuzumab, dont le domaine extracellulaire, HER2-ECD pour extracellular domain, est présent dans la circulation. Une relation inverse a été observée entre les concentrations sériques de HER2-ECD et les concentrations sériques de trastuzumab [
35]. Les études analysant l’influence de la masse tumorale sur la PK du rituximab dans le lymphome malin non hodgkinien ont donné des résultats contradictoires, ce qui pourrait être expliqué par la difficulté à évaluer de façon précise la masse tumorale en pratique clinique [
36] (→). L’influence de la masse tumorale sur la relation dose-concentration-effet du rituximab a été étudiée à l’aide d’un modèle murin développant un lymphome exprimant le CD20 humain [
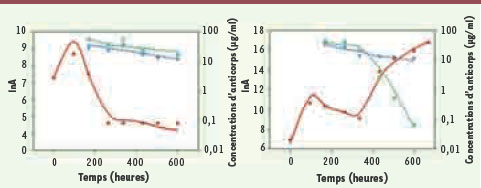
37]. Les concentrations sériques de rituximab étaient inversement corrélées à la masse tumorale, les souris avec une masse tumorale faible ayant des concentrations élevées. Ceci est présenté dans la Figure 2 : les concentrations d’infliximab (ne reconnaissant aucune cible dans ce modèle murin) et de rituximab ont une décroissance log-linéaire chez les souris ayant une réponse totale. Chez les souris ayant une réponse transitoire, suivie d’une nouvelle croissance de la masse tumorale, les concentrations d’infliximab ne sont pas modifiées alors que l’élimination du rituximab est accélérée. Il a par ailleurs été montré que le nombre de sites métastatiques influence la PK du trastuzumab chez les patientes traitées [35].  | Figure 2.
Influence de la masse tumorale sur la pharmacocinétique des Acm. L’influence de la masse tumorale (ronds rouges, exprimée en ln d’activité) sur la relation dose-concentration-effet du rituximab a été étudiée à l’aide d’un modèle murin développant un lymphome exprimant le CD20 humain [ 37]. Les concentrations d’infliximab (ne reconnaissant aucune cible dans ce modèle murin, losanges bleus) et de rituximab (carrés verts) ont une décroissance log-linéaire chez les souris ayant une réponse totale (figure de gauche). Chez les souris ayant une réponse transitoire, suivie d’une nouvelle croissance de la masse tumorale, les concentrations d’infliximab ne sont pas modifiées alors que l’élimination du rituximab est accélérée (figure de droite). |
(→) voir G. Cartron et J.F. Rossi, page 1085
Pour décrire l’interdépendance entre la PK et la pharmacodynamie, des modèles pharmacocinétiques-pharmacodynamiques (PK-PD) spécifiques doivent être développés [37,
38]. Influence des anticorps induits Le développement d’anticorps anti-infliximab chez les patients traités par infliximab a été bien documenté. Un des facteurs de risque de cette immunisation est le sous-dosage des patients. En effet, les concentrations d’anticorps anti-infliximab mesurées 6 mois après le début du traitement chez des patients ayant une polyarthrite rhumatoïde étaient d’autant plus élevées que les concentrations d’infliximab, mesurées 1 mois et demi après l’initiation, étaient faibles [ 34]. La clairance de l’infliximab est 2,7 fois plus élevée et sa t½ d’élimination 34 % plus faible en présence d’anticorps anti-infliximab [ 32]. Une diminution significative des concentrations d’adalimumab, un autre Acm anti-TNF-α, a également été rapportée chez les patients traités pour polyarthrite rhumatoïde et ayant développé des anticorps anti-adalimumab [ 25]. L’administration d’immunosuppresseurs associés (en général méthotrexate ou azathioprine) diminue l’incidence des anticorps anti-infliximab. Les concentrations d’infliximab sont plus élevées chez les patients cotraités par méthotrexate [
39]. Ceci pourrait être expliqué par la diminution du risque de développer des anticorps anti-infliximab, mais un autre mécanisme ne peut être exclu. Une étude comparative a analysé, chez des patients ayant une maladie de Crohn et traités depuis au moins 6 mois par infliximab associé à un immunosuppresseur, l’influence de l’arrêt de l’immunosuppresseur associé sur l’efficacité du traitement [
40]. L’efficacité clinique s’est maintenue pendant les deux années de suivi mais une augmentation significative de la concentration de CRP et une baisse significative de la concentration sérique d’infliximab a été observée dans le groupe ayant arrêté l’immunosuppresseur associé. |
Les Acm sont des biomédicaments dont la PK doit être suffisamment bien connue pour permettre un choix rationnel de leur dose en thérapeutique. Cependant, leur devenir dans l’organisme, et notamment leur distribution, est encore mal connu. Ceci est lié à la difficulté de disposer de modèles animaux pertinents et aux limitations des études utilisant des Acm marqués. Lorsque, en raison de la dose utilisée ou du délai entre les injections, la PK devient dépendante de l’antigène cible, des modèles PK spécifiques ainsi que des modèles décrivant l’interrelation entre PK et pharmacodynamie doivent être utilisés. Les sources de variabilité pharmacocinétique interindividuelle commencent à être identifiées et leur influence mériterait d’être mieux intégrée dans l’adaptation posologique individuelle. Dans les pathologies sévères qui sont les indications habituelles des Acm, le suivi de la concentration sérique de l’Acm permettrait d’adapter la posologie afin de contrôler l’exposition des patients et donc d’optimiser la thérapeutique. De plus, si l’influence de la masse tumorale sur la PK des Acm anticancéreux est confirmée, des essais cliniques devront être réalisés afin d’étudier l’intérêt d’une augmentation des doses chez les patients ayant une masse tumorale élevée. |
L’auteur déclare avoir participé à des interventions ponctuelles pour les entreprises Roche Pharma, LFB, Pierre Fabre.
|
Footnotes |
1. Junghans RP. Finally! The Brambell receptor (FcRB). Mediator of transmission of immunity and protection from catabolism for IgG. Immunol Res 1997; 16 : 29–57. 2. Roopenian DC, Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 2007; 7 : 715–25. 3. Montoyo HP, Vaccaro C, Hafner M, et al. Conditional deletion of the MHC class I-related receptor FcRn reveals the sites of IgG homeostasis in mice. Proc Natl Acad Sci USA 2009; 106 : 2788–93. 4. Kim J, Hayton WL, Robinson JM, Anderson CL. Kinetics of FcRn-mediated recycling of IgG and albumin in human: pathophysiology and therapeutic implications using a simplified mechanism-based model. Clin Immunol 2007; 122 : 146–55. 5. Ober RJ, Radu CG, Ghetie V, Ward ES. Differences in promiscuity for antibody-FcRn interactions across species: implications for therapeutic antibodies. Int Immunol 2001; 13 : 1551–9. 6. Tang L, Meibohm B. Pharmacokinetics of peptides and proteins. In : Meibohm B, ed. Pharmacokinetics and pharmacodynamics of biotech drugs. Weinheim : Wiley-VCH Verlag GmbH and Co, 2006 : 17–43. 7. Wang W, Wang EQ, Balthasar JP. Monoclonal antibody pharmacokinetics and pharmacodynamics. Clin Pharmacol Ther 2008; 84 : 548–58. 8. EMEA. Avastin product information. Human Medicines 2008. 9. Heiduschka P, Fietz H, Hofmeister S, et al. Penetration of bevacizumab through the retina after intravitreal injection in the monkey. Invest Ophthalmol Vis Sci 2007; 48 : 2814–23. 10. Bakri SJ, Snyder MR, Reid JM, et al. Pharmacokinetics of intravitreal bevacizumab (Avastin). Ophthalmology 2007; 114 : 855–9. 11. Kim H, Fariss RN, Zhang C, et al. Mapping of the neonatal Fc receptor in the rodent eye. Invest Ophthalmol Vis Sci 2008; 49 : 2025–9. 12. Spiekermann GM, Finn PW, Ward ES, et al. Receptor-mediated immunoglobulin G transport across mucosal barriers in adult life: functional expression of FcRn in the mammalian lung. J Exp Med 2002; 196 : 303–10. 13. Fahy JV, Cockcroft DW, Boulet LP,et al. Effect of aerosolized anti-IgE (E25) on airway responses to inhaled allergen in asthmatic subjects. Am J Respir Crit Care Med 1999; 160 : 1023–7. 14. Bitonti AJ, Dumont JA. Pulmonary administration of therapeutic proteins using an immunoglobulin transport pathway. Adv Drug Deliv Rev 2006; 58 : 1106–18. 15. Decker M, Rothermundt C, Hollander G, et al. Rituximab plus CHOP for treatment of diffuse large B-cell lymphoma during second trimester of pregnancy. Lancet Oncol 2006; 7 : 693–4. 16. Rubenstein JL, Combs D, Rosenberg J, et al. Rituximab therapy for CNS lymphomas: targeting the leptomeningeal compartment. Blood 2003; 101 : 466–8. 17. Muller PY, Brennan FR. Safety assessment and dose selection for first-in-human clinical trials with immunomodulatory monoclonal antibodies. Clin Pharmacol Ther 2009; 85 : 247–58. 18. Verel I, Heider KH, Siegmund M, et al. Tumor targeting properties of monoclonal antibodies with different affinity for target antigen CD44V6 in nude mice bearing head-and-neck cancer xenografts. Int J Cancer 2002; 99 : 396–402. 19. Reff ME, Heard C. A review of modifications to recombinant antibodies: attempt to increase efficacy in oncology applications. Crit Rev Oncol Hematol 2001; 40 : 25–35. 20. Schror K, Weber AA. Comparative pharmacology of GP IIb/IIIa antagonists. J Thromb Thrombolysis 2003; 15 : 71–80. 21. Gordon MS, Margolin K, Talpaz M, et al. Phase I safety and pharmacokinetic study of recombinant human anti-vascular endothelial growth factor in patients with advanced cancer. J Clin Oncol 2001; 19 : 843–50. 22. Baselga J, Pfister D, Cooper MR, et al. Phase I studies of anti-epidermal growth factor receptor chimeric antibody C225 alone and in combination with cisplatin. J Clin Oncol 2000; 18 : 904–14. 23. Dirks NL, Nolting A, Kovar A, Meibohm B. Population pharmacokinetics of cetuximab in patients with squamous cell carcinoma of the head and neck. J Clin Pharmacol 2008; 48 : 267–78. 24. Ternant D, Paintaud G. Pharmacokinetics and concentration-effect relationships of therapeutic monoclonal antibodies and fusion proteins. Expert Opin Biol Ther 2005; 5 : S37–47. 25. Bartelds GM, Wijbrandts CA, Nurmohamed MT, et al. Clinical response to adalimumab: relationship to anti-adalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis. Ann Rheum Dis 2007; 66 : 921–6. 26. Hale G, Rebello P, Brettman LR, et al. Blood concentrations of alemtuzumab and antiglobulin responses in patients with chronic lymphocytic leukemia following intravenous or subcutaneous routes of administration. Blood 2004; 104 : 948–55. 27. Fracasso PM, Burris H 3rd, Arquette MA, et al. A phase 1 escalating single-dose and weekly fixed-dose study of cetuximab: pharmacokinetic and pharmacodynamic rationale for dosing. Clin Cancer Res 2007; 13 : 986–93. 28. St Clair EW, Wagner CL, Fasanmade AA, et al. The relationship of serum infliximab concentrations to clinical improvement in rheumatoid arthritis: results from ATTRACT, a multicenter, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2002; 46 : 1451–9. 29. Igarashi T, Kobayashi Y, Ogura M, et al. Factors affecting toxicity, response and progression-free survival in relapsed patients with indolent B-cell lymphoma and mantle cell lymphoma treated with rituximab: a Japanese phase II study. Ann Oncol 2002; 13 : 928–43. 30. Baselga J. Phase I and II clinical trials of trastuzumab. Ann Oncol 2001; 12 : S49–55. 31. Ng CM, Bruno R, Combs D, Davies B. Population pharmacokinetics of rituximab (anti-CD20 monoclonal antibody) in rheumatoid arthritis patients during a phase II clinical trial. J Clin Pharmacol 2005; 45 : 792–801. 32. Ternant D, Aubourg A, Magdelaine-Beuzelin C, et al. Infliximab pharmacokinetics in inflammatory bowel disease patients. Ther Drug Monit 2008; 30 : 523–9. 33. Slavin RG, Ferioli C, Tannenbaum SJ, et al. Asthma symptom re-emergence after omalizumab withdrawal correlates well with increasing IgE and decreasing pharmacokinetic concentrations. J Allergy Clin Immunol 2009; 123 : 107–13 e3. 34. Bendtzen K, Geborek P, Svenson M, et al. Individualized monitoring of drug bioavailability and immunogenicity in rheumatoid arthritis patients treated with the tumor necrosis factor alpha inhibitor infliximab. Arthritis Rheum 2006; 54 : 3782–9. 35. Bruno R, Washington CB, Lu JF, et al. Population pharmacokinetics of trastuzumab in patients with HER2+ metastatic breast cancer. Cancer Chemother Pharmacol 2005; 56 : 361–9. 36. Cartron G, Blasco H, Paintaud G, et al. Pharmacokinetics of rituximab and its clinical use: thought for the best use ? Crit Rev Oncol Hematol 2007; 62 : 43–52. 37. Dayde D, Ternant D, Ohresser M, et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modelling using a syngeneic bioluminescent murine model expressing human CD20. Blood 2009; 113 : 3765–72. 38. Ng CM, Stefanich E, Anand BS, et al. Pharmacokinetics/pharmacodynamics of nondepleting anti-CD4 monoclonal antibody (TRX1) in healthy human volunteers. Pharm Res 2006; 23 : 95–103. 39. Maini RN, Breedveld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumor necrosis factor alpha monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998; 41 : 1552–63. 40. Van Assche G, Magdelaine-Beuzelin C, D’Haens G, et al. Withdrawal of immunosuppression in Crohn’s disease treated with scheduled infliximab maintenance: a randomized trial. Gastroenterology 2008; 134 : 1861–8. 41. Kuester K, Kloft C. Pharmacokinetics of monoclonal antibodies. In : Meibohm B, ed. Pharmacokinetics and pharmacodynamics of biotech drugs. Weinheim : Wiley-VCH Verlag, 2006. |